根据等温吸附模型进行水分状态分析的可行性
——以糯米粉的水分解吸为例
2018-03-20段瑞谦赵学伟冯志强
张 华,段瑞谦,赵学伟,冯志强
(1.郑州轻工业学院食品与生物工程学院,河南 郑州 450002;2.河南省食品生产与安全协同创新中心,河南 郑州 450002;3.河南省冷链食品质量安全控制重点实验室,河南 郑州 450002;4.三全食品有限公司,河南 郑州 450044)
从分子水平上看,食品中被吸附的水分子各自处于不同的位置。例如,对于多层吸附,水分子可以位于不同的吸附层,即使在同一层内,也可能有不同的排列方式。由于处于不同的空间位置,食品基质-水、水-水之间相互作用也就不同,这就意味着不同水分子处于不同的能量状态。水分在不同状态之间的分配及每个状态的性质对食品及其原料十分重要。例如:休闲食品在水分含量高于单分子层水分时将失去脆性[1];水分子成簇将会减缓其在食品内的扩散速率[2];处于不同水分含量时具有不同的吸附热[3],实际上是水分在不同状态之间的分配不断变化的结果。
作为一个表面现象,水分吸附是食品基质-水、水-水之间相互作用的结果。因此,等温吸附数据必然蕴含体现相互作用双方的性质及相互作用自身性质的信息,通过理论分析可以获取这些信息。最简单的例子是可以根据BET或GAB方程估算单分子层水分含量。根据等温吸附数据可以分析食品的孔特性[4]。美国农业生物工程师学会推荐的5 个模型在食品领域被广泛采用[5],但这些多是经验模型,虽可方便用于工程设计计算,却不能给出关于水分状态的更多信息。
生物大分子食品的等温吸附类型属BET分类中的Ⅱ型吸附。根据等温曲线的特点可将其分为3 个区域:Ⅰ区位于水分活度(aw)较低的区域,为一相对于aw轴呈凸形的曲线,通常采用Langmuir或Freundlich模型来描述;Ⅱ区的aw位于中间区域,为线性或接近线性的曲线,Henry定律描述的就是一个线性关系;Ⅲ区位于aw较高的区域,是快速向aw轴弯曲的部分,Raoult[6]、Kelvin[7]、Flory-Huggins理论[8]等都曾被用来描述该区域内水分含量与aw的关系。这样,就出现了一类等温吸附模型(称为组合模型),认为吸附的总水分含量为各组分贡献之和,而每个组分的吸附遵循不同的规律(如Langmuir方程、Henry定律或Raoult定律等)。组合模型在合成大分子材料及多孔性材料等非食品物料的吸附特性研究中经常被采用[9-11],而在食品研究中应用较少。其实,常见的BET、GAB方程也可写为组合模型的形式[12],但对于食品来说在aw分别高于0.45、0.90时,这两个方程的预测结果明显较低;Young-Nelson模型在最早提出时是一个用来描述小麦水分吸附的组合模型[13],但在食品领域的应用也很少。
由于组合模型的各分项分别描述的是遵循不同规律的水分,这些吸附规律体现的是水分-吸附质之间相互作用的强弱等信息,也就是水分被吸附后所处的能量状态。因此,以组合模型对实验数据进行拟合,则可根据模型参数推断各水分状态的特点,以及总水分在不同状态间的分布及其变化。在食品研究中,用于分析水分状态分布的等温吸附模型通常是Henderson模型[14-15]和Caurie模型[16-18]。与组合模型不同,这两个模型都认为在一定的aw范围内仅存在一种状态的水分。在根据等温吸附数据进行水分状态分析之前要先确定最适模型;模型对实验数据的拟合度是判定最适模型的常用指标[19]。其中一些文献甚至没有进行不同模型间的拟合度比较[10,20]。实际上,可以体现水分状态的等温吸附模型有多种,可能不只一个模型能够很好地拟合实验结果,而这些模型对水分状态的描述可能存在很大差异。
本研究针对糯米粉的等温解吸数据,采用DW(D’arcy & Watt)、Park、Y-B、Y-N 4 种组合模型以及Henderson模型和Caurie模型对实验数据进行拟合,旨在阐述根据等温吸附模型进行水分状态分析的可行性和局限性,并讨论如何正确使用等温吸附模型进行水分状态分析。
1 材料与方法
1.1 材料
糯米粉购自郑州市华联超市,经测定其组分含量为:蛋白质8.08%(以干基计,下同)、粗脂肪1.11%、粗纤维0.92%、灰分0.90%、碳水化合物88.99%(差减法)。将糯米粉与适量的水混合,使最终的水分含量为45%(以湿基计),调质3 h后用于解吸实验。
1.2 方法
1.2.1 糯米粉解吸平衡水分的测定
[4]的方法,采用静态称质量法在不同温度(10、20、30 ℃)及aw下测定糯米粉的解吸平衡水分。
1.2.2 模型拟合
1.2.2.1 DW模型
DW模型是一个多层吸附模型,认为水分与不同一级吸附位点(位于固体表面上的吸附部位)的结合强度存在差异。水分在强结合一级位点发生吸附的同时,也一定程度上在弱结合一级位点发生吸附。水分子还在二级位点(吸附在一级位点上的水分子)发生多层吸附,且认为只有一种二级位点[21](式(1))。
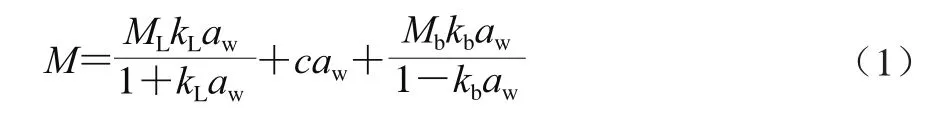
式中:M为平衡水分含量/(g/g);aw为水分活度;ML为强结合位点的最大吸附量/(g/g);kL为水分在强结合位点的吸附平衡常数;c为弱结合位点的最大吸附量/(g/g);Mb为二级位点的最大吸附量/(g/g);kb为水分在二级结合位点的吸附平衡常数。
式(1)等号右侧的第一项表示强结合单层水,其吸附遵循Langmuir方程;第二项为弱结合单层水,由于吸附速率低,可近似认为吸附量与aw之间呈线性关系,采用Henry定律的形式来表示;第三项为多层吸附水,其吸附遵循Rauolt定律。
1.2.2.2 Y-B模型
Yanniotis和Blahovec将食品中的水分分为两部分:吸附在内部不溶性固体物质表面吸附位点上的单分子层水(称为强结合水)和作为溶剂溶解固体中低分子糖、盐、蛋白等可溶性成分的溶剂水,其表达式见式(2)[22]。

式中:a1、b1、a2、b2为模型参数。等号右侧第一项表示强结合水,第二项表示溶剂水。1.2.2.8节中的分析显示,实际上第一项是Langmuir方程的形式,第二项为Raoult定律的形式。
1.2.2.3 Park模型
Park模型认为一部分水与基质表面特定结合,用Langmuir方程表示;一部分水起溶剂作用,其溶解能力符合Henry定律;根据Henry定律吸附的水分子进一步发生成簇反应:nH2O·(H2O2),最后推导出式(3)。
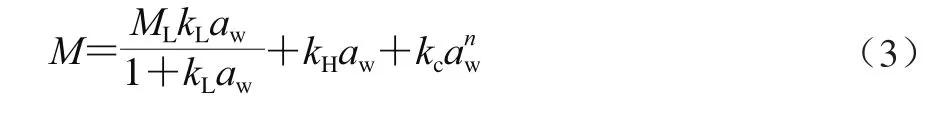
式中:kc为成簇反应的平衡常数;kH为Henry常数;n为平均每个水分子簇中水分子的个数[23]。
1.2.2.4 Y-N模型
Y-N模型是Young和Nelson于1967年提出的一个用于描述小麦等温吸湿的模型[13]。其认为干物质暴露于湿空气时,水分子首先吸附在组织细胞表面形成单分子层水。随吸附进行,单分子层外出现多层水。单分子层既受到表面结合力又受到扩散力的作用,扩散力倾向于将其转移到细胞内部。随单分子层外吸附的多分子层水分增多,扩散力增大,最终超过结合力的作用,使单分子水分转移至细胞内部,形成吸收水。对于水分解吸平衡,存在如下关系式(式(4)~(6))。
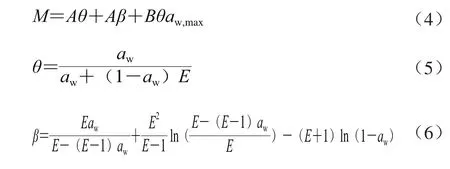
式中:θ为被单分子层覆盖的表面积分数;Aθ为单分子吸附层水分含量/(g/g);Aβ为位于单分子层外的被吸附的水分含量/(g/g);aw,max为水分活度最大值;Bθaw,max为被吸收水分含量/(g/g);A、B、E为模型参数。
1.2.2.5 Caurie模型
Caurie模型认为,水分在表面不是以多层而是单层的形式存在,只是由于不同吸附位点与水的结合作用强弱不同,分为强结合水、弱结合水和松散结合水。Caurie通过对BET方程的转换提出如式(7)所示的等温吸附模型[21]。

式中:M0为强结合水的含量/(g/g);C为Caurie常数;n为100 g干物质中位于单分子层内的水的体积。对方程(7)的进一步分析,Caurie指出:强结合水不能被冻结,不能作为溶剂,对应的aw为aw,M0=1/(1+C1/2);弱结合水含量为M0(n-1),不能被冻结但可起溶剂作用,对应的aw为aw,nM0=1/(1+C/);总结合水含量为,对应的aw为=1/(1+);松散结合水的含量为-M0n=M0(M0-n),这部分水可被冻结[23]。
1.2.2.6 Henderson模型
Henderson模型是一个经验模型,见式(8)。

式中:a、b为模型参数。Rockland通过对多种食品体系的研究发现,以lg(100M)为横坐标、以lg(-ln(1-aw))为纵坐标作图,数据点不在一条直线上,而是出现有1 个或2 个折点[14]。有2 个折点时,其将所有水分为3 个区域,aw从低到高分别为单层结合水、多层结合水、自由水。
1.2.2.7 温度对吸附平衡常数的影响
组合模型中各吸附平衡常数(以k表示)与温度之间符合van’t Hoff关系式(9)[8,11]。

式中:k0为指前因子;Q为水分在相应位点发生吸附时的吸附热/(kJ/mol)。Q更为量化地反映了不同状态水分与吸附位点之间结合作用的大小。
1.2.2.8 对组合模型的分析
关于Y-B模型,其表达式可转变为式(10)。
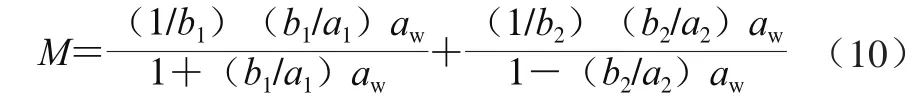
如果定义1/b1=ML,b1/a1=kL,1/b2=Mb,b2/a2=kb,可以看出,上式中第一项为Langmuir方程的形式,第二项为Raoult定律的形式。因此,Y-B模型实际上是DW模型在忽略Henry项后的变形形式。
关于Y-N模型,其中的单分子吸附层水分表达式可转变为式(11)。
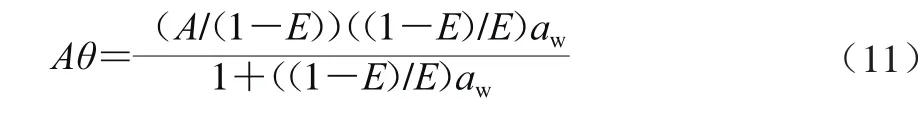
可以看出,该式仍是Langmuir方程的形式,其中kL=(1-E)/E,ML=A/(1-E)。关于吸收水分项Bθaw,max,也可转化为Langmuir方程的形式,只是这时的强结合水含量为Baw,max/(1-E),用表示,而kL=(1-E)/E仍成立。因此,可以将Y-N模型中的单层水及吸收水看作是两个都遵循Langmuir规律的吸附过程,两过程的吸附速率常数相等而最大吸附量不等。
关于多层吸附水,2.1节的分析显示方程(6)中等号右侧前两项的数值很小,暂且忽略。由于ln(1-aw)可展开为幂级数:ln(1-aw)=-aw-…,则多层吸附水可表示为式(12)。
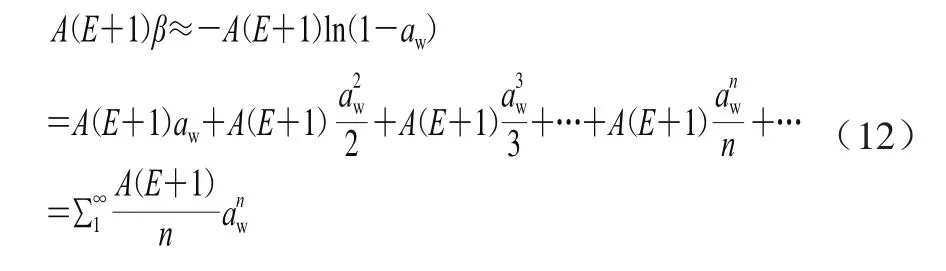
因此,Y-N模型中的这部分水可以看作是无穷多个水分子成簇反应的结果,各反应的级数为n,速率常数为A(E+1)/n。再结合前面的分析,则可以将Y-N模型中的水分看作是两类Langmuir吸附水与多种成簇水的总和。
这样,4 个组合模型中不同状态水分所遵循的规律可归结为:Langmuir方程、Henry定律、Raoult定律或水分成簇反应。不同组合模型对水分的各种分类与其所遵循规律之间的对应关系见表1。

表1 组合模型中各状态水分所遵循的吸附规律Table1 Laws describing the adsorption of water in different states for composite models
不同组合模型都是根据水分与固体基质间结合作用的强弱对水分进行分类。由于不同模型有不同的假设前提,各状态水分的名称不尽相同,实际含义也存在差异。例如:DW中的Henry项实际上是对Langmuir吸附在吸附速率很低时的线性近似,是直接吸附在基质表面上的水分;而Park模型、Y-B模型中的Henry项则是起溶剂作用的溶液水;DW模型、Y-B模型尽管都采用相同的形式表示多层水,但前者认为吸附是界面现象,而后者的推导则是基于溶液理论;根据上述分析,Y-N模型中吸收水、单层水都采用Langmuir方程的形式,但吸收水分是位于基质内部的。需要指出的是,Y-N模型的原始文献中指出第三部分水是多层水,表2中将这部分水称为成簇水,是基于上述分析的结果。不过,在对实验数据进行模型拟合时,所有这些差异都被忽略了。因此,可以将不同状态的水分别称为Langmuir水、Henry水、Raoult水、成簇水。另外,从纯数学的角度看,在如何描述水分含量随aw快速升高的问题上,DW模型和Y-B模型采用一个(1-kbaw)的反比函数表示水分含量,而Park模型和Y-N模型采用的是指数大于1的幂函数(kawn)表示水分含量。
2 结果与分析
2.1 基于组合模型的水分状态分析
糯米粉的解吸平衡水分如表2所示。
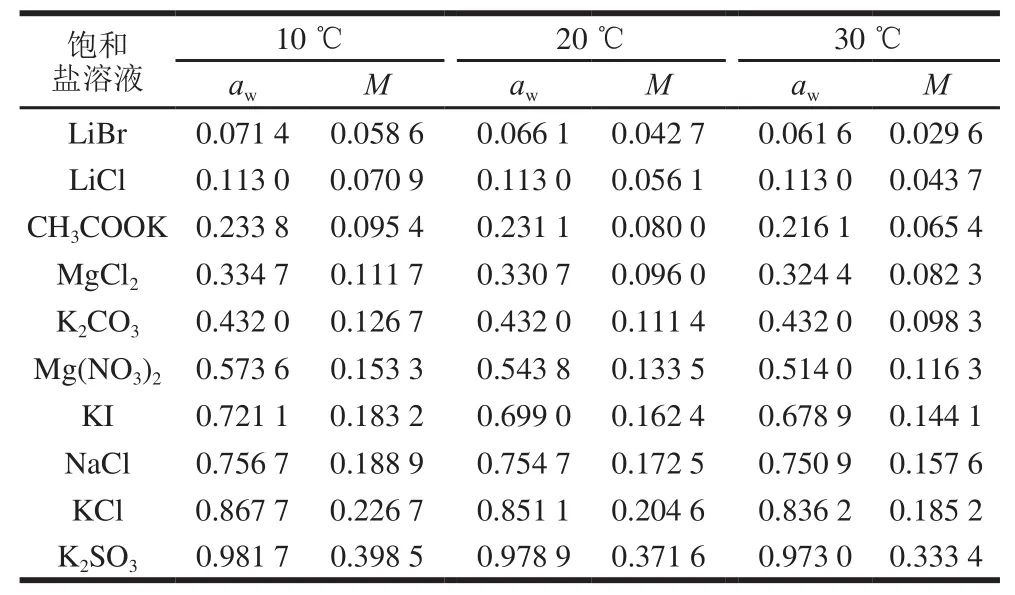
表2 糯米粉的水分等温解吸数据Table2 Isothermal water desorption data of glutinous rice fl our
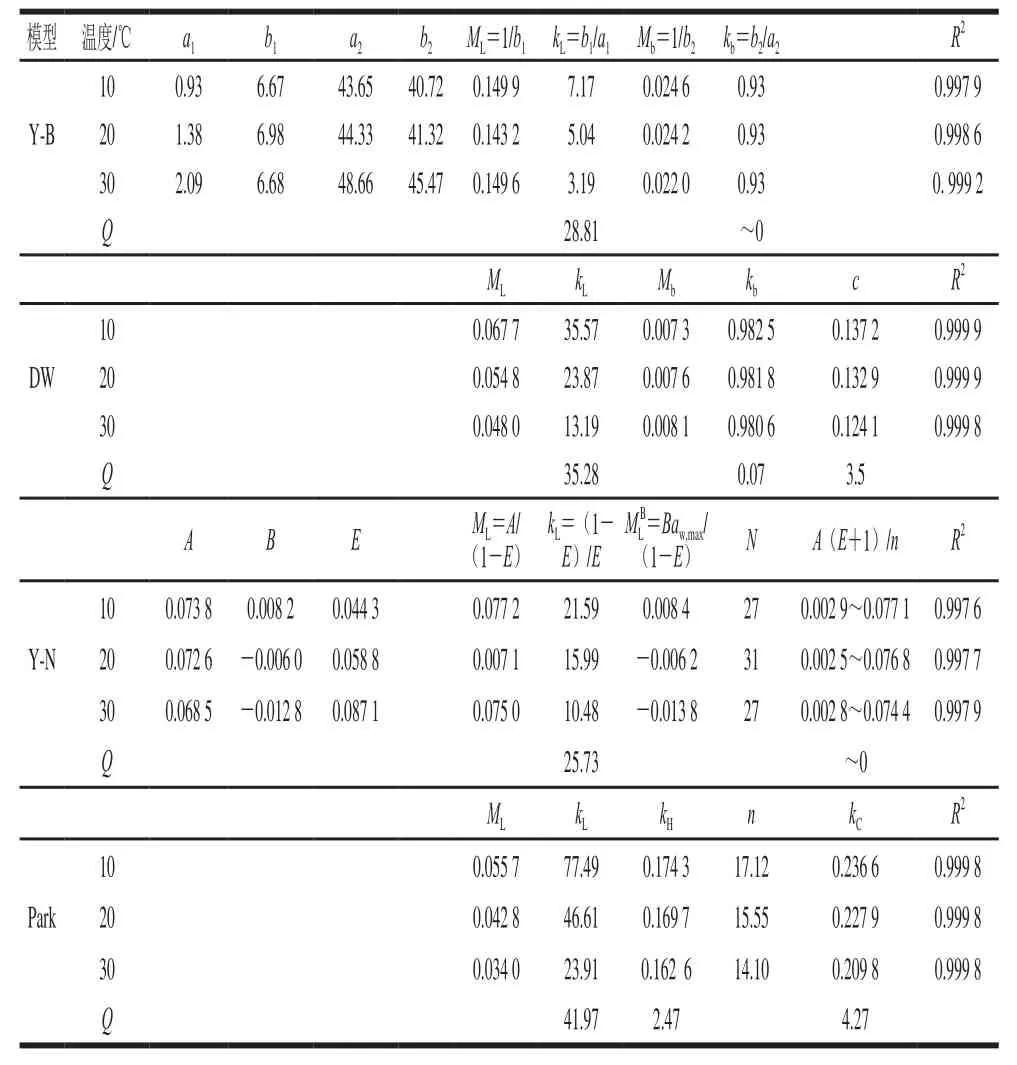
表3 采用4 个组合模型对糯米粉水分解吸数据拟合的结果及根据van’t Hoff模型计算的吸附焓Table3 Fitting results of four composite models for water desorption data of glutinous rice fl our and adsorption enthalpies from the van’t Hoff law
以4 个组合模型为回归方程,对糯米粉的解吸数据进行拟合,结果汇总于表3。确定表3中N值(团簇内水分子的数量)的方法为:首先从0.06开始,以0.02的步长增加到0.98,确定出多个aw数据点;然后分别计算出、-A(E+1)ln(1-a)在n取不同值时w的值,直到最后一个数据点(对应aw=0.98)时上述两式的计算值相差<10%,倒数第二个数据点的相差<3%,认为两者在整个aw范围近似相等,这时的n的最大值就是N,即:Y-N模型中的多层吸附水可近似表示为N个水分子团簇。
图1 是10 ℃、N=27时的情况。N 个水分子团簇中每个团簇内水分子的数量从1至N不等,假设不同大小团簇的数量彼此相等,可以计算出不同温度下的平均每个团簇中水分子的个数在14~16之间,这与根据Park模型的预测结果(见表3)较为接近。图1中同时给出了式(6)右侧前两项的计算结果,可以看出,相对于第三项,前两项的值基本可以忽略。
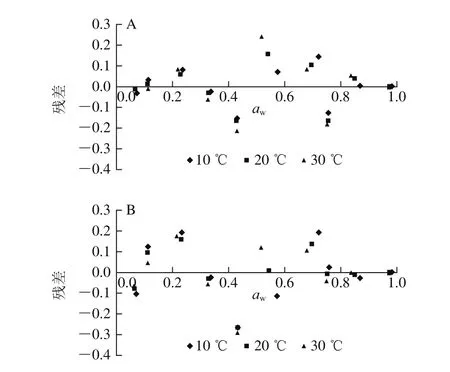
图2 DW模型(A)以及Park模型(B)的残差图Fig.2 Residual plots of the DW model (A) and the Park model (B)
由表3可以看出,各组合模型对不同状态水分含量的最大值、吸附速率、吸附焓、以及不同状态水分含量随aw变化趋势等方面的预测结果都存在一定的差异。但是,所有模型的决定系数均达到0.997以上,说明这4 个模型都能够很好预测糯米粉的解吸过程。残差图是体现模型预测性能的另一个方法,如果残差分布具有明显的规律性,说明该模型不合适;如果残差分布均匀,说明模型合适[24]。Y-B、Y-N模型的残差图都有一定规律(未显示)。DW模型、Park模型的残差图见图2,都为随机分布,且难以分辨哪个模型更好,但两模型对第三类吸附水的存在状态的假设是明显不同的。
图3更为直观地显示了各模型预测的不同状态水分含量随aw变化的情况,同时给出了总水分的模型拟合曲线。为便于观察,总水分含量及其拟合曲线上移0.05 个刻度。尽管不同模型的拟合参数有别,通过对表3、图3的分析,发现这些结果也存在一定的共性:1)所有模型都显示,Langmuir吸附速率常数比其他两个吸附过程的要大得多,至少为一个数量级,这使得Langmuir吸附在较低aw时就已接近完成,而多层吸附水或成簇水在低aw范围内增加很少,在aw达到某个临界水平后快速上升;2)Langmuir最大吸附量比二级吸附位点的最大吸附量大得多,说明强吸附位点的数量要大得多;3)温度降低导致吸附水的总量增大,增大部分多数位于第一层,少部分为Henry水,温度对多层(或成簇)水含量的影响很小;4)随温度升高,Langmuir吸附平衡常数减小,说明Langmuir是放热吸附,而其他吸附机理的平衡常数随温度变化很小;强结合过程的吸附热比弱结合过程的高得多,而其他吸附过程的吸附热要小得多。
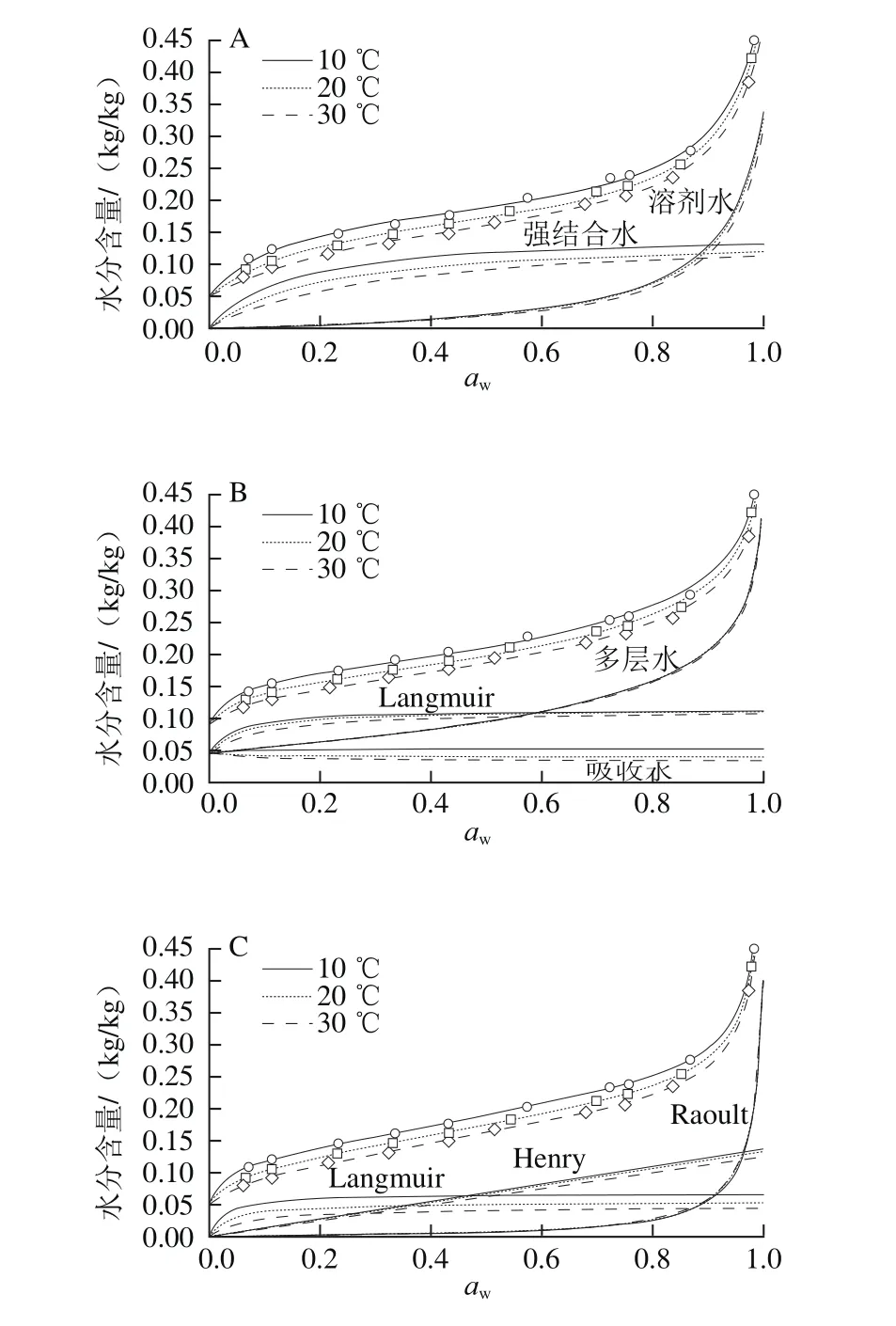
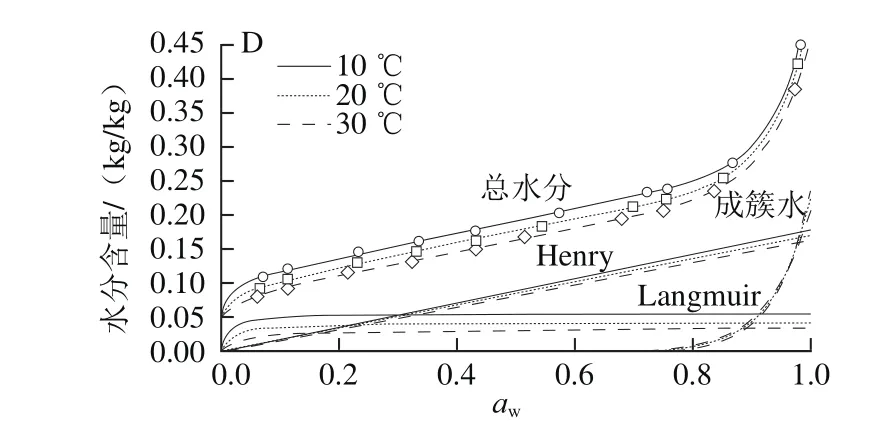
图3 采用Y-B(A)、Y-N(B)、DW(C)和Park(D)4 种组合模型预测的总水分含量及其分解所得的不同状态水分含量Fig.3 Predicted total and individual water contents from the Y-B (A),Y-N (B), DW (C) and Park (D) models
2.2 基于Henderson模型和Caurie模型的水分状态分布分析
针对糯米粉解吸的Henderson模型分析见图4。图中只出现一个折点。Cervenka等[15]就烘烤食品的研究也有类似发现。分别以aw较高的2 个点、较低的8 个点的数据进行线性回归,根据回归方程求出10、20、30 ℃时,折点对应的aw分别为0.84、0.83、0.87。通过比较可以发现,该折点处的aw与DW模型中的多层水、Park模型中的成簇水快速增多时的aw(分别为0.90、0.85)较为接近,这说明不同模型对某些吸附特性的预测具有一定的一致性。实际上,Henderson模型中的折点体现的是aw高于某临界值时水分含量快速增大,这时吸附的水为自由水;DW模型中的多层水、Park模型中的成簇水也正是与固体基质结合最弱的那部分水。
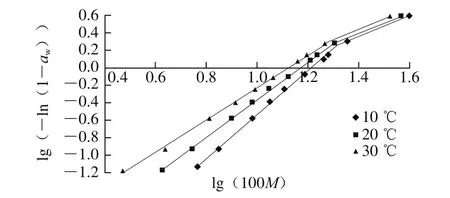
图4 根据Henderson方程分析糯米粉的等温解吸过程Fig.4 Henderson plot of isothermal water desorption of glutinous rice fl our
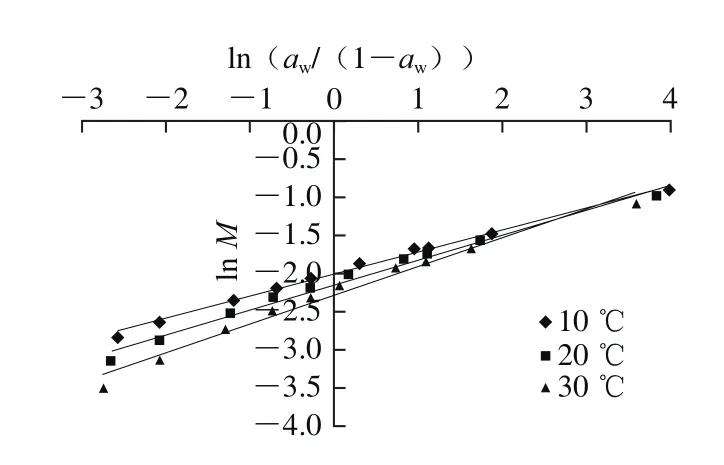
图5 根据Caurie模型分析糯米粉的等温解吸过程Fig.5 Caurie plot of isothermal water desorption of glutinous rice fl our
根据糯米粉的等温解吸结果,对式(7)线性化后,以ln M对ln(aw/(1-aw))作图(图5)。根据所得回归直线的斜率和截距,求出模型参数的值,并计算出各状态水分的含量,列于表4。根据Caurie模型,10、20、30 ℃下与总水分含量M02对应的aw分别为0.999 6、0.998 4、0.994 8。根据Park模型、DW模型、Y-B模型、Y-N模型以及Henderson模型可计算出该aw下的水分含量及其在各种状态之间的分配,并同时列于表4。由于Caurie模型预测的松散结合水遵循Raoult定律[18],故将其与组合模型中的多层水或成簇水放在一列进行比较。再根据Henderson模型计算aw为0.999 6、0.998 4、0.994 8时的水分含量时,采用的是根据aw最高的2 个数据点所得到的回归方程。可以看出,Caurie预测的总含水量比其他4 个模型预测的对应值要高得多,这主要归因于其预测的弱结合水的含量很高。另外,Y-N模型预测的多层水含量比其他模型预测的明显要高,导致其总水分含量也较高。Henderson模型预测的总水分含量也相对较高。
表4 Caurie模型和Henderson模型的拟合参数以及根据各模型预测的总结合水(与Caurie模型中对应的水分含量)及其在不同状态间的分布Table4 Fitting results of Caurie model and Henderson model and predicted total and individual bound water (corresponding to the in the Caurie model) from six models
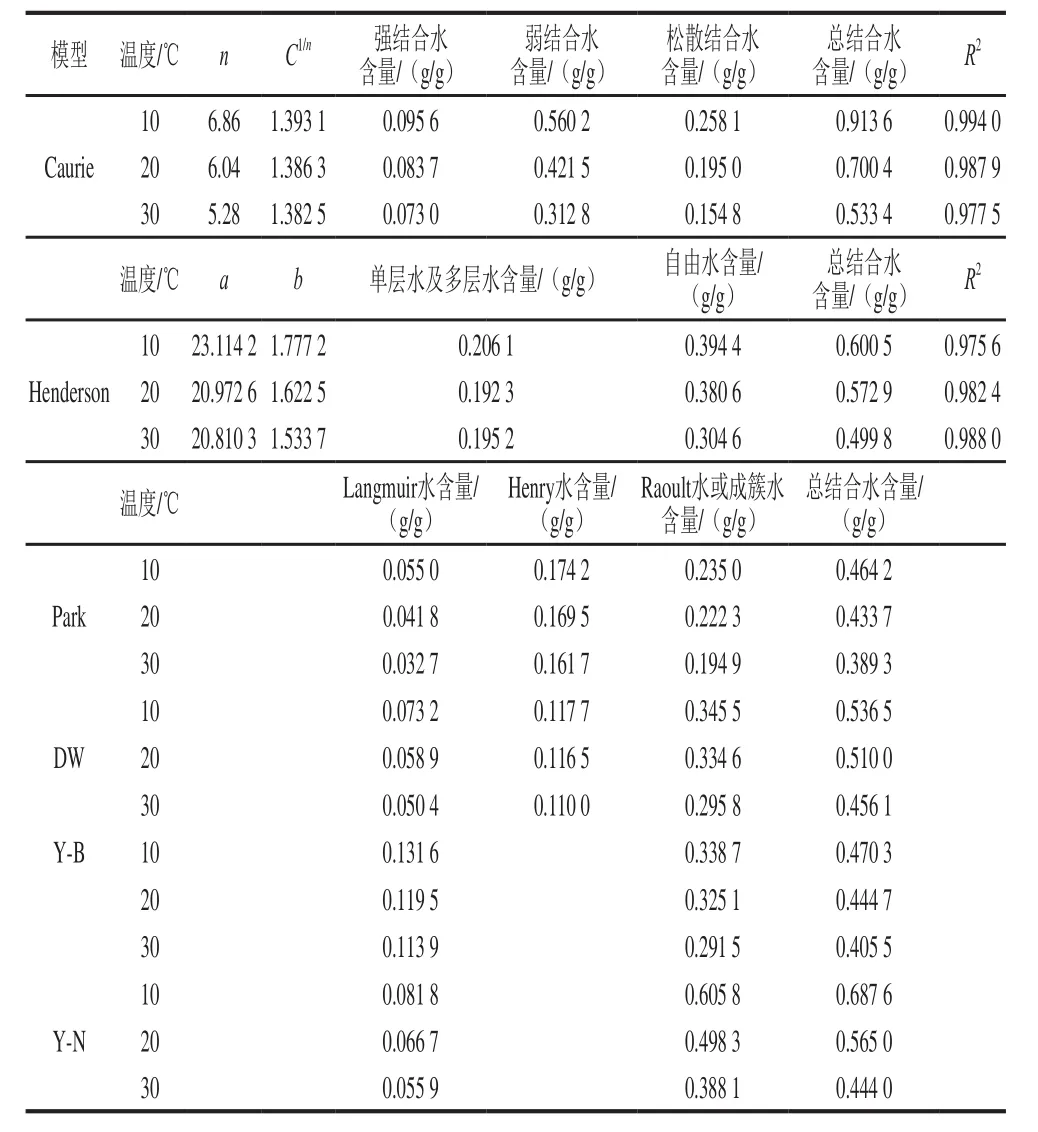
表4 Caurie模型和Henderson模型的拟合参数以及根据各模型预测的总结合水(与Caurie模型中对应的水分含量)及其在不同状态间的分布Table4 Fitting results of Caurie model and Henderson model and predicted total and individual bound water (corresponding to the in the Caurie model) from six models
?
3 讨 论
由前述可知,不同模型给出的预测结果不同,而在一定温度下就一种给定的食品体系而言,不同状态水分所占比例不会因选择的模型不同而变化。另外,就糯米粉的解吸而言,DW模型与Park模型的决定系数都很高,很难仅从模型拟合的统计学分析指标来判断哪个模型给出的结果更接近真实。为进行水分状态分析,在已知其水分吸附机理的情况下可以直接选用相应的模型,这当然需要对模型有准确的理解,问题的关键是吸附机理往往难以事先已知,这就需要采用其他技术手段并结合合适的策略来甄别出最适模型。
3.1 不同状态的水分是否可以同时存在
Caurie模型、Henderson模型与组合模型之间的根本区别在于是否认为在一个aw下同时存在多种状态的水分。上述4 个组合模型的提出都有相对严格的理论推导,而Caurie在由BET得到式(7)的过程中并没有严格的理论推导,逻辑不够严密,对水分的划分也显得难以理解。Henderson法对水分状态的划分缺乏严格的理论依据。Asay等[25]采用ATR-IR针对吸附在二氧化硅的水分研究显示:在不同aw下同时存在两种状态的水分,只是相对多少存在差异;一种水分随aw的变化很像Langmuir水,另一种随aw的变化很像DW模型中的多层水,在aw>0.6时快速增大。尚鲜发现关于食品物料的类似研究报道,不过这已能说明组合模型关于多种吸附机理同时进行的假设更为合理。
3.2 如何根据吸附模型的自身特点选定合适的模型
Y-B模型、Y-N模型与另两个组合模型的根本区别在于是否认为有Henry水存在。对Henry水的直接测定可能比较困难,但根据DW模型,如果表面存在吸附能力不同的位点,就可推断可能存在Henry水。蛋白质的极性侧链可以作为水分子的强结合位点,肽键可作为水分子的弱结合位点[26]。看来,对于食品物料来说,Henry项是应该考虑的。另外,前面的结果也显示,Y-N、Y-B模型拟合度不高的一个主要原因就是缺少Henry项。
Y-N模型的显著特点是认为存在吸收水,这样在解吸时就会出现吸附滞后现象,实际上当时提出该模型的一个目的正是试图解释吸附滞后现象[13]。如果一个吸附过程没有滞后现象就说明Y-N模型不适用。另外,Barham等[10]在研究药物胶囊的吸湿特性时根据其发生膨胀推断有吸收水存在。
Park模型的一个重要假设前提是水分子发生成簇反应。水分子成簇后由于几何尺寸增大,其在基质内的扩散系数会降低[2],因此进行水分扩散系数测定成为判断成簇反应是否发生的常用方法,如果水分扩散系数在aw较高时反而降低,就证明Park模型的假设是合理的[27-28]。采用全反射傅里叶红外光谱分析直接测定水分子团簇尺寸[29]是判断是否发生成簇反应的最直接方法。也有研究者从热力学的角度判断是否发生成簇反应,可根据等温吸附数据由van’t Hoff定律计算出吸附热,如果吸附热与自由水的冷凝热接近,意味着水分子成簇可能发生[30];采用石英晶体微天平/热导式热量计可以同时进行吸附过程中的质量变化和吸附焓变测定[30-31],这将使根据吸附焓所作出的判断更为客观。不过这种间接判定方法可能会产生较大误差。另外,还可以根据Zimm-Lundberg理论、Brown方程或Flory-Huggins理论[23,29-32]对水分子是否成簇作出进一步验证。
3.3 如何根据吸附模型的预测结果推断模型的合理性
各模型都给出最大吸附水分含量的预测值,可以根据该值计算出吸附位点的数量[20]。如果能够通过其他技术手段获取吸附位点数量的相关信息,也可据此对吸附模型是否适用作出判断。在非食品研究领域有一些相关报道:可以实测无孔碳[33]、多壁碳纳米管[34]的表面氧(水分子的结合位点)数量,也可以实测离子交换树脂的离子水化数[35]、水化溶菌酶的水化数[36],可以采用化学分析方法确定氧化钛表面每个钛原子上的水分子结合位点数量[37],而这些参数也可以由吸附模型给出预测值。这些直接测定结合位点数量的技术手段能否用于食品物料尚未可知,毕竟食品物料多为复查多样的生物大分子。即使存在某种技术手段可以测定食品物料表面水分子结合位点的数量,也可能因误差大(大于不同模型预测的吸附位点数量之差)而不能对不同模型的合理性作出判别。
前人还用以下几个方面的吸附模型预测结果与其他探测技术得到的结果进行比对:由于水-生物组织间的弱结合作用主要是氢键,这种弱结合的强度(可由吸附模型给出预测值)应当与氢键键能接近[38];对于纤维素膜,核磁共振测得的自旋-自旋弛豫时间T2开始增长时的aw与DW模型中多层水开始出现时的一致[39];根据GAB模型确定的吸附等温曲线的aw分区临界值,与根据核磁共振测得的弛豫时间T2确定的aw临界值一致[40]。需要说明的是,尽管可以采用傅里叶红外光谱、核磁共振、差示扫描量热等技术研究水分的状态,但这些技术对水分状态的分类和定义与组合吸附模型所规定的可能不完全是一个概念。尽管根据吸附模型研究水分状态存在一定的局限性,但一旦根据其他技术证实某吸附模型适用,就可根据该吸附模型获取更多关于水分状态的信息,如基质-水以及水-水之间相互作用的强弱、不同结合强度的吸附位点数量、吸附速率常数、不同状态水分的空间分布及其随温度、aw的变化等,能够同时获取这么多信息,这是其他探测技术难以做到的。
另外,也可根据模型参数值的合理性对模型的优劣作出判断。如:针对糯米粉的解吸,Y-N模型的拟合结果显示吸收水为负值;Y-N模型、Caurie模型、Henderson模型在aw为1时无意义;根据Caurie模型,M0、M02、M0(n-1)皆表示水分含量,但它们量纲明显不一致。
4 结 论
不同的等温吸附模型由于各自不同的吸附机理假设,对水分状态的分类、不同状态的水分含量、特性及其是否随aw变化的预测都存在差异。与食品研究中常用的Caurie模型和Henderson模型相比,组合模型对水分状态分布的描述更为合理,为我们由食品等温吸附数据解析出水分在不同状态间的分布及其随aw的变化提供了一种途径。Langmuir方程、Henry定律、Raoult定律、幂律方程是组合模型中描述不同状态水分吸附规律的常用方程。基于不同吸附机理的各组合模型针对不同状态水分间的差异性预测,在定性方面是一致的。在采用组合模型进行水分状态分析时,往往不能只根据统计学分析指标,还应根据模型的各自特点采用其他技术对其是否适用进行甄别,还可以从吸附热力学特性、表面吸附位点特性、临界aw等方面入手对模拟结果作进一步验证。
参考文献:
[1] KATZ E E, LABUZA T P. Effect of water activity on the sensory crispness and mechanical deformation of snack food products[J].Journal of Food Science, 1981, 46(2): 403-409. DOI:10.1111/j.1365-2621.1981.tb04871.x.
[2] GUILLARD V, BOURLIEU C, GONTARD N. Food structure and moisture transfer: a modeling approach[M]. New York: Springer,2013: 3-34. DOI:10.1007/978-1-4614-6342-9.
[3] DURAKOVA A G, MENKOV N D. Moisture sorption characteristics of rice flour[J]. Nahrung, 2004, 48(2): 137-140. DOI:10.1002/food.200300387.
[4] 张华, 赵学伟, 白艳红, 等. 糯米粉的水分等温解吸及孔特性[J]. 食品科学, 2017, 38(7): 88-95. DOI:10.7506/spkx1002-6630-201707015.
[5] 邱光应, 彭桂兰, 吴绍锋, 等. 花椒吸附等温线及热力学性质[J]. 食品科学, 2015, 36(21): 1-5. DOI:10.7506/spkx1002-6630-201521001.
[6] VAN DEN BERG C. Description of water activity of foods for engineering purposes by means of the GAB model of sorption[M].New York: Elsevier, 1984: 311-332.
[7] LIU X J, SHI Y F, KALBASSI M A, et al. Water vapor adsorption isotherm expressions based on capillary condensation[J]. Separation and Purification Technology, 2013, 116: 95-100. DOI:10.1016/j.seppur.2013.05.020.
[8] DETALLANTE V, LANGEVIN D, CHAPPEY C, et al. Water vapor sorption in naphthalenic sulfonated polyimide membranes[J]. Journal of Membrane Science, 2001, 190(2): 227-241. DOI:10.1016/S0376-7388(01)00437-9.
[9] GOUANVE F, MARAIS S, BESSADOK A, et al. Study of water sorption in modified flax fibers[J]. Journal of Applied Polymer Science, 2006, 101(6): 4281-4289. DOI:10.1002/app.23661.
[10] BARHAM A S, TEWES F, HEALY A M. Moisture diffusion and permeability characteristics of hydroxypropylmethylcellulose and hard gelatin capsules[J]. International Journal of Pharmaceutics, 2015,478(2): 796-803. DOI:10.1016/j.ijpharm.2014.12.029.
[11] FURMANIAK S, WISNIEWSKI M, WERENGOWSKA-CIECWIERZ K, et al. Water at curved carbon surface: mechanisms of adsorption revealed by fi rst calorimetric study[J]. The Journal of Physical Chemistry C, 2015, 119: 2703-2715. DOI:10.1021/jp512383g.
[12] BLAHOVEC J. Sorption isotherms in materials of biological origin mathematical and physical approach[J]. Journal of Food Engineering,2004, 65(4): 489-495. DOI:10.1016/j.jfoodeng.2004.02.012.
[13] YOUNG J H, NELSON G L. Theory of hysteresis between sorption and desorption isotherms in biological materials[J]. Transaction of the ASAE, 1967, 10: 260-263.
[14] ROCKLAND L B. Water activity and storage stability[J]. Food Technology, 1969, 23: 1241-1249.
[15] CERVENKA L, REZKOVA S, KRALOVSKY J. Moisture adsorption characteristics of gingerbread, a traditional bakery product in Pardubice, Czech Republic[J]. Journal of Food Engineering, 2008,84(4): 601-607. DOI:10.1016/j.jfoodeng.2007.07.006.
[16] CAURIE M. The unimolecular character of the classical Brunauer,Emmett and Teller adsorption equation and moisture adsorption[J].International Journal of Food Science and Technology, 2005, 40(3):283-293. DOI:10.1111/j.1365-2621.2004.00892.x.
[17] MARTIN-SANTOS J, VIOQUE M, GOMEZ R. Thermodynamic properties of moisture adsorption of whole wheat flour. calculation of net isosteric heat[J]. International Journal of Food Science and Technology, 2012, 47(7): 1487-1495. DOI:10.1111/j.1365-2621.2012.02996.x.
[18] CAURIE M. Bound water: its definition, estimation and characteristics[J]. International Journal of Food Science and Technology, 2011, 46: 930-934. DOI:10.1111/j.1365-2621.2011.02581.x.
[19] FURMANIAK S, TERZYK A P, GOŁEMBIEWSKI R, et al.Searching the most optimal model of water sorption on foodstuffs in the whole range of relative humidity[J]. Food Research International,2009, 42(8): 1203-1214. DOI:10.1016/j.foodres.2009.06.004.
[20] WORTMANN F J, AUGUSTIN P, POPESCU C. Temperature dependence of the water-sorption isotherms of wool[J].Journal of Applied Polymer Science, 2001, 79(6): 1054-1061.DOI:10.1002/1097-4628(20010207)79:6<1054::AID-APP80>3.0.CO;2-X.
[21] D’ARCY R L, WATT I C T. Analysis of sorption isotherms of nonhomogeneous sorbents[J]. Transactions of the Faraday Society, 1970,66: 1236-1245.
[22] YANNIOTIS S, BLAHOVEC J. Model analysis of sorption isotherms[J]. LWT-Food Science and Technology, 2009, 42(10):1688-1695. DOI:10.1016/j.lwt.2009.05.010.
[23] PARK G S. Transport principles: solution, diffusion and permeation in polymer membranes[M]// Synthetic membranes: science, engineering and applications. Dordrecht: Springer, 1986: 57-107.
[24] CHEN C C. Evaluation of equilibrium sorption isotherm equations[J].The Open Chemical Engineering Journal, 2013, 7(1): 24-44. DOI:10.2174/1874123101307010024.
[25] ASAY D B, KIM S H. Evolution of the adsorbed water layer structure on silicon oxide at room temperature[J]. Journal of Physical Chemistry B, 2005, 109(35): 16760-16763. DOI:10.1021/jp053042o.
[26] WATT C, D’ARCY R L. Hydration of biopolymers[J]. Journal of Polymer Science: Symposium, 1976, 55(1): 155-166.
[27] BESSADOK A, LANGEVIN D, GOUANVE F, et al. Study of water sorption on modif i ed Agave fi bres[J]. Carbohydrate Polymers, 2009,76: 74-85. DOI:10.1016/j.carbpol.2008.09.033.
[28] ALIX S, PHILIPPE E, BESSADOK A, et al. Effect of chemical treatments on water sorption and mechanical properties of flax fibres[J]. Bioresource Technology, 2009, 100(20): 4742-4749.DOI:10.1016/j.biortech.2009.04.067.
[29] DAVIS E M, ELABD Y A. Water clustering in glassy polymers[J].Journal of Physical Chemistry B, 2013, 117(36): 10629-10640.DOI:10.1021/jp405388d.
[30] DU A, KOO D, THERYO G, et al. Water transport and clustering behavior in homopolymer and graft copolymer polylactide[J]. Journal of Membrane Science, 2012, 396: 50-56. DOI:10.1016/j.memsci.2011.12.030.
[31] SMITH A L, SHIRAZI H M, MULLIGAN S R. Water sorption isotherms and enthalpies of water sorption by lysozyme using the quartz crystal microbalance/heat conduction calorimeter[J]. Biochimica et Biophysica Acta, 2002, 1594(1): 150-159. DOI:10.1016/S0167-4838(01)00298-9.
[32] CHU L Q, MAO H Q, KNOLL W. In situ characterization of moisture sorption/desorption in thin polymer films using optical waveguide spectroscopy[J]. Polymer, 2006, 47: 7406-7413. DOI:10.1016/j.polymer.2006.08.031.
[33] BARTON S S, EVANS M J B, MACDONALD J A F. Adsorption of water vapor on nonporous carbon[J]. Langmuir, 1994, 10(11): 4250-4252. DOI:10.1016/0008-6223(92)90080-G.
[34] BRADLEY R H, ANDREU A, CASSITY K, et al. Dependence of water vapour adsorption on the polarity of the graphene surfaces of multi-wall carbon nanotubes[J]. Adsorption Science and Technology,2010, 28(10): 903-912.
[35] NANDAN D, VENKATARAMANI B, GUPTA A R. Ionic hydration and water sorption isotherms of ion exchange resins[J]. Langmuir,1993, 9(7): 1786-1793. DOI:10.1021/la00031a029.
[36] LIOUTAS T S, BAIANU I C, STEINBERG M P. Oxygen-17 and deuterium nuclear magnetic resonance studies of lysozyme hydration[J]. Archives of Biochemistry and Biophysics, 1986, 247(1):68-75. DOI:10.1016/0003-9861(86)90534-5.
[37] VENKATARAMANI B. Characterization of sorption sites on hydrous titanium and thorium oxides by water sorption[J]. Langmuir, 1993,9(11): 3026-3032. DOI:10.1021/la00035a047.
[38] HITMI A, COUDRET A, BARTHOMEUF C, et al. Role of intracellular water retention strength in freezing tolerance of Chrysanthemum cinerariaefolium Vis. cell cultures[J]. Journal of Plant Physiology, 2000, 157(1): 47-53. DOI:10.1016/S0176-1617(00)80134-0.
[39] SUN S M, MITCHELL J R, MACNAUGHTAN W, et al. Comparison of the mechanical properties of cellulose and starch films[J].Biomacromolecules, 2010, 11(1): 126-132. DOI:10.1021/bm900981t.
[40] FARRONI A E, BUERA M P. Cornflake production process: state diagram and water mobility characteristics[J]. Food and Bioprocess Technology, 2014, 7: 2902-2911. DOI:10.1007/s11947-014-1270-5.
