还原糖快速检测试纸的研制
2018-03-20马千里杨仁党
刘 萧,马千里,杨仁党*
(华南理工大学 制浆造纸工程国家重点实验室,广东 广州 510640)
果糖、葡萄糖和蔗糖等可溶性糖是食品的重要组成成分之一,为人体生长提供所需的能量,同时也是食品的重要风味成分[1]。此外,可溶性糖及有机酸是水果的重要营养成分和重要风味物质,其构成和含量水平是决定水果甜酸风味的关键因素[2-5]。在发酵过程中产生的还原糖和可溶性糖是决定产品质量的重要因素,其含量的变化与功能性成分也有着密切的关系[6-8]。血液中的葡萄糖提供了人体组织细胞所需的大多能量,所以血糖含量必须保持在一定范围内才能维持含量体内各器官和组织的需要。在医药方面,从天然产物和真菌中提取的活性多糖类具有抗癌、抗氧化、降血糖等活性[9-11],低聚木糖、低聚果糖、甲壳低聚糖等低聚糖是功能保健产品的重要成分之一[12-13]。由于糖的分析涉及到食品、发酵、医学、药学等多个领域,所以糖含量测定技术一直是国内外的研究热点。糖测定的方法有多种,国内食品检测目前主要采用GB 5009.7—2016《食品中还原糖的测定》[14]。除此之外比较常用的实验室分析方法有3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法、苯酚-硫酸法、费林试剂法等[15-18]。近年来仪器分析如高效液相色谱法也被用于多种糖分的分析检测[19-20]。实验室方法使用试剂、仪器较多,操作繁琐费时,并且可测定的糖浓度范围有限;大型设备价格昂贵,整个过程需要专业人士熟练操作,对操作者有较高的要求。因此,手持糖度仪等小型测定仪器开始逐渐走向市场,其测定范围较大,使用简单,但是仍然没有脱离仪器,维护、携带较为不方便。
试纸法是把化学反应从试管移到试纸上进行,利用产生明显颜色的化学反应定性或定量检测待测物质。试纸法具有操作简单、携带方便、价格便宜、无需仪器设备、结果显示直观、不需检修维护等特点,具有良好的应用前景[21]。目前已应用于快速检测食品中的过氧化氢、亚硝酸盐、尿素、组胺、敌敌畏、硼砂等物质[22-29],但测定食品中糖含量的研究较少。
本实验以DNS比色法为显色机理,通过对显色配方和工艺条件优化,制备了还原糖快速检测试纸。并将该方法与糖度仪测定结果进行对比,验证其准确性。
1 材料与方法
1.1 材料与试剂
饮料、水果 市购;定性滤纸(φ 7 cm)、定量滤纸(φ 7 cm)、层析滤纸(φ 7 cm) 杭州沃华滤纸有限公司;DNS(分析纯) 上海源叶生物科技有限公司;氧化钙(分析纯) 天津市福晨化学试剂厂;葡萄糖(分析纯) 上海博奥生物科技有限公司。
1.2 仪器与设备
HWS26型电热恒温水浴锅、DHG-9140A电热鼓风干燥箱 上海一恒科学仪器有限公司;FA1104电子天平上海精天电子仪器厂;RHB80糖度计 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 实验原理
在碱性条件下,还原糖与显色剂DNS共热反应生成棕红色的氨基化合物,在一定范围内,还原糖的含量与反应产物棕红色颜色的深浅成正比关系。氧化钙与待测样品中的水反应,生成氢氧化钙,为反应提供了碱性环境,同时放出热量,具备了还原糖与DNS发生氧化还原反应的条件,生成了棕红色的氨基化合物,实验化学反应原理如图1所示。通过与标准色阶对比,确定还原糖的质量浓度,实现了还原糖的半定量检测。
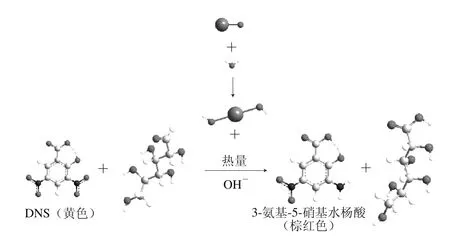
图1 DNS试剂显色原理示意图Fig. 1 Schematic diagram for the principle of DNS colorimetry
1.3.2 葡萄糖溶液的配制
以葡萄糖溶液作为标准还原糖溶液,分别配制浓度为0.01、0.02、0.05、0.10、0.20、0.50、1.00、2.00、3.00 mol/L的葡萄糖溶液。
1.3.3 试纸的制备
配制质量浓度6.0 g/L的DNS溶液,取100 mL于培养皿中,将快速定性滤纸(φ 7 cm)浸泡在溶液中1 min,用镊子取出置于鼓风干燥箱,在50 ℃条件下进行干燥。干燥结束后,将氧化钙粉末均匀涂在基纸上下表面,覆涂量为0.1 g/面。将制备好的试纸统一裁剪成3 cm×1 cm规格的长条,储存于避光、干燥、密闭处备用。
1.3.4 试纸制备条件及显色剂配方的选择
移取20 μL标准葡萄糖溶液滴加在试纸上,观察并记录标准葡萄糖溶液在试纸上的显色效果、色阶变化、显色稳定性、均匀性,从而确定最佳试纸制备条件以及显色剂浓度。
1.3.5 标准比色卡的制备
在最优条件下制备还原糖试纸,分别滴加20 μL 0.01、0.02、0.05、0.10、0.20、0.50、1.00、2.00、3.00 mol/L的标准葡萄糖溶液于试纸上,显色5 min后用相机拍摄照片,采用计算机软件Photoshop在颜色面板中读取RGB值,然后制备试纸标准比色卡。
1.3.6 试纸的检测范围
在最优条件下制备的试纸与系列标准葡萄糖溶液反应,确定试纸的检测上下限。
1.3.7 样品测定
利用制备的还原糖检测试纸对未知浓度葡萄糖溶液、购自超市的饮料及水果进行检测。同时采用手持糖度仪进行检测对比,验证试纸的准确性。
2 结果与分析
2.1 试纸基纸的选择
试纸在使用过程中,基纸对试纸的显色有显著的影响,试纸基纸的选择需要满足容易吸附试剂且吸附量较大、干燥时间短、显色速度快、颜色变化明显等要求[30]。制作试纸的基纸有多种,本实验分别选用8 种类型基纸,观察显色效果,确定最佳基纸。

表1 基纸对试纸显色效果的影响Table 1 Effect of base paper on color development
如表1所示,1号和2号基纸显色程度一般,色阶变化不明显。5、6、7、8号基纸显色均匀性较差,3号基纸显色清晰,色阶变化明显,显色均匀性较好。因此,本实验采用3号基纸快速定性滤纸作为试纸的基纸。
2.2 显色剂质量浓度的确定
实验采用DNS作为显色剂,在其他制备条件相同条件下,考察不同质量浓度显色剂对试纸显色性能的影响,结果见图2。显色剂质量浓度不同,试纸显色效果和显色梯度也不同,在一定质量浓度范围内,显色剂质量浓度越高,试纸显色越清晰,显色梯度越明显。显色剂质量浓度为6.0 g/L和8.0 g/L时,试纸显色效果基本相同。考虑到试剂成本及能源节约问题,实验选用的显色剂DNS质量浓度为6.0 g/L。
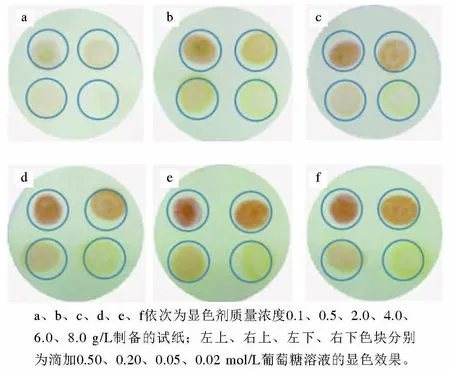
图2 显色剂质量浓度对试纸的影响Fig. 2 Impact of different color reagent concentrations on the strip test
2.3 干燥温度的选择
选择优化后的条件,在不同温度条件下干燥,考察干燥温度对试纸显色效果的影响,如表2所示。在不同温度条件下干燥制得的试纸显色效果差异不大,低温干燥的试纸有底色的干扰,并且干燥所需的时间较长,随着温度升高,试纸干燥时间缩短,但试纸表面出现褶皱现象,综合考虑到干燥时间等因素,本实验选用50 ℃鼓风干燥制备试纸。

表2 干燥温度对试纸效果的影响Table 2 Effect of drying temperature on the strip test
2.4 标准比色卡的制备
采用试纸比色模式,根据试纸的颜色变化制作标准比色卡,从而实现对还原糖的半定量快速检测。制作的标准比色卡如图3所示,随着葡萄糖浓度的增加,试纸颜色也发生了明显的变化,颜色变化梯度为浅黄色、浅棕色、深棕色(浅到深)。

图3 试纸标准比色卡Fig. 3 Standard colorimetric card
2.5 试纸的检测范围
用试纸法分别检测不同浓度梯度的葡萄糖溶液,结果表明,当葡萄糖溶液的浓度低于0.01 mol/L时,肉眼无法辨别试纸的颜色变化,葡萄糖浓度增加,试纸显色加深,当葡萄糖溶液浓度达到3.00 mol/L时,试纸显色为深棕色(最深)。因此,试纸的检测范围为0.01~3.00 mol/L。
2.6 样品检测结果
用本实验制备的试纸检测样品中的还原糖浓度,同时与糖度计检测结果进行对比,结果见表3,试纸法测定的浓度范围与糖度计测定的结果是对应的,其准确性良好,验证了本实验制备的还原糖检测试纸在实际检测应用中的可行性。
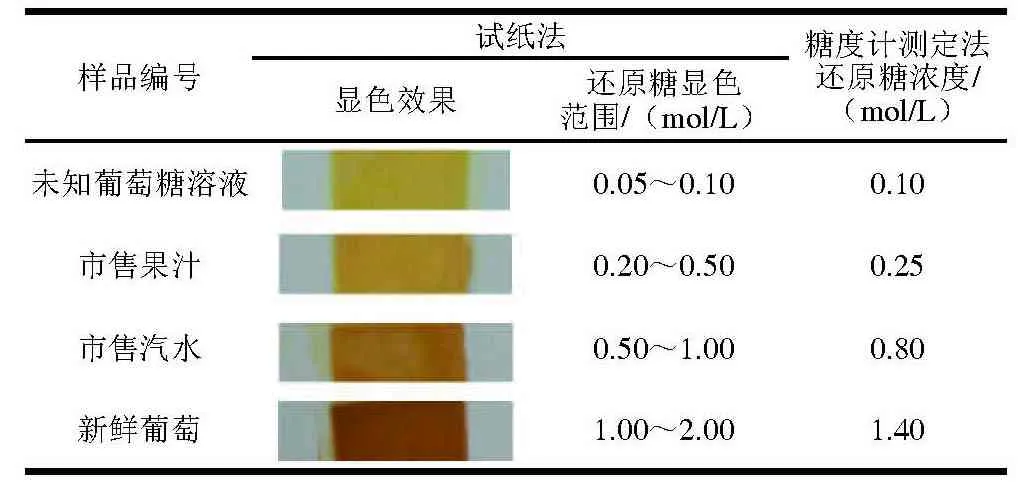
表3 样品糖含量检测结果Table 3 Results of detection of reducing sugar in real samples
3 结 论
本实验建立了一种快速检测还原糖浓度的试纸法,对其制备工艺条件及配方进行了优化,结果表明,采用快速定性滤纸(φ 7 cm)、质量浓度6.0 g/L的DNS、浸泡时间1 min、干燥温度50 ℃、氧化钙覆涂量0.1 g/面制备的试纸具有良好的性能。试纸法检测所需时间仅需5 min,检测范围为0.01~3.00 mol/L,具有样品量小、反应灵敏、成本低廉、使用方便、操作简单的优点。与传统的还原糖实验检测方法相比,实现了现场快速检测,其检测范围较大,应用领域广泛,是一种快速半定量检测方法,在食品、发酵、医学、药学等产业中有良好的发展前景。
[1] 周春丽, 钟贤武, 范鸿冰, 等. 果蔬及其制品中可溶性总糖和还原糖的测定方法评价[J]. 食品工业, 2012, 33(5): 89-92.
[2] 郑丽静, 聂继云, 闫震. 糖酸组分及其对水果风味的影响研究进展[J]. 果树学报, 2015, 32(2): 304-312. DOI:10.13925/j.cnki.gsxb.20140271.
[3] 蒋侬辉, 钟云, 曾继吾. 杨梅成熟期间有机酸、糖的动态变化分析[J].食品科学, 2013, 34(18): 235-238. DOI:10.7506/spkx1002-6630-201318048.
[4] 马千里, 田英姿, 英犁, 等. 模糊综合评价法在新疆葡萄质量评价分析中的应用[J]. 现代食品科技, 2015, 31(2): 179-183. DOI:10.13982/j.mfst.1673-9078.2015.2.030.
[5] 阚茗铭, 叶发银, 赵国华. 成熟度对甘蓝膳食纤维单糖组成及抗氧化活性的影响[J]. 食品科学, 2017, 38(5): 60-65. DOI:10.7506/spkx1002-6630-201705010.
[6] LU Z, FLWMING H P, Mc FEETERS R F, et al. Effects of anions and cations on sugar utilization in cucumber juice fermentation[J]. Journal of Food Science, 2002, 67(3): 1155-1161. DOI:10.1111/j.1365-2621.2002.tb09469.x.
[7] 唐霞, 李曼, 马俊莲. 不同前处理对发酵液中还原糖含量影响的研究[J]. 食品工业, 2015, 36(5): 152-155.
[8] 卢福芝, 李启虔, 钱丰, 等. 黑蒜发酵过程中还原糖和可溶性糖含量变化的研究[J]. 食品科技, 2014, 39(12): 91-93. DOI:10.13684/j.cnki.spkj.2014.12.019.
[9] 邹林武, 赵谋明, 游丽君. 香菇多糖提取工艺的优化及其抗氧化活性研究[J]. 食品工业科技, 2013, 34(19): 177-182. DOI:10.13684/j.cnki.spkj.2014.12.019.
[10] BROWNLEE L A. The physiological roles of dietary fibre[J].Food Hydrocolloids, 2011, 5(2): 238-250. DOI:10.1016/j.foodhyd.2009.11.013.
[11] ZHAO L Y, DONG Y H, CHEN G T, et al. Extraction, purification,characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J]. Carbohydrate Polymers, 2010, 80: 783-789.DOI:10.1016/j.carbpol.2009.12.029.
[12] SWENNEN K, COURTIN C M, DELCOUR J A. Nondigestible oligosaccharides with prebiotic properties[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(6): 459-471.DOI:10.1080/10408390500215746.
[13] 刘晓梅, 彭芝榕, 倪学勤, 等. 低聚果糖、乳酸杆菌对便秘模型大鼠的通便功能影响[J]. 食品科学, 2013, 34(11): 296-299. DOI:10.7506/spkx1002-6630-201311063.
[14] 国家卫生和计划生育委员会. 食品中还原糖的测定: GB 5009.7—2016[S]. 北京: 中国标准出版社, 2016: 3.
[15] WOOD L P, ELLISTON A, RYDEN P, et al. Rapid quantification of reducing sugars in biomass hydrolysates: improving the speed and precision of the dinitrosalicylic acid assay[J]. Biomass and Bioenergy,2012, 44: 117-121. DOI:10.1016/j.biombioe.2012.05.003.
[16] 李志霞, 聂继云, 闫震, 等. 响应面法对3,5-二硝基水杨酸比色法测定水果中还原糖含量条件的优化[J]. 分析测试学报, 2016, 35(10):1283-1288. DOI:10.3969/j.issn.1004-957.2016.10.011.
[17] HALL M B. Efficacy of reducing sugar and phenol-sulfuric acid assays for analysis of soluble carbohydrates in feedstuあse[J]. Animal Feed Science and Technology, 2013, 185: 94-100. DOI:10.1016/j.anifeedsci.2013.06.008.
[18] 张学英, 黄忠意, 章发盛, 等. 两种检测还原糖方法的比较[J]. 食品与机械, 2017, 33(2): 66-69. DOI:10.13652/j.issn.1003-5788.2017.02.014.
[19] ZEPPA G, CONTERNO L, GERBI V. Determination of organic acids,sugars, diacetyl, and acetoin in cheese by high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry, 2011,49(6): 2722-2726. DOI:10.1021/jf0009403.
[20] 李映志, 胜辉, 祝英, 等. 液相色谱法测定菠萝蜜果实中的葡萄糖、果糖和蔗糖[J]. 食品科学, 2014, 35(12): 84-87. DOI:10.7506/spkx1002-6630-201412016.
[21] 师邱毅, 纪其雄, 许莉勇. 食品安全快速检测技术及应用[M]. 北京:化学工业出版社, 2010: 10-17.
[22] 程楠, 何景, 董凯. 试纸法在食品安全快速检测中的研究进展[J]. 食品科学, 2015, 36(1): 256-261. DOI:10.7506/spkx1002-6630-201501049.[23] 程楠, 董凯, 何景, 等. 食品中过氧化氢残留快速检测试纸的研制与应用[J]. 农业生物技术学报, 2013, 21(12): 1103-1112. DOI:10.3969/j.issn.1674-7968.2013.12.001.
[24] CHE H X, TIAN B, BAI L N, et al. Development of a test strip for rapid detection of lactoperoxidase in raw milk[J]. Journal of Zhejiang University-Science (Biomedicine & Biotechnology), 2015, 16(8): 672-679. DOI:10.1631/jzus.B1400359.
[25] 张洁, 陈晓敏, 徐桂花, 等. 亚硝酸盐快速检测试纸的研制[J]. 食品科技, 2010, 35(8): 344-346. DOI:10.13684/j.cnki.spkj.2010.08.060.
[26] 杜雪, 田雨, 姜瞻梅, 等. 试纸法快速检测生乳中尿素含量的研究[J].食品工业, 2012, 33(12): 163-165.
[27] 王丽, 吴强, 桑宏庆, 等. 组胺检测试纸的研制[J]. 食品工业科技,2011, 32(6): 410-413. DOI:10.13386/j.issn1002-0306.2011.06.043.
[28] 周睿璐, 付大友, 郭雪琰, 等. 试纸法快速检测果蔬中敌敌畏含量的研究[J]. 应用化工, 2017, 46(1): 106-112. DOI:10.16581/j.cnki.issn1671-3206.2017.01.002.
[29] 张小村, 程楠, 黄昆仑, 等. 食品中硼砂快速检测试纸条的改进与应用[J]. 食品科技, 2016, 41(12): 277-282. DOI:10.13684/j.cnki.spkj.2016.12.055.
[30] 桑宏庆, 王丽, 汪伟. 辛硫磷试纸的制备及其在金银花检测中的应用[J]. 分析实验室, 2014, 33(7): 778-781. DOI:10.13595/j.cnki.issn1000-0720.2014.0183.
