植物乳杆菌Sc52益生特性评价及其在降血糖产品中的应用
2018-03-20肖凤艳段翠翠赵玉娟牛春华李盛钰
温 贺,肖凤艳,段翠翠,高 磊,赵玉娟,牛春华,赵 权,李盛钰,*
(1.吉林省农业科学院农产品加工研究所,吉林 长春 130033;2.吉林农业科技学院中药学院,吉林 吉林 132109;3.吉林农业大学中药材学院,吉林 长春 130118)
益生菌是一类对宿主健康有促进作用的活性微生态制剂[1],其中乳杆菌和双歧杆菌是主要的益生菌种类。研究发现益生菌具有改善肠道、提高免疫力、抗氧化、调节血脂代谢、降低过敏反应等生理功能[2-5],其良好的功能特性和健康促进作用已被广泛接受和认可。益生菌是发酵食品中普遍存在的微生物,研究人员已经从发酵食品中分离鉴定出众多不同功能特性的益生菌[6-8],并不断被应用于健康食品和功能食品中[9],益生菌对提高食品安全性、丰富营养成分、赋予产品功能特性和改善产品风味等起到重要作用[10]。而优良益生特性和发酵特性的益生菌,须经严格的体外实验、动物体内实验和人体实验等筛选获得。
植物乳杆菌(Lactobacillus plantarum)Sc52是分离自传统发酵酸菜中的益生菌新菌株,该菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏登记号为CGMCC NO.11027。本实验室前期研究证明植物乳杆菌Sc52是一株具有辅助降血糖作用的益生菌。该菌株通过调节肠道微生物平衡,促进肠道益生菌生长,降低血清血脂水平,降低机体内毒素及炎症因子水平和改善肠道屏障功能等机制发挥降血糖作用[11]。而有效活菌株到达肠道并定植是植物乳杆菌Sc52改善肠道功能、辅助降糖的基础和前提,因此本研究分析了植物乳杆菌Sc52耐受、黏附等体外益生特性,并将其与其他益生菌菌株联合发酵药食同源原料,制成辅助降血糖固体饮料产品,初步评价产品的降血糖作用。
1 材料与方法
1.1 材料与试剂
SPF级健康雄性ICR(institute of cancer research)小鼠 长春市亿斯实验动物技术有限责任公司;链脲佐菌素(streptozocin,STZ) 北京索莱宝科技有限公司;吐温-80、牛胆盐 北京鼎国昌盛生物技术有限公司;小鼠总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)试剂盒 南京建成生物工程研究所;小鼠低密度脂蛋白(low density lipoprotein,LDL)、胰岛素(insulin,INS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒 上海朗顿生物技术有限公司;葡萄糖测定试剂盒(葡萄糖氧化酶法) 上海荣盛生物药业有限公司;人参、山药、枸杞子、辣木叶、桑叶为中药饮片 吉林大药房;其余试剂均为国产分析纯。
1.2 仪器与设备
卓越型血糖仪 德国Roche诊断有限公司;CP12 4S分析天平 德国Sartorius公司;高压蒸汽灭菌锅 日本Sanyo公司;无菌超净工作台 哈尔滨东联电子技术开发有限公司;Cary 300紫外-可见分光光度计美国Varian公司;pH计 德国Sartorius公司;Sorvall Evolotion RC型高速冷冻离心机 美国Thermo公司;ELx800型全自动酶标仪 美国BioTek公司;冷冻干燥机美国Labconco公司;动态多功能提取罐 上海锐元机械设备有限公司。
1.3 方法
1.3.1 菌株处理与培养基组成
植物乳杆菌Sc52分离自传统发酵酸菜,植物乳杆菌Q3-4分离自自然发酵的辣酱,植物乳杆菌CH126分离自咸菜辣萝卜,植物乳杆菌C88分离自内蒙古发酵奶豆腐,上述菌株由吉林省农业科学院农产品加工研究所实验室分离鉴定,在含体积分数20%甘油的MRS(deMan Rogosa and Sharpe)液体培养基中于-80 ℃保存。使用前,菌株在MRS液体培养基中连续活化传代培养3 代后,按3%量接种于MRS液体培养基中37 ℃培养16 h,后置于4 ℃冰箱中备用。
MRS液体培养基:蛋白胨10.0 g,牛肉膏10.0 g,酵母浸粉5.0 g,磷酸氢二钾2.0 g,无水乙酸钠5.0 g,柠檬酸钠5.0 g,硫酸镁0.2 g,硫酸锰0.05 g,葡萄糖20.0 g,吐温-80 1.0 mL,加三级水至1 000 mL,醋酸调pH 6.6±0.2,115 ℃高压灭菌20 min。
MRS固体培养基:MRS液体培养基中加入琼脂20 g/L。
1.3.2 植物乳杆菌Sc52体外益生特性
1.3.2.1 耐酸性实验
菌株按体积分数3%的量接种于用1 mol/L盐酸调pH值分别为2.0、3.0、6.6的液体MRS培养基中,37 ℃培养1 h或3 h,适度倍比稀释后涂布于MRS琼脂平板,37 ℃培养48 h后菌落计数,菌落数用lg(CFU/mL)表示,每个稀释度做3 个平行。
1.3.2.2 耐胆盐实验
菌株按体积分数3%的量分别接种于含有0.3、0.5、1.0 g/100 mL牛胆盐的液体MRS培养基中,37 ℃培养4 h,以不加胆盐的MRS为对照。适度倍比稀释后涂布于MRS琼脂平板,37 ℃培养48 h后菌落计数,菌落数用lg(CFU/mL)表示,每个稀释度做3 个平行。
1.3.2.3 疏水性测定
采用细菌黏着物质法(bacterial adhesion substance,BATS)测定植物乳杆菌Sc52疏水性[12]。取培养16 h的菌株离心(5 500 r/min、4 ℃离心5 min),菌体用生理盐水重悬2 次,再次离心后用0.1 mol/L KNO3溶液重悬至菌数1×108CFU/mL,600 nm波长处测定吸光度A。取出3 mL0菌悬液分别与1 mL二甲苯、氯仿、乙酸乙酯混合,旋涡振荡2 min后室温放置30 min,混合液分为两相,600 nm波长处测定水相的吸光度A1,实验重复3 次,用公式(1)计算菌株的疏水率:

1.3.2.4 自凝聚能力测定
取培养16 h的菌液离心(5 500 r/min、4℃离心5 min),菌体用生理盐水重悬2 次,离心后调整600 nm波长处吸光度A0为1.0,以生理盐水为空白对照。菌液放置试管中静置1、24、48 h,取1 mL上层菌液测定吸光度,每个菌株每个时间点做3 个平行。用公式(2)计算菌株的自凝聚率:
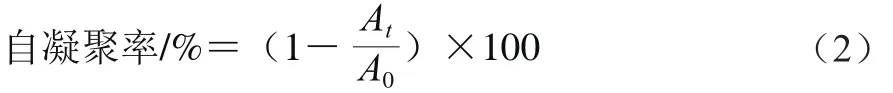
式中:A0为600 nm波长处测得吸光度;At为不同静置时间点测得吸光度。
1.3.2.5 抗生素对菌株最低抑菌浓度测定
选取10 种抗生素根据不同溶剂进行倍比稀释,终质量浓度为1 024、512、256、128、64、32、16、8、4、2、1、0.5 µg/mL,用0.22 μm滤膜过滤除菌。将待测菌液用灭菌的MRS液体培养基稀释1 000 倍,备用。在96 孔板中依次加入不同质量浓度的抗生素和制备好的菌液各70 µL,阳性对照孔加入待测菌液及溶解抗生素所用溶剂,阴性对照孔加入MRS液体培养基。在37 ℃培养箱中培养16 h后,观察96孔板中菌株的生长情况,明显无菌株生长的孔所对应的抗生素浓度即是对菌株的最低抑菌浓度。
1.3.3 植物乳杆菌Sc52辅助降糖产品的制备
提取液的制备:将人参、山药、枸杞子、辣木叶、桑叶按不同比例混合,加10 倍水热回流提取2 次,每次1 h,过滤,滤液浓缩至1/2体积。
固体饮料的制备:提取液中加入低聚果糖10 g/L,葡萄糖20 g/L,调pH 6.0~6.6,115 ℃高压灭菌20 min。将培养好的植物乳杆菌Sc52、C88、Q3-4、CH126分别按体积分数1%的接种量接入灭菌后的提取液中,37 ℃培养16 h后冻干。收获的发酵液冻干粉进行复配,制成固体饮料,具体配方如下:20%发酵液冻干粉、30%塔格糖、20%燕麦-β-葡聚糖、10%低聚果糖、20%麦芽糊精。
1.3.4 2型糖尿病小鼠模型建立及分组
参考栾畅等[11]方法。SPF级健康雄性ICR小鼠50 只,4~5 周龄,质量15~17 g。基础饲料含5%脂肪、53%碳水化合物、23%蛋白质;高脂饲料含22%脂肪、48%碳水化合物、20%蛋白质。设定标准体质量为60 kg的人每天服用5 g产品,按黄继汉等[13]方法换算小鼠的灌胃给药量。小鼠分组、饲喂及造模方法如表1所示。

表1 小鼠分组、饲喂及造模方法Table 1 Grouping and feeding of mice and diabetic model induction
1.3.5 口服葡萄糖耐量实验
治疗结束后,禁食不禁水12 h,灌胃葡萄糖溶液(每只按2 g/kg),分别于0、30、60、90、120 min后测定小鼠血糖值,并按照式(3)计算血糖曲线下面积(area under the curve,AUC)[14]:
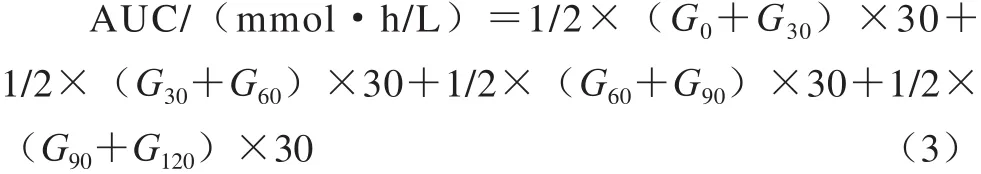
式中:G0~G120分别为0~120 min时小鼠的血糖值/(mmol/L);30为测定间隔时间/min。
1.3.6 小鼠血清生理生化指标测定
治疗结束后,各组小鼠经眼球取血,4 ℃、3 000 r/min离心10 min,收集上清液,-80 ℃冻存,待用。按照试剂盒说明书检测小鼠血清中TG、TC、LDL、TNF-α、INS、葡萄糖水平。
1.4 统计分析
2 结果与分析
2.1 耐受能力分析
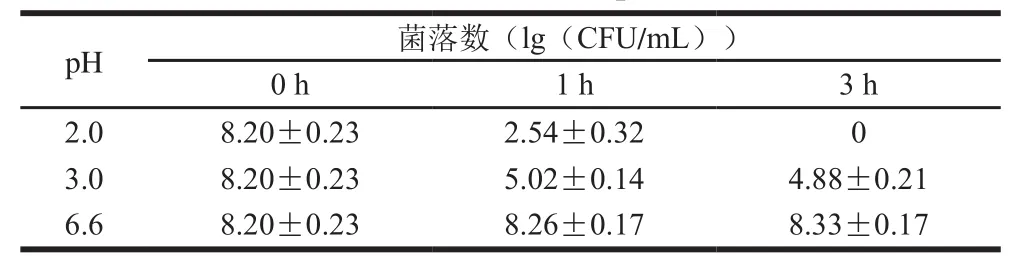
表2 植物乳杆菌Sc52的耐酸性Table 2 Acid resistance of L. plantarum Sc52
如表2所示,pH 6.6的条件下菌株生长良好,随着时间的延长活菌数呈上升趋势。pH 2.0条件下菌株的存活率明显低于pH 3.0,培养3 h未检测到活菌,由此可知低pH值能够明显杀死菌株或抑制菌株生长,这与Maragkoudakis等[15]研究的内容一致。pH 3.0的条件下,植物乳杆菌Sc52表现出了一定的耐酸性,培养3 h后,存活率仍在55%以上。有研究发现菌株的耐酸能力大小,与菌株的H+-ATP酶活性有关,由此推测,植物乳杆菌Sc52的耐酸性也可能与其H+-ATP酶活性有关[16]。
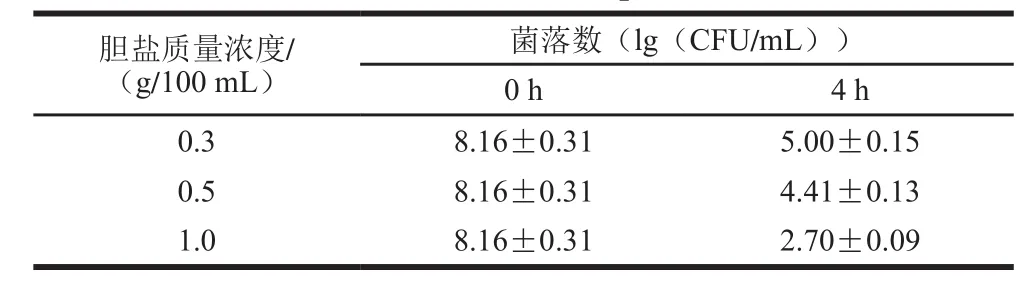
表3 植物乳杆菌Sc52的耐胆盐性Table 3 Bile tolerance of L. plantarum Sc52
如表3所示,在0.3 g/100 mL和0.5 g/100 mL胆盐质量浓度下,其存活率分别为61%和54%,随着胆盐质量浓度的增加,活菌数在不同程度的降低,但在1 g/100 mL胆盐质量浓度下培养4 h,其存活率仍有32%,表明植物乳杆菌Sc52有较强的胆盐耐受能力。有报道称,当乳酸菌受到高胆盐刺激时,细胞膜外强度的增加、胞外多糖的保护等可能是益生菌耐胆盐的机理[17-19]。
2.2 疏水性及自凝聚能力
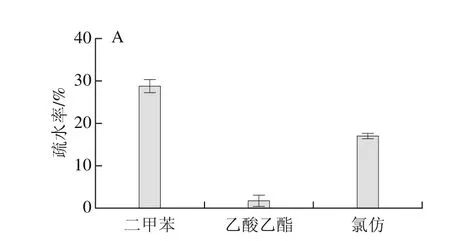
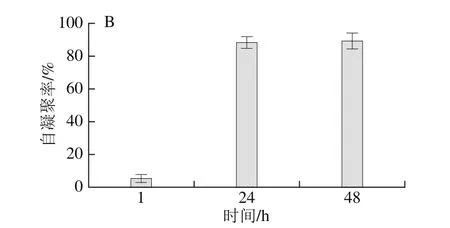
图1 植物乳杆菌Sc52的有机溶剂疏水性(A)及自凝聚性(B)Fig. 1 Hydrophobicity of L. plantarum Sc52 in organic solvent (A) and aggregation ability at different standing times (B)
图1 A为Sc52菌株对二甲苯、氯仿和乙酸乙酯3 种有机溶剂疏水能力的结果,疏水率的评价标准如下[20]:疏水率大于50%为高疏水性,疏水率介于20%和50%为中度疏水,疏水率小于20%为非疏水。植物乳杆菌Sc52在二甲苯溶剂中表现出中度疏水能力,而在乙酸乙酯和氯仿中表现出非疏水能力。通常疏水性高的菌株对细胞有较强的黏附能力,但是在Schillinger等[21]的研究中,一株疏水性只有2%的乳杆菌对细胞的黏附率为40%,同样条件下LGG的黏附率为25%。在考察自凝聚率方面,选择了3 个不同时间点进行测定,随着时间的延长,自凝聚率升高,在48h后,菌悬液上层呈澄清状态,自凝聚率达到(89±0.3)%(图1B)。自凝聚能力由菌株表面疏水性引起,同时与其黏附能力密切相关,高凝聚能力的菌株一般具有较高的黏附能力[22]。
2.3 抗生素对菌株的最低抑菌浓度
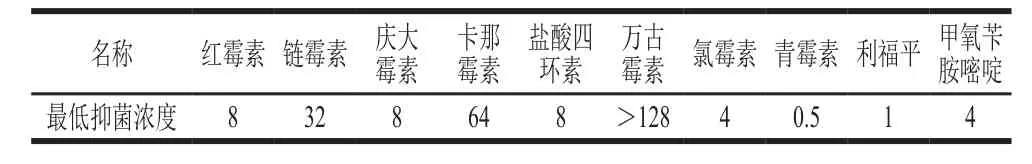
表4 不同抗生素对植物乳杆菌Sc52的最低抑菌浓度Table 4 Minimum inhibitory concentration (MIC) of different antibiotics against L. plantarum Sc52µg/mL
乳酸菌抗生素抗性是益生菌安全性评价中的一项重要环节[23]。如表4所示,植物乳杆菌Sc52对甲氧苄胺嘧啶、氯霉素、利福平、青霉素比较敏感,对链霉素和卡那霉素的最低抑菌浓度范围较大,对万古霉素表现出强耐药性,最低抑菌浓度大于128 µg/mL。有研究显示,多数乳酸菌对糖肽类抗生素万古霉素会产生耐药性[24],这与本实验结果相一致。
2.4 植物乳杆菌Sc52等多菌株发酵产品的降血糖作用
2.4.1 发酵产品对糖尿病小鼠一般状态的影响
实验通过高脂饮食联合STZ诱导2型糖尿病模型,与空白组相比,模型组小鼠毛发粗糙发黄,精神萎靡,出现多饮、多食、多尿,体质量减轻的“三多一少”症状,表明2型糖尿病造模成功。给予发酵产品治疗4 周后,观察小鼠的一般状态,与模型组相比,给药组小鼠毛发较之前润泽,精神状态良好,糖尿病症状减轻。
2.4.2 产品对2型糖尿病小鼠口服葡萄糖耐量的影响
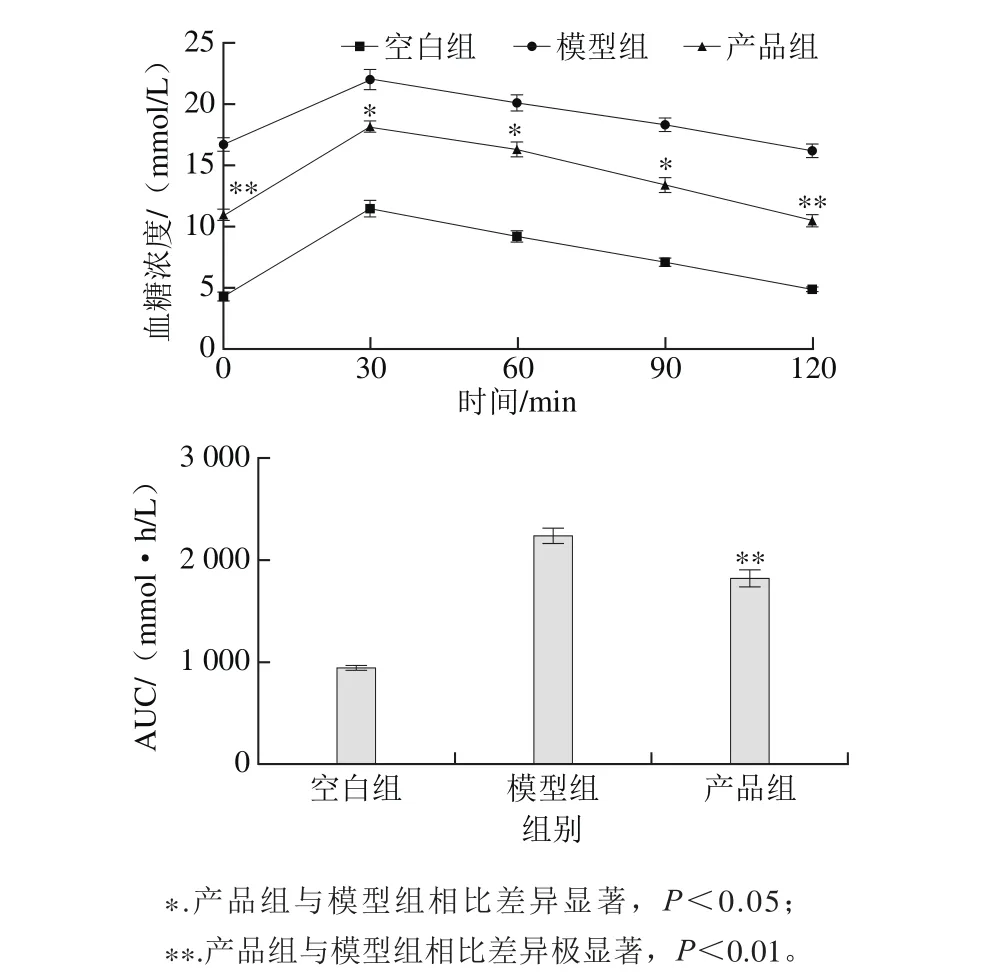
图2 发酵产品对2型糖尿病小鼠口服葡萄糖耐量及AUC的影响Fig. 2 Effect of fermented product on oral glucose tolerance and area under the curve in type 2 diabetic mice
如图2所示,各组小鼠在给予葡萄糖(2 g/kg)30 min后,血糖浓度均不同程度升高,达到峰值。但产品组的血糖值显著低于模型组(P<0.05),为模型组的78.2%,说明产品改善了糖尿病小鼠的血糖调控能力。随着时间的延长,血糖浓度均呈下降趋势,而模型组仍处在较高的水平上。120min后,空白组的血糖浓度基本回到灌胃前的水平,提示空白组小鼠口服葡萄糖耐量正常。然而模型组小鼠在120 min的血糖浓度高于0 min,说明模型组小鼠由于INS分泌不足基本丧失调节血糖的能力。经过治疗后的产品组在120 min的血糖浓度稍低于0 min时,与模型组相比有极显著差异(P<0.01),说明产品可以帮助机体有效改善血糖调控的能力,减缓餐后血糖升高。
2.4.3 发酵产品对2型糖尿病小鼠空腹血糖的影响

表5 发酵产品对2型糖尿病模型小鼠空腹血糖的影响Table 5 Effect of fermented product on fasting blood glucose in type 2 diabetes mellitus mice
如表5所示,第10周时,小鼠空腹血糖与空白组相比明显升高,10 周以后模型组数据稳定,与空白组相比有极显著差异,提示造模成功。在治疗期间,产品组小鼠空腹血糖呈下降趋势,从第11周开始小鼠空腹血糖得到明显抑制,到第14周时空腹血糖下降到11.00 mmol/L,与模型组相比有极显著差异(P<0.01)。结果表明发酵产品能明显降低2型糖尿病小鼠的空腹血糖值,对高血糖症有治疗作用。
2.4.4 发酵产品对2型糖尿病小鼠血清血脂水平、INS及TNF-α的影响
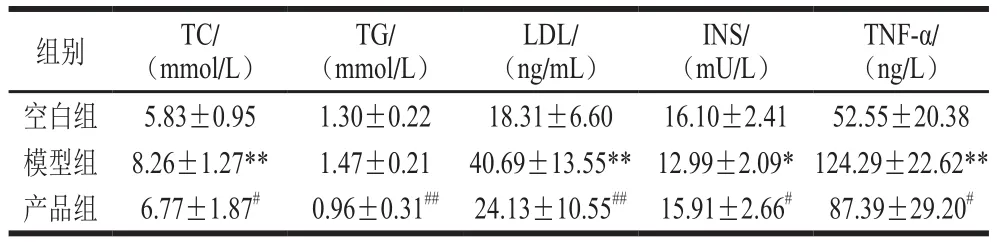
表6 发酵产品对2型糖尿病模型小鼠血脂、INS及TNF-α的影响Table 6 Effect of fermented product on serum lipids, insulin and tumor necrosis factor-α in type 2 diabetes mellitus mice
如表6所示,高脂饮食结合链脲佐菌素诱导小鼠建立2型糖尿病模型后,小鼠出现高血脂,模型组小鼠血清中TC、TG、LDL水平明显升高,TC、LDL水平与空白组相比差异极显著(P<0.01),小鼠血清INS水平显著降低(P<0.05),炎症因子TNF-α含量极显著升高(P<0.01)。给予发酵产品治疗4 周后,产品组小鼠血清中的TC、TG、LCL水平显著降低(P<0.01或P<0.05),TC降低到6.77 mmol/L,TG降低到0.96 mmol/L,INS水平显著升高(P<0.05),升高到15.91 mU/L,TNF-α的水平显著降低(P<0.05),降低到87.39 ng/L。结果表明,发酵产品可以降低2型糖尿病小鼠血清中TC、TG、LDL水平,同时对2型糖尿病小鼠的低INS症状有明显的改善,并能有效缓解机体的慢性炎症。
3 讨 论
益生菌进入人体消化道后,必须能够耐受胃酸及高胆盐的环境,以较高的活菌数到达肠道,并在肠道黏附和定植,才能发挥有效的益生作用,因此耐受性和黏附性等益生特性是筛选菌株的重要指标。前期已发表的研究结果表明,植物乳杆菌Sc52能够调节肠道微生物平衡,促进肠道益生菌生长,增加肠道短链脂肪酸含量,保护肠屏障,降低机体炎症反应等机制调节血糖,而这些功能作用的发挥与活菌能否有效到达肠道密切相关,因此本研究在前期实验证明菌株具有辅助降糖作用的基础上,分析了菌株耐酸、耐胆盐、黏附等益生特性。结果表明植物乳杆菌Sc52在低pH值及高胆盐环境中的存活率分别为55%及32%,表面疏水性和自凝聚率较高。与已报道的一些益生菌相比较,植物乳杆菌Sc52具有较强耐受和黏附等益生特性,例如,副干酪乳杆菌CD4和胃肠乳杆菌BTM7均能耐受pH 2.0及1%的胆盐环境,存活率分别为53.2%和28.6%[25];4 ℃条件下,干酪乳杆菌在pH 3.8的黄瓜汁中可以存活达2 个月以上,存活率在60%左右[26];瑞士乳杆菌T159具有较高的自凝聚率及疏水性,并且与人肠癌细胞的黏附率达到50%以上[27]。综上,植物乳杆菌Sc52是一株能耐受肠道环境,能在肠道黏附和定植的益生菌,有助于菌株通过调节肠道菌群、改善肠道功能发挥辅助降糖作用。
本研究在发酵产品配方上,选取具有降血脂功能菌株Q3-4、降血糖作用菌株CH126,抗氧化菌株C88[7]联合植物乳杆菌Sc52作为混合发酵剂,发酵由人参、桑叶、辣木叶、枸杞子等药食同源原料组成的降血糖复方提取物,获得辅助降糖的固体饮料产品。产品经动物体内实验证明具有较好的降糖降脂作用,并能促进胰岛细胞分泌。有研究报道利用植物乳杆菌NUC-C1制备发酵红参,发现在口服葡萄糖耐量实验中,灌胃发酵红参组血糖水平显著降低,TC和TG水平降低,血清中INS水平升高[28]。2型糖尿病受试者服用发酵红参粉4 周,有利于改善餐后血清血糖和INS水平[29]。益生菌与中药联合使用,通过发酵生物转化,能够提质增效,在预防和治疗各类疾病方面起到积极的作用。研究表明乳酸菌发酵中药后,产生的乳酸菌素、乳酸菌胞外多糖和有机酸,能转化产生新的小分子生物活性成分,提高了发酵产物的生物活性[30],例如不同益生菌发酵当归提取物的抗氧化活性及酪氨酸酶抑制活性显著高于未发酵提取物[31]。山参经长岐杆菌发酵后具有更强的抗氧化及抗炎活性[32],黄芪经发酵后还可以使黄芪甲苷含量明显提高[33]。本研究的结果充分体现了益生菌发酵药食同源原料协同增效和发酵生物转化的作用。但其作用机制还有待于深入研究。
综上所述,本研究通过体外实验分析,证明了辅助降糖植物乳杆菌Sc52是一株具有较好耐受性和黏附性的益生菌。将其与其他益生菌联合发酵药食同源原料,开发的固体饮料产品,具有明显的降血糖作用,为益生菌发酵药食同源原料开发健康食品提供了新的思路。
[1] FAO-WHO. Evaluation of health and nutritional properties of probiotics in food including powdermilk with live lactic acid bacteria[R]. Córdoba, Argentina: FAO/WHO, 2011.
[2] GIARDINA S, SCILIRONRI C, MICHELOTTI A, et al. In vitro anti-inflammatory activity of selected oxalate-degrading probiotic bacteria: potential applications in the prevention and treatment of hyperoxaluria[J]. Journal of Food Science, 2014, 79(3): M384-M390.DOI:10.1016/j.juro.2014.07.037.
[3] KASSAYOVA M, BOBROV N, STROJNY L, et al. Preventive eあects of probiotic bacteria Lactobacillus plantarum and dietary fiber in chemically-induced mammary carcinogenesis[J]. Anticancer Research,2014, 34(9): 4969-4975.
[4] LAU K, BENITEZ P, ARDISSONE A, et al. Inhibition of type 1 diabetes correlated to a Lactobacillus johnsonii N6. 2-mediated Th17 bias[J]. Journal of Immunology, 2011, 186(6): 3538-3546.DOI:10.4049/jimmunol.1001864.
[5] BEHNSEN J, DERIU E, SASSONE-CORSI M, et al. Probiotics: propertites,examples and specific applications[J]. Cold Spring Harbor Perspectives in Medicine, 2013, 3(3): 306-307. DOI:10.1101/cshperspect.a010074.
[6] HON Y F, KIM H, KIM H R, et al. Different immune regulatory potential of Lactobacillus plantarum and Lactobacillus sakei isolated from kimchi[J]. Journal of Microbiology & Biotechnology, 2014,24(12): 1629-1635. DOI:10.4014/jmb.1406.06062.
[7] LI S Y, ZHAO Y J, ZHANG L, et al. Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J]. Food Chemistry, 2012, 135(3): 1914-1919.DOI:10.1016/j.foodchem.2012.06.048.
[8] CHEN Y F, LIU W J, XUE J G, et al. Angiotensin-converting enzyme inhibitory activity of Lactobacillus helveticus strains from traditional fermented dairy foods and antihypertensive eあect of fermented milk of strain H9[J]. Journal of Dairy Science, 2014, 11(97): 6680-6692.DOI:10.3168/jds.2014-7962.
[9] JANKOVIC I, SYBESMA W, PHOTHIRATH P, et al. Application of probiotics in food products-challenges and new approaches[J]. Current Opinion in Biotechnology, 2010, 21(2): 175-181. DOI:10.1016/j.copbio.2010.03.009.
[10] 曲菲. 长白山地区发酵食品来源益生菌的分离、筛选及应用研究[D].哈尔滨: 东北农业大学, 2014: 8-9.
[11] 栾畅, 王宏伟, 何忠梅, 等. 植物乳杆菌Sc52联合牛蒡低聚果糖对2型糖尿病的治疗作用[J]. 食品科学, 2015, 36(21): 214-220.DOI:10.7506/spkx1002-6630-201521040.
[12] KOTZAMANIDIS C, KOURELIS A, LITOPOULOU-TZANETAKI E, et al. Evaluation of adhesion capacity, cell surface traits and immunomodulatory activity of presumptive probiotic Lactobacillus strains[J]. International Journal of Food Microbiology, 2010, 140(2):154-163. DOI:10.1016/j.ijfoodmicro.2010.04.004.
[13] 黄继汉, 黄晓晖, 陈志扬, 等. 药理实验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.
[14] 谷豪, 夏毅伟, 王飞, 等. 桃胶多糖、抗性淀粉、低聚果糖对糖耐量受损大鼠血糖的影响比较研究[J]. 热带医学杂志, 2013, 13(3):288-290.
[15] MARAGKOUDAKIS P A, ZOUMPOPOULOU G, MIARIS C, et al. Probiotic potential of Lactobacillus strains isolated from dairy products[J]. International Dairy Journal, 2006, 16(3): 189-199.DOI:10.1016/j.idairyj.2005.02.009.
[16] CALL E K, GOH Y J, SELLE K, et al. Sortase-deficient lactobacilli:eあect on immunomodulation and gut retention[J]. Microbiology, 2015,161(2): 311-321. DOI:10.1099/mic.0.000007.
[17] BUSTOS A, SAAVEDRA L, VALDEZ G, et al. Relationship between bile salt hydrolase activity, changes in the internal pH and tolerance to bile acids in lactic acid bacteria[J]. Biotechnology Letters, 2012, 34(8):1511-1518. DOI:10.1007/s10529-012-0932-5.
[18] 陈卫, 谭惠子, 胡斌. 益生菌对消化道胃酸和胆盐胁迫的应激机理[J]. 中国食品学报, 2010, 10(6): 1-6. DOI:10.3969/j.issn.1009-7848.2010.06.001.
[19] ALP G, ASLIM B. Relationship between the resistance to bile salts and low pH with exopolysaccharide (EPS) producton of Bifidobacterium spp. isolated from infants feces and breast milk[J]. Anaerobe, 2010,16(2): 101-105. DOI:10.1016/j.anaerobe.2009.06.006.
[20] 李华, 王杨, 李强, 等. 灿烂弧菌的疏水性和生物被膜形成能力[J]. 中国水产科学, 2011, 18(5): 1084-1090. DOI:10.3724/SP.J.1118.2011.01084.
[21] SCHILLINGER U, GUIGAS C, HERINRICH H W. In vitro adherence and other properties of lactobacilli used in probiotic yoghurt-like products[J]. International Dairy Journal, 2005, 15(12): 1289-1297.DOI:10.1016/j.idairyj.2004.12.008.
[22] 靳彩娟. 高黏附性乳酸菌的筛选、鉴定及其表面疏水特性研究[D].扬州: 扬州大学, 2013: 44-45.
[23] 孙之兰. 卷曲乳杆菌益生特性及黏附机理的研究[D]. 济南: 山东大学, 2012: 13.
[24] DELGADO S, FLOREZ A B, MAYO B. Antibiotic susceotibility of Lactobacillus and Bifidobacterium species from the human gastrointestinal tract[J]. Current Microbiology, 2005, 50: 202-207.DOI:10.1007/s00284-004-4431-3.
[25] SHARMA K, MAHAJAN R, ATTRI S, et al. Selection of indigenous Lactobacillus paracasei CD4 and Lactobacillus gastricus BTM 7 as probiotic: assessment of traits combined with principal component analysis[J]. Journal of Applied Microbiology, 2017, 122(5): 1310-1320. DOI:10.1111/jam.13426.
[26] SICUN F, FRED B, ROBERT P, et al. Survival and growth of probiotic lactic acid bacteria in refrigerated pickle products[J]. Food Science,2017, 82(1): 167-173. DOI:10.1111/1750-3841.13579.
[27] WASKO A, POLAK B M, PADUCH R, et al. The effect of moonlighting proteins on the adhesion and aggregation ability of Lactobacillus helveticus[J]. Anaerobe, 2014, 30: 161-168.DOI:10.1016/j.anaerobe.2014.10.002.
[28] HYUN J K, IN G C, SUNG G L, et al. Effects of fermented red ginseng extracts on hyperglycemia in streptozotocin-induced diabetic rats[J]. Journal of Ginseng Research, 2010, 34(2): 104-112.DOI:10.5142/jgr.2010.34.2.104.
[29] OH M R, PARK S H, KIM S Y, et al. Postprandial glucose-lowering effects of fermented red ginseng in subjects with impaired fasting glucose or type 2 diabetes: a randomized, double-blind, placebocontrolled clinical trial[J]. BMC Complementary and Alternative Medicine, 2014, 14: 237. DOI:10.1186/1472-6882-14-237.
[30] HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014,160: 346-356. DOI:10.1016/j.foodchem.2014.03.112.
[31] WANG G H, CHEN C Y, TAI T H, et al. Evaluation of tyrosinase inhibitory and antioxidant activities of Angelica dahurica root extracts for four different probiotic bacteria fermentations[J]. Journal of Bioscience and Bioengineering, 2017, 123(6): 679-684. DOI:10.1016/j.jbiosc.2017.01.003.
[32] PARK B G, JUNG H J, CHO Y W, et al. Potentiation of antioxidative and anti-inflammatory properties of cultured wild ginseng root extract through probiotic fermentation[J]. The Journal of Pharmacy and Pharmacology, 2013, 65(3): 457-464. DOI:10.1111/jphp.12004.
[33] 马伟, 贾艳姝, 刘秀波, 等. 保加利亚乳杆菌发酵黄芪工艺优化[J].中医药学报, 2012, 40(6): 44-46.
