大肠杆菌O157:H7的冷冻损伤及解冻存活
2018-03-20姬赛赛王娴静马晶晶蒋小燕袁换云禹金龙
姬赛赛,王娴静,马晶晶,蒋小燕,袁换云,禹金龙,江 芸*
(南京师范大学金陵女子学院,江苏 南京 210097)
食源性致病菌所致的食源性疾病是我国重要的食品安全问题。大肠杆菌O157:H7(Escherichia coli O157:H7)是引起人类致病的肠出血性大肠杆菌(enterohemorrhage E. coli,EHEC)最常见的血清型,可引起腹泻、出血性肠炎和溶血性尿毒综合症,后者病死率很高。该菌因感染剂量低、致病力强、危险性大,已经成为全球公认的食源性致病菌之一[1-2]。E. coli O157:H7可通过食物、水及接触进行传播,其中食源性传播最为普遍,可通过牛肉、羊肉等动物性食物为主要载体进行传播[3]。自1982年首次由美国报道了E. coli O157:H7引起的出血性肠炎暴发,随后诸多国家包括我国江苏、安徽等多个地区均有E. coli O157:H7感染的暴发流行。
冻藏是食品工业中常见的贮藏措施,可有效抑制微生物增殖,延长食品货架期。然而,研究表明冻藏可导致E. coli O157:H7等食源性致病菌产生亚致死损伤[4-6],损伤菌对选择性培养基中的一些物质敏感而不能生长[7-8],所以在常规安全检测中会被低估或出现假阴性。然而,已有研究表明,损伤菌在一定条件下可以修复为正常状态,恢复其致病性等生理特性[9-10],从而带来食品安全隐患。
损伤菌修复方面在国内外有大量报道,其中较多是关于修复方法的研究,一般采用营养丰富的培养基,或食品(如牛奶、肉)为基质以促进损伤菌的修复[9,11-15],增加检出率,防止漏检。但这些研究条件下并未区分正常菌的增殖和损伤菌的修复,所以若要单独探讨损伤菌的变化情况,则不宜采用营养丰富的基质。Koseki等[16]研究发现超高压损伤后的E. coli可在无营养的磷酸盐缓冲液(phosphate buffer saline,PBS)中修复,本课题组前期研究得到了同样结论[17],张勇等[18]亦发现冷冻24 h的E. coli ATCC25922在PBS中存在一定程度的修复,因此采用PBS作为修复基质时,因为不存在正常菌的生长和增殖,从而可以针对性地揭示损伤菌的存活情况。
冷冻食品,如不同种类的肉和肉制品,超市、农贸市场或家庭在不同季节因环境温度不同会自然解冻不同时间。采用不同温度进行解冻不仅对食品品质产生一定影响,对残存微生物的存活也会产生影响,进而对食品安全和货架期产生影响。因此,本实验首先研究E. coli O157:H7不同菌株冷冻后的死亡和损伤情况,进而采用无营养的PBS作为基质研究冷冻后不同自然解冻方式对E. coli O157:H7存活的影响。本实验摒除了正常菌的增殖,可更加真实地反映残存菌本身的存活情况,为冻藏食品中食源性致病菌的科学合理的风险评估和有效控制提供理论依据。
1 材料与方法
1.1 菌种与试剂
E. coli O157:H7 CICC21530为中国工业微生物菌种保藏管理中心,由南京农业大学国家肉品质量安全控制工程技术研究中心惠赠;E. coli O157:H7 NCTC12900购自广东环凯微生物科技有限公司;2 株分离自牛肉的E. coli O157:H7由南京农业大学江苏省动物源食品生产与安全保障重点实验室惠赠。4 株菌携带毒力基因情况不尽相同[8]。
胰蛋白胨大豆琼脂(tryptic soy agar,TSA)、山梨醇麦康凯琼脂(sorbital macconkey ager base,SMAC)、胰蛋白胨大豆肉汤(trypticase soy broth,TSB) 北京陆桥技术有限公司;磷酸二氢钠、磷酸氢二钠、氯化钠南京化学试剂有限公司。
1.2 仪器与设备
SZX超净工作台 上海浦东跃欣仪器厂;LDZX-30FBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SG403A Sterile GDRD生物安全柜 美国Baker公司;WGZ-2XJ细菌浊度计 上海昕瑞仪器仪表有限公司;QL-200微型涡旋混合仪 海门市其林贝尔仪器有限公司;HH-S2数显恒温水浴锅 金坛市医疗器械厂;2-16KL高速冷冻离心机 美国Sigma公司;BCD-248T冰箱 河南新飞电器有限公司;DHP-9052型电热恒温培养箱 上海一恒科技有限公司;ZQTY-70台式振荡培养箱 上海知楚仪器有限公司。
1.3 方法
1.3.1 菌悬液制备
将保藏的4 株E. coli O157:H7经TSA划线培养,37 ℃培养24 h,挑取单菌落接种于3 mL TSB中,37 ℃培养18 h,再转接至100 mL TSB中,37 ℃培养18~20 h。
1.3.2 冷冻及解冻实验
1.3.2.1 E. coli O157:H7不同菌株冷冻后存活情况
4 株E. coli O157:H7 TSB活化菌液,用浊度计调菌液浓度为108CFU/mL(1.005~1.010麦氏浊度单位),然后

1.4 统计分析
采用SPSS V17.0进行数据分析处理,采用ANOVA进行单因素方差分析中的Duncan’s多重比较检验(P<0.05),数据均以 ±s表示。用无菌生理盐水梯度稀释菌液至浓度106CFU/mL,并分装于灭菌的1.5 mL离心管中,分别置于-20 ℃冷冻处理24、48、72 h,采用TSA和SMAC进行传统培养计数,比较不同菌株死亡/冻伤情况,并计算损伤率。
1.3.2.2 冷冻后不同解冻方式对E. coli O157:H7存活的影响
4 株E. coli O157:H7 TSB活化菌液,4 ℃、6 000×g离心5 min,弃上清液,用灭菌PBS(pH 7.2)离心洗涤3 次,用浊度计调至浓度为108CFU/mL,无菌生理盐水梯度稀释菌液至浓度106CFU/mL,4 株菌的PBS菌液等量混合均匀,分装于灭菌的1.5 mL离心管中,置于-20 ℃冷冻处理一定时间,冷冻时间根据1.3.2.1节结果确定。进一步进行解冻实验,1)冷冻后不同解冻温度对E. coli O157:H7存活的影响:4 株菌的PBS混合菌液冷冻一定时间后,立即取出分别置于20、30、37 ℃解冻12、24、36、48 h,采用TSA进行传统培养计数,观察不同解冻温度对E. coli O157:H7存活的影响;2)冷冻后不同缓慢解冻方式对E. coli O157:H7存活的影响:4 株菌的PBS混合菌液冷冻一定时间后,将冷冻后菌体先置于4 ℃不同时间(0、2、6、12 h)再置于37 ℃不同时间(5、10、30 min),采用TSA和SMAC进行传统培养计数,观察菌株存活情况。上述冷冻及解冻实验,各处理组均做3个重复。
1.3.3 传统培养计数方法
待测菌液经系列10 倍梯度稀释,选择3 个合适稀释梯度,吸取100 μL至TSA或SMAC上,采用平板涂布法,37 ℃培养24 h,对E. coli O157:H7进行菌落计数。
根据两种平板上菌落数计算损伤率,非选择培养基TSA上的菌落数为未损伤、损伤和已繁殖的菌数,选择性培养基SMAC上的菌落数为未损伤、已修复、已繁殖的菌落数,计算公式如下[19]:
2 结果与分析
2.1 E. coli O157:H7不同菌株冷冻后菌落数变化
4 株E. coli O157:H7分别置于-20 ℃冷冻处理24、48、72 h,采用传统培养计数,比较不同菌株死亡/冻伤情况。由图1可知,与冷冻前相比,4 株菌冷冻后两种培养基TSA和SMAC上的菌落数均显著下降(P<0.05),冷冻时间越长,菌落数下降越多,表明冷冻导致细菌发生了死亡和损伤,且冷冻时间越长细菌致死和致伤效果越明显。进一步比较发现,冷冻相同时间时,不同菌株菌落数的下降并不相同,表明冷冻造成细菌死亡和损伤程度存在菌株差异。
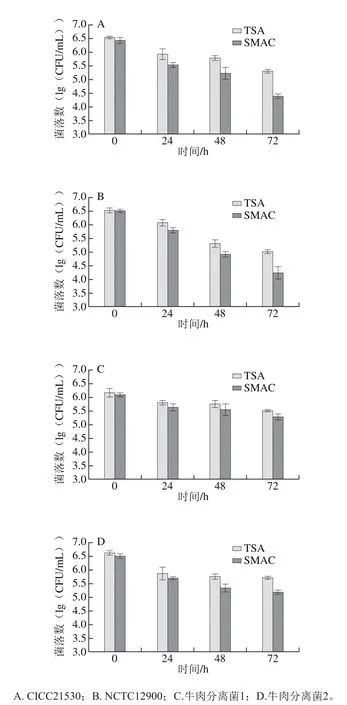
图1 E. coli O157:H7冷冻不同时间后的菌落数Fig. 1 E. coli O157:H7 counts after freezing for different times
正常菌和损伤菌均能在非选择性平板TSA上生长,而选择性平板SMAC上只有正常未损伤菌可以生长,因此非选择性平板上菌落数与选择性平板上菌落数的差值可以反映损伤菌的数量。由图1可知,4 株菌两种平板上的菌落数差值(损伤菌数量)在不同冷冻时间不尽相同,在冷冻72 h时菌株CICC21530、NCTC12900、两株牛肉分离菌在两种平板上的菌落数差值分别为0.91、0.77、0.23、0.52(lg(CFU/mL))。进一步计算4 株E. coli O157:H7冷冻不同时间于活菌中的损伤率,如表1所示,随着冷冻时间的延长,损伤率逐渐增大,进一步比较不同菌株的损伤率发现,冷冻过程中4 株菌损伤率不尽相同,冷冻72 h时菌株CICC21530的损伤率最高,达到87.70%。冷冻对微生物的影响与细胞内冰晶形成所致的结构损伤有关,还与溶质损伤、脱水、氧化胁迫等有关[20-21],导致细菌发生可逆性损伤甚至死亡。值得注意的是,由于选择性培养基SMAC中存在一些抑菌物质,所以冷冻前SMAC上的菌落数稍低于TSA(P>0.05),即存在一定的损伤率(表1中0 h)。
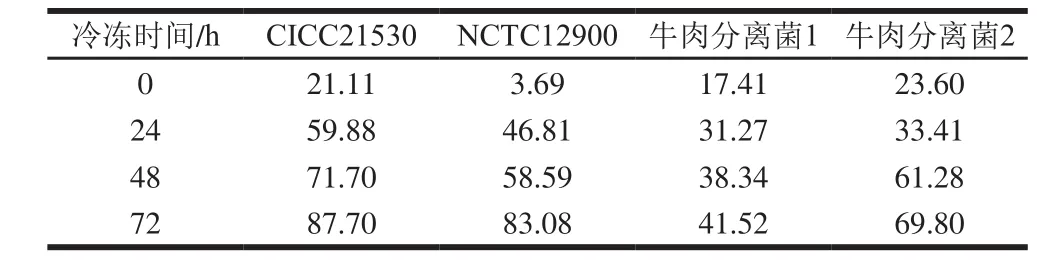
表1 4 株E. coli O157:H7冷冻不同时间后的损伤率Table 1 Injury rates of four E. coli O157: H7 strains after freezing for different times%
Ro等[22]研究发现接种于肉制品的EHEC冷冻180 d后菌数未发生显著变化;Metzger等[23]报道接种于奶酪的单核细胞性李斯特菌、金黄色葡萄球菌于-20 ℃冷冻30 d后菌数未发生显著下降,而E. coli O157:H7和伤寒沙门菌则显著下降;Manios等[6]报道接种于绞碎牛肉中的沙门菌和E. coli O157:H7 -22 ℃冷冻5 d时均发生了显著下降,并产生了一定量的损伤菌体,继续冷冻至75 d时两种致病菌数量未进一步下降。上述研究报道以及本实验的发现并不完全一致,主要原因是微生物死亡和损伤程度与冷冻条件、菌液基质、菌种、菌株等有关[4-5]。
2.2 冷冻后不同解冻温度对E. coli O157:H7存活的影响
由2.1节结果可知,E. coli O157:H7冷冻72 h时产生了较大的损伤和死亡,且存在菌株差异,因此进一步采用混合菌株进行解冻实验,同时为了避免正常菌增殖的干扰,采用无营养的PBS作为基质。4 株菌的PBS混合菌液冷冻前TSA上的初始菌落数为6.48(lg(CFU/mL)),冷冻72 h后菌落数显著下降(P<0.05)。冷冻后的PBS混合菌液分别置于20、30、37 ℃解冻不同时间,由图2可知,3 种温度条件下菌落数均继续下降,且解冻温度越高下降越明显,至24 h时3 个解冻温度组TSA菌落数均显著低于冷冻72 h(冷冻后)时菌落数(P<0.05),且20 ℃、24 h显著高于30 ℃、24 h和37 ℃、24 h菌落数(P<0.05)。解冻36 h和48 h时,20 ℃和30 ℃菌落数未再出现显著变化(P>0.05),而37 ℃、36 h菌落数显著增加(P<0.05),之后无显著性变化;至实验末期48 h时3 个解冻温度组菌落数均显著低于冷冻72 h时菌落数(P<0.05)。

图2 不同解冻温度条件下E. coli O157:H7存活情况Fig. 2 Survival rates of E. coli O157:H7 thawed at different temperatures
本实验结果表明,E. coli O157:H7 PBS菌液冷冻后立即置于20、30、37 ℃解冻,细菌发生了进一步的死亡,解冻温度越高死亡越明显。这可能是从-20 ℃立即转入较高温度时,菌体无法适应环境的突然变化而加重了应激损伤程度。但是,张勇等[18]对冷冻24 h的E. coli ATCC25922进行4 h内最佳修复方法研究时发现冷冻后PBS菌液于25 ℃和37 ℃时,发生了修复甚至菌数增加,并未发生进一步的死亡。本实验与其研究结果不一致,可能与冷冻时间、修复时间、不同菌株等有关。冷冻解冻过程中,细胞内相关基因相关蛋白发生变化,主要的应激蛋白包括热应激蛋白和冷应激蛋白[24]。黄忠明等[25]将TSB+0.6% YE培养的金黄色葡萄球菌-18 ℃冻藏90 d后于37 ℃修复,发现细胞膜相关基因msrR和抗氧化应激相关基因fhuC表达量显著下调,而产能代谢相关基因cytB表达量显著上调,认为冷冻损伤的金黄色葡萄球菌的修复可能与细胞表面的修复、细胞中活性氧含量降低以及产能代谢活动逐渐增强有关。关于无营养PBS基质中细菌的冷冻解冻存活的分子机制值得进一步研究。
采用非选择性培养基如TSA、TSAYE等进行培养计数,相当于是一种固体修复方法。早期即有研究表明,最佳修复培养基的成分及培养条件与应激种类、损伤程度和机制、菌种和菌株等有关[26]。例如,单核细胞性李斯特菌损伤后,采用非选择性平板TSAYE计数时30 ℃培养温度比37 ℃更有利于其盐、酸损伤的修复;在TSAYE上添加过氧化氢酶、D-葡萄糖有利于其盐和酸损伤的修复,添加硫酸镁有利于其热损伤的修复,而对盐、酸应激损伤无影响[27-28]。Gurtler等[29]研究发现TSA平板中添加FeSO4、硫代二丙酸、丙酮酸钠可增加热损伤沙门菌的修复。Manios等[6]研究冻伤对沙门菌影响时采用TSA添加1%丙酮酸盐作为非选择性计数培养基以增加损伤菌的修复。PBS作为一种无营养基质,损伤菌可以修复而正常菌不出现增殖[16],本实验中37 ℃解冻36 h时菌落数出现增加,可能是解冻初期冷冻损伤严重的菌体采用TSA、37 ℃培养计数时并未得到完全修复生长,至解冻36 h时有更多的修复菌体能够在TSA、37 ℃条件下生长,从而使菌落数出现增加,其具体机制尚需进一步研究。本实验结果表明,冷冻后立即于较高温度下解冻不利于细菌的存活。为了探讨在缓慢解冻时细菌的存活情况,进一步进行冷冻后缓慢解冻方式对E. coli O157:H7存活影响的实验。
2.3 冷冻后不同缓慢解冻方式对E. coli O157:H7存活的影响
4 株菌的PBS混合菌液冷冻72 h后先置于4 ℃一定时间(0、2、6、12 h),再置于37 ℃不同时间(5、10、30 min)观察菌株存活情况,如图3所示,冷冻前TSA上的初始菌落数为6.33(lg(CFU/mL))。冷冻后于4 ℃解冻0、2、6、12 h再置于37 ℃,与冷冻前相比两种培养基上的菌落数均显著低于冷冻前(P<0.05),仅除了4 ℃、12 h/37 ℃、5 min组TSA上的菌落数(P>0.05),表明缓慢解冻仍造成了一定量细菌的死亡/损伤。4 ℃放置一定时间后,置于37 ℃、5 min,37 ℃、10 min,37 ℃、30 min各组两种平板上的菌落数均稍有下降,显著性分析具体结果见图3。
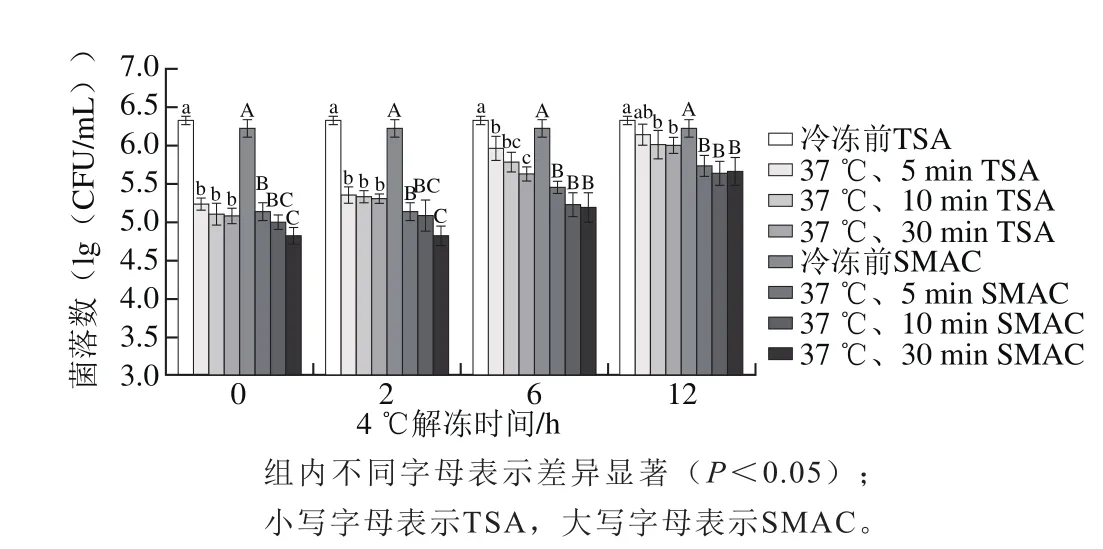
图3 不同缓慢解冻方式条件下E. coli O157:H7存活情况Fig. 3 Survival rates of E. coli O157:H7 treated by different slow thawing methods
进一步对37 ℃、5 min的各组进行比较时发现,4 ℃条件下时间越长菌数越多,4 ℃ 0 h和2 h之间菌落数无显著差异,而4 ℃ 6 h和12 h菌落数显著高于4 ℃ 0 h和2 h(P<0.05)。37 ℃、10 min各组和37 ℃、30 min各组亦存在相似变化趋势。结果表明4 ℃缓慢解冻时间越长,越有利于细菌的存活。分析原因可能是4 ℃放置较短时间后转入37 ℃时,菌体无法适应温度的突然变化而加重应激损伤程度造成了进一步的死亡,当4 ℃放置较长时间后转入37 ℃时,细菌得到足够时间的缓冲对较高温度耐受增强,也可能在4 ℃较长时间时菌体存在一定程度的修复,具体机制有待进一步研究。
Metzger等[23]报道接种于奶酪的单核细胞性李斯特菌、金黄色葡萄球菌-20 ℃冷冻30 d后分别采用4 ℃、14 h和20 ℃、4 h进行解冻,结果两种解冻方式之间菌数无显著差异。Manios等[6]报道接种于绞碎牛肉的沙门菌和E. coli O157:H7 -22 ℃冷冻5、75 d后,分别采用冰箱(4 ℃、16 h)、室温(20 ℃、12 h)、微波22~24 min进行解冻,结果冰箱解冻或微波解冻与解冻前菌数无显著性差异,而室温解冻与解冻前菌数相比两种菌均有所增加,且E. coli O157:H7菌数显著增加。本实验采用无营养PBS基质的解冻实验结论不一致,表明解冻对细菌存活的影响与基质存在较大关系。
本实验采用4 ℃、12 h/37 ℃、5~30 min解冻,TSA上菌落数无显著差异,SMAC上的亦无显著性差异,而SMAC上的菌落数显著低于TSA上的菌落数(P<0.05),表明尚有一定量损伤菌存在。本实验结果提示,食品生产中采用“缓慢解冻”方式,在保证食品品质的同时,也有利于食源性致病菌的存活,因此在冷冻食品风险控制时除了常规检测外,还应重视损伤菌的检测,以防漏检或低估。
3 结 论
本实验首先研究E. coli O157:H7不同菌株冷冻后的死亡和损伤情况,然后采用无营养的PBS作为基质研究冷冻后不同解冻方式对E. coli O157:H7存活的影响。结论如下:1)实验的4 株E. coli O157:H7冷冻后发生了一定程度的死亡和损伤,冷冻时间越长细菌致死和致伤程度越明显,且存在菌株差异,冷冻72 h时菌株CICC21530的损伤率最高。2)采用混合菌株进行解冻实验,E. coli O157:H7 PBS菌液冷冻后立即于20、30、37 ℃解冻,细菌发生了进一步的死亡,解冻温度越高死亡越明显。3)进一步探讨缓慢解冻方式对菌体存活的影响,结果表明4 ℃缓慢解冻时间越长,越有利于细菌的存活,但实验末期仍有一定量损伤菌存在。本实验提示冷冻食品风险评估时应重视对残存菌尤其是损伤菌的检测和控制。
[1] ATKINSON R, JOHNSON G, ROOT T, et al. Importance of culture confirmation of Shiga toxin-producing Escherichia coli infection as illustrated by outbreaks of gastroenteritis: New York and North Carolina, 2005[J]. Morbidity and Mortality Weekly Report, 2006,55(38): 1042-1045. DOI:10.1037/e550322006-003.
[2] MAGWEDERE K, DANG H A, MILLS E W, et al. Incidence of Shiga toxin-producing Escherichia coli strains in beef, pork,chicken, deer, boar, bison, and rabbit retail meat[J]. Journal of Veterinary Diagnostic Investigation, 2013, 25(2): 254-258.DOI:10.1177/1040638713477407.
[3] HESSAIN A M, AL-ARFAJ A A, ZAKRI A M, et al. Molecular characterization of Escherichia coli O157:H7 recovered from meat and meat products relevant to human health in Riyadh, Saudi Arabia[J]. Saudi Journal of Biological Sciences, 2015, 22: 725-729.DOI:10.1016/j.sjbs.2015.06.009.
[4] DYKES G A. The eあect of freezing on the survival of Escherichia coli O157:H7 on beef trimmings[J]. Food Research International,2000, 33(5): 387-392. DOI:10.1016/S0963-9969(00)00060-0.
[5] RESTAINO L, FRAMPTON E W, SPITZ H. Repair and growth of heat- and freeze-injured Escherichia coli O157:H7 in selective enrichment broths[J]. Food Microbiology, 2001, 18(6): 617-629.DOI:10.1006/fmic.2001.0427.
[6] MANIOS S G, SKANDAMIS P N. Eあect of frozen storage, diあerent thawing methods and cooking processes on the survival of Salmonella spp. and Escherichia coli O157:H7 in commercially shaped beef patties[J]. Meat Science, 2015, 101(1): 25-32. DOI:10.1016/j.meatsci.2014.10.031.
[7] WU V C H, FUNG D Y C. Evaluation of thin agar layer method for recovery of heat-injured foodborne pathogens[J]. Journal of Food Science, 2001, 66(4): 580-583. DOI:10.1111/j.1365-2621.2001.tb04605.x.
[8] 水新云, 王虎虎, 高峰, 等. 4 株E. coli O157:H7毒力基因检测及其冷应激损伤[J]. 食品科学, 2016, 37(4): 176-180. DOI:10.7506/spkx1002-6630-201604031.
[9] WU V C H. A review of microbial injury and recovery methods in food[J]. Food Microbiology, 2008, 25(6): 735-744. DOI:10.1016/j.fm.2008.04.011.
[10] HOUSE B, KUS J V, PRAYITNO N, et al. Acid-stress-induced changes in enterohaemorrhagic Escherichia coli O157:H7 virulence[J].Microbiology, 2009, 155(9): 2907-2918. DOI:10.1099/mic.0.025171-0.
[11] FUSCO V, RICCARDI M, QUERO G M. Thin agar layer- versus most probable number-PCR to enumerate viable and stressed Escherichia coli O157:H7 and application in a traditional raw milk pasta filata cheese[J]. International Journal of Food Microbiology, 2012, 159(1):1-8. DOI:10.1016/j.ijfoodmicro.2012.07.013.
[12] ZHENG Q, BUSTANDI C, YANG Y, et al. Comparison of enrichment broths for the recovery of healthy and heat-injured Salmonella Typhimurium on raw duck wings[J]. Journal of Food Protection, 2013,76(11): 1963-1968. DOI:10.4315/0362-028X.JFP-13-041.
[13] BULL M K, HAYMAN M M, STEWART C M, et al. Eあect of prior growth temperature, type of enrichment medium, and temperature and time of storage on recovery of Listeria monocytogenes following high pressure processing of milk[J]. International Journal of Food Microbiology, 2005, 101(1): 53-61. DOI:10.1016/j.ijfoodmicro.2004.10.045.
[14] WALKLING-RIBEIRO M, ANANY H, GRIFFITHS M W.Effect of heat-assisted pulsed electric fields and bacteriophage on enterohemorrhagic Escherichia coli O157:H7[J]. Biotechnology Progress, 2015, 31(1): 110-118. DOI:10.1002/btpr.2014.
[15] 水新云. 超高压诱导大肠杆菌O157:H7损伤及损伤后修复生长研究[D].南京: 南京师范大学, 2015.
[16] KOSEKI S, YAMAMOTO K. Recovery of Escherichia coli ATCC 25922 in phosphate buffered saline after treatment with high hydrostatic pressure[J]. International Journal of Food Microbiology,2006, 110(1): 108-111. DOI:10.1016/j.ijfoodmicro.2006.01.039.
[17] 袁文静. 超高压致大肠杆菌O157:H7损伤后的修复机理研究[D].南京: 南京师范大学, 2016.
[18] 张勇, 刘衡川, 殷强仲, 等. -20 ℃冷冻损伤大肠杆菌修复的研究[J]. 中国卫生检验杂志, 2005, 15(3): 289-292. DOI:10.3969/j.issn.1004-8685.2005.03.013.
[19] JASSON V, UYTTENDAELE M, RAJKOVIC A, et al. Establishment of procedures provoking sub-lethal injury of Listeria monocytogenes,Campylobacter jejuni and Escherichia coli O157 to serve method performance testing[J]. International Journal of Food Microbiology,2007, 118(3): 241-249. DOI:10.1016/j.ijfoodmicro.2007.07.016.
[20] ELKEST S E, MARTH E H. Freezing of Listeria monocytogenes and other microorganisms: a review[J]. Journal of Food Protection,1992, 55(8): 639-648. DOI:10.4315/0362-028X-55.8.639.
[21] SUN D. Handbook of frozen food processing and packaging[M].Boca Raton, FL: CRC Taylor and Francis, 2005: 3-32.
[22] RO E Y, KO Y M, YOON K S. Survival of pathogenic enterohemorrhagic Escherichia coli (EHEC) and control with calcium oxide in frozen meat products[J]. Food Microbiology, 2015, 49(1):203-210. DOI:10.1016/j.fm.2015.02.010.
[23] METZGER N, ALVAREZ-ORDÓÑEZ A, LEONG D, et al. Survival of foodborne pathogens during frozen storage of cheese made from artificially inoculated milk[J]. Dairy Science & Technology, 2015,95(5): 759-767. DOI:10.1007/s13594-015-0233-6.
[24] AI-FAGEEH M B, SMALES C M. Control and regulation of the cellular responses to cold shock: the response in yeast and mammalian systems[J]. Biochemical Journal, 2006, 397(2): 247-259.DOI:10.1042/BJ20060166.
[25] 黄忠明, 吕海鹏, 艾志录, 等. 冷冻致亚致死损伤的金黄色葡萄球菌修复机制[J]. 微生物学报, 2015, 55(11): 1409-1417. DOI:10.13343/j.cnki.wsxb.20150081.
[26] MOSSEL D A A, CORRY J E L. Detection and enumeration of sublethally injured pathogenic and index bacteria in foods and water processed for safety[J]. Alimenta-Sonderausgabe, 1977, 16(1): 19-34.
[27] BUSH S V, DONNELLY C W. Development of a repair-enrichment broth for resuscitation of heat-injured Listeria monocytogenes and Listeria innocua[J]. Applied and Environmental Microbiology, 1992,58(1): 14-20. DOI:0099-2240/92/010014-07$02.00/0.
[28] BESSE N G, BRISSONNET F D, LAFARGE V, et al. Effect of various environmental parameters on the recovery of sublethally saltdamaged and acid-damaged Listeria monocytogenes[J]. Journal of Applied Microbiology, 2000, 89(6): 944-950. DOI:10.1046/j.1365-2672.2000.01195.x.
[29] GURTLER J B, KORNACKI J L. Comparison of supplements to enhance recovery of heat-injured Salmonella from egg albumen[J].Letters in Applied Microbiology, 2009, 49(4): 503-509. DOI:10.1111/j.1472-765X.2009.02695.x.
