β-乳球蛋白纤维化过程中的界面及乳化性质
2018-03-20高志明吴彬娴林展拓赵俊俊方亚鹏
黄 颖,高志明,2,吴彬娴,林展拓,赵俊俊,方亚鹏,2,*
(1.湖北工业大学 菲利普斯亲水胶体研究中心,湖北 武汉 430068;2.工业发酵湖北省协同创新中心,湖北 武汉 430068)
β-乳球蛋白是乳清蛋白的主要成分[1],约占乳清蛋白总量的50%。β-乳球蛋白分子质量约为18.4 kDa[2],等电点为5.1~5.3,含有162 个氨基酸残基[3],具有良好的凝胶,起泡和乳化性能[4]。在一定条件下,蛋白质单体经过构象改变,β-折叠增多并重新排列而发生聚集[5-6],这种聚集可以产生蛋白质纳米纤维。蛋白质纳米纤维是蛋白质在低pH值(例如pH 2.0~3.0)条件下进行热处理得到的长直型自组装产物,其直径和长度尺寸分别在2~5 nm和200 nm~15 μm范围内,是具有较大长径比的形状各向异性材料。Dietler等[7]通过原子力显微镜表征了蛋白质纳米纤维的精细结构,认为蛋白质纳米纤维最初形成“原纤维”即单股聚集体,然后经过螺旋缠绕逐步形成多股螺旋结构,形成成熟的纳米纤维。蛋白质纳米纤维具有许多特殊的物理化学特性以及生物特性,例如具有良好的表面活性和细胞穿透性[8-11],可被用于药物载体的构建以强化细胞吸收。同时因其良好的流变特性,可用作增稠剂和凝胶填充物[12-13]。蛋白质纤维聚集体具有特殊的表面活性。Mezzenga等[14]比较了天然β-乳球蛋白及其纳米纤维在油水和汽水界面的吸附和剪切流变性质,发现热处理蛋白形成的纤维聚集体可以吸附于油水界面,其界面剪切模量明显高于天然蛋白质。该研究还发现,未转化成纤维聚集体的多肽的存在有可能会提高蛋白界面吸附和乳化性质。该团队还发现,改变水相的pH值和离子强度,蛋白质纤维聚集体在油水界面具有不同的排列模式,并产生不同的界面流变特性[15-16]。Gao Zhiming等[17]也曾对蛋白质纳米纤维的乳化活性做过报道。
蛋白质纤维化转变过程较长(约4~10 h),其形成过程较为复杂。在纤维生成的不同阶段,其产物的组成、结构、尺寸以及界面性质及乳化活性均不同。本实验主要针对β-乳球蛋白在纤维形成的不同阶段,研究其产物的界面及乳化活性,为其在食品工业中的合理利用提供理论依据,特别是富含蛋白质的饮料[18-19]。
1 材料与方法
1.1 材料与试剂
食用大豆油 市售;β-乳球蛋白(蛋白质干基质量分数97%,其中β-乳球蛋白占95.9%) 美国Davisco食品公司;硫磺素T(thioflavin-T,ThT)、硅镁型吸附剂/氟罗里硅土(Florisil分子筛,60~100 目) 美国Sigma-Aldrich公司。
1.2 仪器与设备
EL204型分析天平 梅特勒-托利多仪器(上海)有限公司;Direct Q3型超纯水机 美国Merck Millipore公司;FE-20 FiveEasy Plus pH计 梅特勒-托利多国际股份有限公司;F-7000荧光分光光度计 日本日立公司;Multifuge高速冷冻离心机 赛默飞世尔科技(中国)有限公司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;JEM-2100(HR)透射电子显微镜 日本电子Jeol公司;TRACKER界面流变仪 法国Teclis界面技术有限公司;PT-MR 2100型高速剪切乳化机 瑞士Kinematica公司;Mastersizer 2000型激光粒度仪 英国Malvern公司。
1.3 方法
1.3.1 蛋白质纳米纤维的制备
将β-乳球蛋白分散于去离子水中(2%),室温搅拌2 h,使其充分水化。调节蛋白质分散液pH 2.0,置于80 ℃水浴锅加热20 h,此过程持续磁力搅拌,每隔2 h定时取样,取出后立即浸没在冰水混合物中,冷却20 min,随后保存于冰箱备用。
1.3.2 蛋白质纳米纤维形成动力学表征
将12.0 mg ThT溶解于10 mL去离子水中,充分溶解后,用0.22 μm水相滤膜过滤,于4 ℃冰箱中避光保存。在制备β-乳球蛋白纳米纤维的过程中,取不同加热时间样品2.98 mL,加入20 µL ThT储藏液,均匀混合,反应1 min后进行测量。激发和发射波长分别为450 nm和482 nm,激发和发射狭缝均为5 nm,电压为400 mV。
1.3.3 透射电子显微镜
将β-乳球蛋白纤维分散液用pH 2.0的去离子水稀释到质量分数为0.05%,在水浴超声清洗装置中以功率50%超声处理10 min,促进样品分散。接着,用移液枪吸取10 μL样品滴至铜网上,自然晾干,随后用毛细管吸取2 g/100 mL的磷钨酸(水浴超声30 min,100%功率,且用0.22 μm水相滤膜过滤)滴至样品表层,再次晾干后进行电镜观察。
1.3.4 界面吸附和界面流变行为分析
分别通过分析蛋白质纤维聚集体在界面吸附过程中的界面张力变化和膨胀黏弹模量的变化分析其界面吸附行为和界面流变行为。取不同阶段所形成的混合分散体系稀释至质量分数0.01%并调pH 3.5后进行界面分析,选取界面流变仪的悬滴模式检测样品在油-水界面上的吸附情况。量取5 mL混合分散液于样品槽中,将U形样品针浸入水相中,并通过马达控制形成10 μL的油滴。该实验在室温条件下进行,测定时间持续12 000 s,测试频率0.05 Hz,振幅10%。在检测过程中,整个检测系统应保持平衡,避免外界振动干扰测量。
由于食用大豆油中含有的少量小分子表面活性成分容易对测定结果产生干扰,因此使用前需要进行纯化。参考Gaonkar等[20]的方法,在100 mL食用大豆油中加入3 g Florisil分子筛吸附剂,随后搅拌0.5 h,静置5 min,5 000 r/min离心20 min,再加入新的吸附剂,重复上述操作3 次,收集纯化后的大豆油,利用界面流变仪测定去离子水的界面张力,直到其界面张力在30 min内下降不超过0.5 mN/m即可满足要求。纯化后大豆油的密度为 0.914 2 g/cm3,去离子水与油相的界面张力为(27±0.1)mN/m。
1.3.5 乳液制备及表征
乳液的制备:将一定量的β-乳球蛋白纤维化产物用去离子水稀释至一定浓度,并用1 mol/L NaOH溶液调pH值至3.5,加入大豆油,配成蛋白总质量分数为0.5%,油量体积分数为10%的混合液,采用高速剪切进行乳化20 000 r/min离心2 min,乳液中添加0.4 g/L的叠氮钠防菌。
粒径分析:以去离子水为分散介质,采用Mastersizer 2000激光粒度仪测定乳液粒径分布及平均粒径。测定加样前先将乳液轻微振荡摇匀,再逐滴加至分散介质中,直到信号满足测试要求。分散相和连续相的折光指数分别采用1.475和1.33,遮光度为10%~20%,样品的吸收率为0.1%,泵转速为2 000 r/min。每个样品平行测量3 次,取平均值。
2 结果与分析
2.1 β-乳球蛋白纳米纤维形成动力学
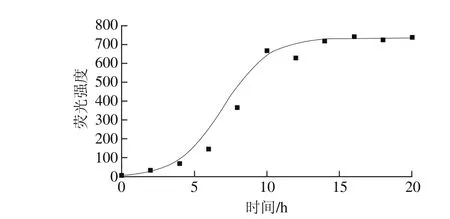
图1 加热不同时间的β-乳球蛋白纳米纤维的ThT荧光强度Fig. 1 Thioflavin T fluorescence intensity of β-lactoglobulin fibrils at different heating times
ThT荧光染色法是检测蛋白质纤维化的典型方法。ThT通过与蛋白质纤维中β-折叠结构的特异性结合而具有特定的荧光行为。该方法可以检测β-折叠结构的变化从而获得纤维化程度的信息,即形成的蛋白质纤维的数量。ThT荧光强度越强,意味着形成的蛋白质纤维越多[21-23]。从图1可以看出,荧光强度随着加热时间延长逐渐增加。在热处理的前4 h内荧光强度的增加较为缓慢,随后则快速增加。大约10 h后,曲线出现平台区,荧光强度值保持相对稳定,意味着蛋白质纤维化转变已经完成。本实验观察到的现象与其他蛋白质相关现象类似[18,24]。
2.2 β-乳球蛋白纤维聚集体形成过程中的形貌变化
如图2所示,在开始阶段(图2A),β-乳球蛋白呈现出均匀球状,粒径约为30~40 nm,分散良好。加热0.5 h后(图2B)可观察到球状蛋白粒径开始减小,而分布更加密集,可能由于蛋白质的水解导致[25-26]。直到加热2 h后(图2D),开始出现明显的蛋白质纳米纤维,但纤维数量较少。进一步加热会导致纤维数量增加,直径变粗(图2E、F)。Mezzenga等[27]研究了纤维的形成机理及过程,发现蛋白质分子在反应初始阶段发生水解,然后部分以β-折叠结构为主的片段在静电排斥力和疏水相互作用的平衡下进行有序聚集,即自组装作用,形成纤维状聚集物。一旦纤维开始形成,其生长的进程快且双向进行,最后形成具有长直结构的蛋白质纤维。从图2可以得出,在蛋白质纤维化转变的不同阶段,其产物的组成、形貌是不同的,意味着其界面性质的差异。
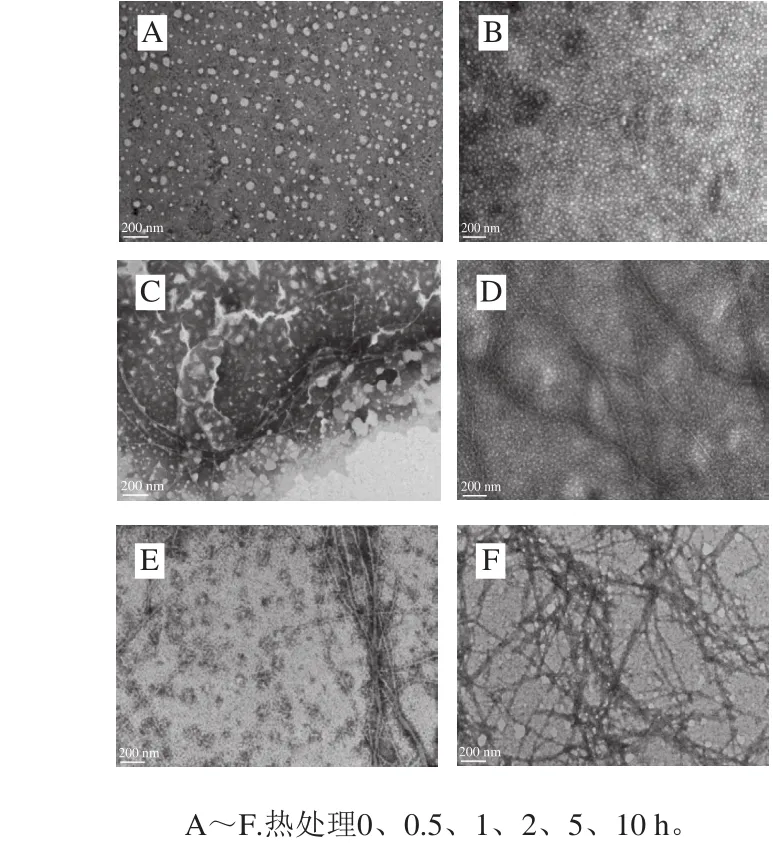
图2 加热不同时间形成的β-乳球蛋白纳米纤维的透射电子显微镜图Fig. 2 TEM of β-lactoglobulin fibrils heated for different times
2.3 纤维化过程中β-乳球蛋白界面性质的变化
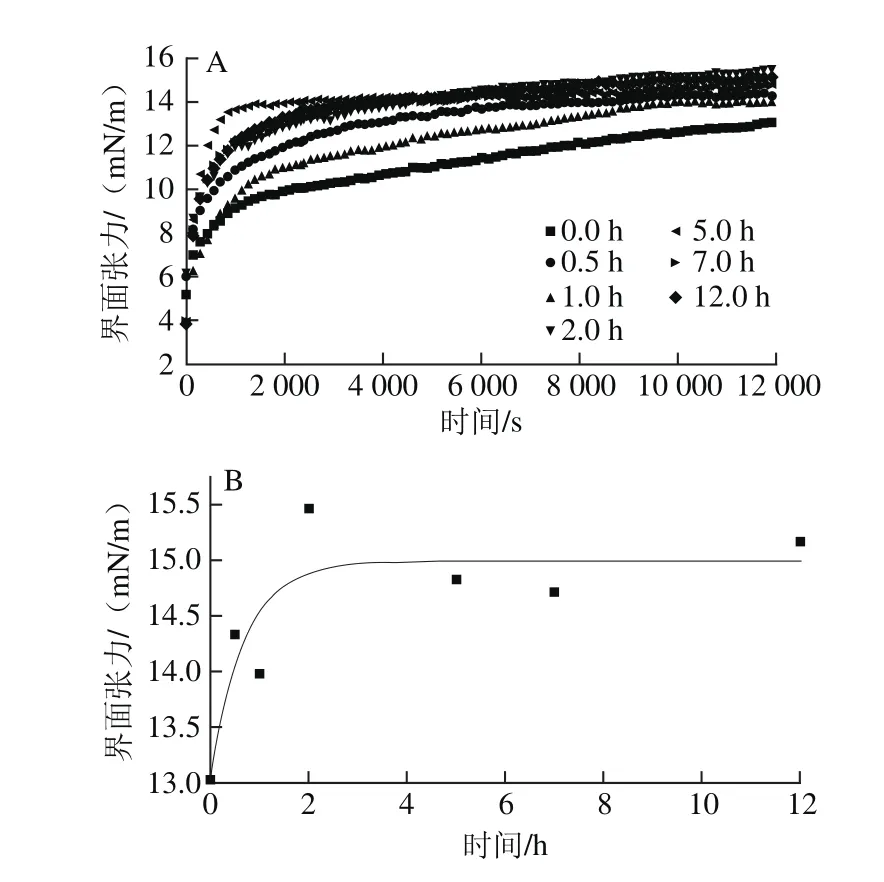
图3 纤维化过程中β-乳球蛋白在油水界面的吸附动力学过程(A)及其饱和界面张力(B)的变化Fig. 3 Changes in adsorption kinetics (A) and saturated surface pressures (B) of β-lactoglobulin dispersions during fibrillation
乳液的形成及稳定性决定于界面物质的吸附行为和界面膜的黏弹模量[28-32]。采用悬滴法对β-乳球蛋白纤维化转变过程中不同阶段产物的界面吸附动力学过程和界面膜的黏弹模量进行研究。图3A为各阶段产物在油-水界面的界面张力随时间的变化。可以观察到,所有样品的界面张力随吸附时间逐渐上升,意味着不同阶段产物均具有界面吸附行为。一段时间后界面张力上升速度趋于平缓,表明物质在界面上的吸附逐渐达到饱和。从图3B可以发现,纤维化转变不同阶段的产物,其平衡界面张力存在区别。在开始阶段,饱和界面张力随蛋白加热时间的延长而升高,当加热时间超过2 h后,饱和界面张力的变化不再明显。综合上述分析可以看出,在热处理的初始阶段,蛋白质发生了水解,这一现象使得蛋白质分子质量变小,而扩散速度增加,因而相对未水解的蛋白能达到更高的饱和界面张力。尽管过度水解会导致蛋白质界面活性的破坏,但后期随着纳米纤维的形成,混合体系的整体界面活性仍然能保持较高水平。
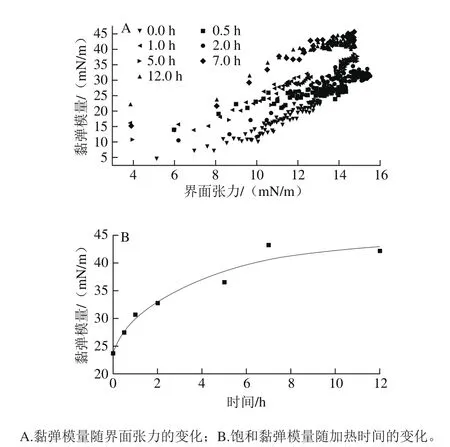
图4 纤维化过程中β-乳球蛋白在油/水界面的扩张流变学特性Fig. 4 Changes in interfacial dilatational rheological properties of dispersions during fibrillation
如图4A所示,随着蛋白不断吸附到油-水界面上(界面张力的增加),样品的黏弹模量也不断增加,说明不同纤维化阶段的产物在油/水界面存在明显相互作用,使得界面层具有较强的黏弹性。同时随着纤维化转变的进行(加热时间的延长),其界面黏弹模量逐渐升高,说明纤维化转变有利于界面吸附层的黏弹性的提高。如图4B所示,随着纤维化转变的进行,其饱和模量不断升高,但在不同阶段,其变化幅度不同。即在纤维化的初始阶段上升较快,而后期则上升不明显,这表示纤维化转变的完成,体系中纤维的数量增加不再明显,体系的界面黏弹模量的变化趋于平缓。蛋白质纳米纤维属于形状各向异性材料,其在油/水界面上的相互作用不同于一般的球形颗粒或柔性高分子,具有更强的相互作用,因而能产生更高的界面黏弹性[33-37]。食品油/水界面或气/水界面的稳定依赖于界面膜的强度,即黏弹模量[38]。目前食品行业大多数采用的吐温、蔗糖酯等小分子表面活性剂所形成的界面膜通常较弱,在食品储藏过程中容易使界面失稳,从而导致食品结构的破坏(如奶油的乳析、植脂末的渗油等)。蛋白质纤维聚集体所表现出的高界面强度则有助于上述问题的解决。
2.4 纤维化过程对β-乳球蛋白乳化性的影响
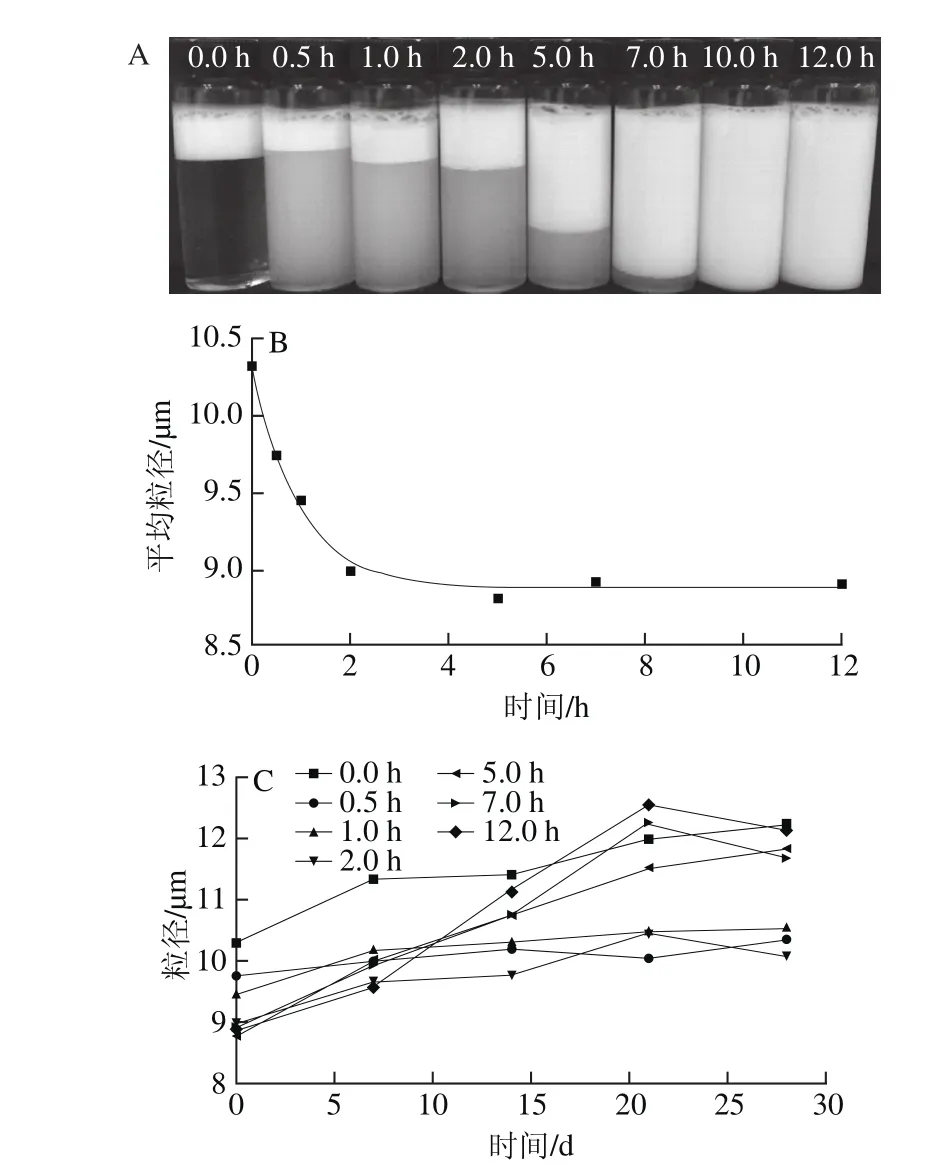
图5 纤维化转变过程中β-乳球蛋白纳米纤维稳定的乳液外观(A)、平均粒径(B)和常温贮藏时粒径(C)的变化Fig. 5 Appearance (A), average droplet size (B) and storage stability (C)of emulsions stabilized by β-lactoglobulin dispersions during fibrillation
从图5A可以看出,纤维化的各个阶段的产物均能形成较为稳定的油/水乳液,并且随着纤维化程度提高,乳液中乳化层的厚度增加,意味着纤维化产物的乳化能力的提高。通过乳液的平均粒径(图5B)可以看出,乳液的粒径随着纤维化程度的提高而逐渐减小,直至纤维化转变2 h后,其产物形成的乳液粒径趋于稳定,说明其乳化能力的变化不再明显,与图5A图现象一致。如图5C所示,随着储藏时间的延长,乳液的粒径均有所上升,这是由于乳液在储藏过程中乳滴之间发生了一定程度的絮凝或聚集。絮凝主要由于乳滴之间的静电排斥力所致,而聚集则由于乳滴表面的界面强度不足所致。比较不同样品在30 d储藏过程中的粒径变化发现,未转化的蛋白乳液平均粒径增加了1.907 μm,而纤维化0.5~12 h的蛋白,其乳液的平均粒径分别增加了0.63 μm(0.5 h),1.08 μm(1 h),1.09 μm(2 h),3.00 μm(5 h),2.80 μm(7 h)和3.20 μm(12 h)。由此可见,纤维化0.5 h的乳液相对最为稳定,未经纤维化转变或过长时间的纤维化转变均不利于乳液的稳定性。纤维化转变后,柔性蛋白分子转变为具有一定刚性的纤维聚集体,该聚集体相对于蛋白分子具有更高的界面吸附能,从而提高了乳液的稳定性。而长时间的纤维化所导致的乳液稳定性下降,可能由于连续相中的纤维产生的耗散性絮凝所导致[17]。在实际应用中,乳化能力和乳化稳定性需要同时考虑。较高的乳化能力有助于形成粒径较小的乳滴,而乳化稳定性有助于乳液保持长期的稳定性。综合比较,纤维化2 h的蛋白质较适宜于在食品乳化中的应用。
3 结 论
本实验对β-乳球蛋白在纤维化转变不同阶段的产物进行了表征,并对其界面及乳化行为进行了分析研究。在纤维化转变初期,蛋白质发生水解,2 h后开始形成少量纤维。随时间延长纤维数量则开始增加,直径变粗。通过对界面吸附行为和界面流变性分析可知,β-乳球蛋白的纤维化转变可有效提高其界面活性,且增强了界面上蛋白分子间的相互作用。通过乳化实验,发现随着纤维化转变过程的延长,其产物的乳化能力逐渐提高,但乳化稳定性在开始阶段有所提高,后期逐渐下降。综合比较,纤维化2 h的产物最适宜用于食品的乳化。
[1] KONTOPIDIS G, HOLT C, SAWYER L. Invited review: betalactoglobulin: binding properties, structure, and function[J]. Journal of Dairy Science, 2004, 87(4): 785-796. DOI:10.3168/jds.S0022-0302(04)73222-1.
[2] MEZZENGA R, BOLISETTY S, HARNAU L, et al. Gelation, phase behavior and dynamics of beta-lactoglobulin amyloid fibrils at varying concentrations and ionic strengths[J]. Biomacromolecules, 2012,13(10): 3241-3252. DOI:10.1021/bm301005w.
[3] PAPIZ M Z, SAWYER L, ELIOPOULOS E E, et al. The structure of beta-lactoglobulin and its similarity to plasma retinol-binding protein[J]. Nature, 1986, 324: 383-385. DOI:10.1038/324383a0.
[4] DICKINSON E, YAMAMOTO Y. Effect of lecithin on the viscoelastic properties of β-lactoglobulin-stabilized emulsion gels[J].Food Hydrocolloids, 1996, 10(3): 301-307. DOI:10.1016/S0268-005X(96)80005-1.
[5] UVERSKY V N, LI J, FINK A L. Evidence for a partially folded intermediate in alpha-synuclein fibril formation[J]. Journal of Biological Chemistry, 2001, 276(14): 10737-10744. DOI:10.1074/jbc.M010907200.
[6] ROBERTS C J. Non-native protein aggregation kinetics[J].Biotechnology and Bioengineering, 2007, 98(5): 927-938.DOI:10.1002/bit.21627.
[7] ADAMCIK J, JUNG J M, FLAKOWSKI J, et al. Understanding amyloid aggregation by statistical analysis of atomic force microscopy images[J]. Nature Nanotechnology, 2010, 5(6): 423-428. DOI:10.1038/nnano.2010.59.
[8] BOLISETTY S, BODDUPALLI C S, HANDSCHIN S, et al. Amyloid fibrils enhance transport of metal nanoparticles in living cells and induced cytotoxicity[J]. Biomacromolecules, 2014, 15(7): 2793-2799.DOI:10.1021/bm500647n.
[9] ISA L, JUNG J M, MEZZENGA R. Unravelling adsorption and alignment of amyloid fibrils at interfaces by probe particle tracking[J].Soft Matter, 2011, 7(18): 8127-8134. DOI:10.1039/C1SM05602F.
[10] BURKE K A, YATES E A, LEGLEITER J. Amyloid-forming proteins alter the local mechanical properties of lipid membranes[J].Biochemistry, 2013, 52(5): 808-817. DOI:10.1021/bi301070v.
[11] TA H P, BERTHELOT K, COULARYSALIN B, et al. Comparative studies of nontoxic and toxic amyloids interacting with membrane models at the air-water interface[J]. Langmuir the ACS Journal of Surfaces & Colloids, 2011, 27(8): 4797-4807. DOI:10.1021/la103788r.
[12] LINDEN E V D, VENEMA P. Self-assembly and aggregation of proteins[J]. Current Opinion in Colloid & Interface Science, 2007,12(4/5): 158-165. DOI:10.1016/j.cocis.2007.07.010.
[13] LINDEN E V D. From peptides and proteins to micro-structure mechanics and rheological properties of fibril systems[J].Food Hydrocolloids, 2012, 26(2): 421-426. DOI:10.1016/j.foodhyd.2010.11.019.
[14] JUNG J M, GUNES D Z, MEZZENGA R. Interfacial activity and interfacial shear rheology of native β-lactoglobulin monomers and their heat-induced fibers[J]. Langmuir the ACS Journal of Surfaces &Colloids, 2010, 26(19): 15366-15375. DOI:10.1021/la102721m.
[15] JORDENS S, RÜHS P A, SIEBER C, et al. Bridging the gap between the nanostructural organization and macroscopic interfacial rheology of amyloid fibrils at liquid interfaces[J]. Langmuir, 2014, 30(33):10090-10097. DOI:10.1021/la5020658.
[16] RÜHS P A, SCHEUBLE N, WINDHAB E J, et al. Simultaneous control of pH and ionic strength during interfacial rheology of β-lactoglobulin fibrils adsorbed at liquid/liquid Interfaces[J]. Langmuir the ACS Journal of Surfaces & Colloids, 2012, 28(34): 12536-12543.DOI:10.1021/la3026705.
[17] GAO Z M, ZHAO J J, HUANG Y, et al. Edible Pickering emulsion stabilized by protein fibrils. Part 1: effects of pH and fibrils concentration[J]. LWT-Food Science and Technology, 2016, 76: 1-8.DOI:10.1016/j.lwt.2016.10.038.
[18] LOVEDAY S M, SU J, RAO M A, et al. Effect of calcium on the morphology and functionality of whey protein nanofibrils[J].Biomacromolecules, 2011, 12(10): 3780-3788. DOI:10.1021/bm201013b.
[19] HUMBLET-HUA K N P, SCHELTENS G, LINDEN E V D, et al.Encapsulation systems based on ovalbumin fibrils and high methoxyl pectin[J]. Food Hydrocolloids, 2011, 25(3): 307-314. DOI:10.1016/j.foodhyd.2010.06.008.
[20] GAONKAR A G. Interfacial tensions of vegetable oil/water systems:effect of oil purification[J]. Journal of the American Oil Chemists’Society, 1989, 66(8): 1090-1092. DOI:10.1007/BF02670090.
[21] LEVINE H. Thioflavine T interaction with amyloid β-sheet structures[J]. Amyloid-journal of Protein Folding Disorders, 1995,2(1): 1-6. DOI:10.3109/13506129509031881.
[22] MAZAHERI M, MOOSAVI-MOVAHEDI A A, SABOURY A A,et al. Curcumin protects β-lactoglobulin fibril formation and fibrilinduced neurotoxicity in PC12Cells[J]. PLoS ONE, 2015, 10(7).DOI:10.1371/journal.pone.0133206.
[23] KREBS M R, BROMLEY E H, DONALD A M. The binding of thioflavin-T to amyloid fibrils: localisation and implications[J].Journal of Structural Biology, 2005, 149(1): 30-37. DOI:10.1016/j.jsb.2004.08.002.
[24] CHENG B, LIU X R, GONG H, et al. Coffee components inhibit amyloid formation of human islet amyloid polypeptide in vitro:possible link between coffee consumption and diabetes mellitus[J].Journal of Agricultural & Food Chemistry, 2011, 59(24): 13147-13155. DOI:10.1021/jf201702h.
[25] LARA C, ADAMCIK J, JORDENS S, et al. General self-assembly mechanism converting hydrolyzed globular proteins into giant multistranded amyloid ribbons[J]. Biomacromolecules, 2011, 12(5):1868-1875. DOI:10.1021/bm200216u.
[26] AKKERMANS C, VENEMA P, GOOT A J V D, et al. Peptides are building blocks of heat-induced fibrillar protein aggregates of betalactoglobulin formed at pH 2[J]. Biomacromolecules, 2008, 9(5):1474-1479. DOI:10.1021/bm7014224.
[27] JONES O G, MEZZENGA R. Inhibiting, promoting, and preserving stability of functional protein fibrils[J]. Soft Matter, 2012, 8(8): 876-895. DOI:10.1039/C1SM06643A.
[28] MURRAY B S, DICKINSON E. Interfacial rheology and the dynamic properties of adsorbed films of food proteins and surfactants[J]. Food Science & Technology International Tokyo, 1996, 2(3): 131-145.DOI:10.3136/fsti9596t9798.2.131.
[29] WILLIAMS A, PRINS A. Comparison of the dilational behaviour of adsorbed milk proteins at the air-water and oil-water interfaces[J].Colloids & Surfaces A: Physicochemical & Engineering Aspects,1996, 114(16): 267-275. DOI:10.1016/0927-7757(96)03534-0.
[30] NICOLAI T, BRITTEN M, SCHMITT C. β-Lactoglobulin and WPI aggregates: formation, structure and applications[J].Food Hydrocolloids, 2011, 25(8): 1945-1962. DOI:10.1016/j.foodhyd.2011.02.006.
[31] MURRAY B S. Rheological properties of protein films[J]. Current Opinion in Colloid & Interface Science, 2011, 16(1): 27-35.DOI:10.1016/j.cocis.2010.06.005.
[32] HALLING P J. Protein-stabilized foams and emulsions[J]. Critical Reviews in Food Science and Nutrition, 1981, 15(2): 155-203.DOI:10.1080/10408398109527315.
[33] MAHMOUDI N, AXELOS M A V, RIAUBLANC A. Interfacial properties of fractal and spherical whey protein aggregates[J]. Soft Matter, 2011, 7(7): 7643-7654. DOI:10.1039/c1sm05262d.
[34] KIM D A, CORNEC M, NARSIMHAN G. Effect of thermal treatment on interfacial properties of β-lactoglobulin[J]. Journal of Colloid & Interface Science, 2005, 285(1): 100-109. DOI:10.1016/j.jcis.2004.10.044.
[35] WIJESINHABETTONI R, GAO C, JENKINS J A, et al. Heat treatment of bovine alpha-lactalbumin results in partially folded,disulfide bond shuffled states with enhanced surface activity[J].Biochemistry, 2007, 46(34): 9774-9784. DOI:10.1021/bi700897n.
[36] DICKINSON E. Adsorbed protein layers at fluid interfaces: interactions,structure and surface rheology[J]. Colloids & Surfaces B: Biointerfaces,1999, 15(2): 161-176. DOI:10.1016/S0927-7765(99)00042-9.
[37] RÜHS P A, AFFOLTER C, WINDHAB E J, et al. Shear and dilatational linear and nonlinear subphase controlled interfacial rheology of β-lactoglobulin fibrils and their derivatives[J]. Journal of Rheology, 2013, 57(3): 1003-1022. DOI:10.1122/1.4802051.
[38] ERIC D. Hydrocolloids as emulsifiers and emulsion stabilizers[J].Food Hydrocolloids, 2009, 23(6): 1473-1482. DOI:10.1016/j.foodhyd.2008.08.005.
