不同浓度理中汤多糖作为碳源对肠道拟杆菌及厚壁菌体外生长的影响
2018-03-20伍荷洁张丽萍舒青龙
伍荷洁,张丽萍,舒青龙
(江西中医药大学基础医学院,南昌330004)
人类胃肠道栖息着1 000~1 150种细菌[1]。中药复方通过对肠道菌群进行调节,加强益气健脾之力,恢复宿主的微生态平衡从而治疗肠道菌群失衡导致的各类疾病,效果良好[2]。中药复方成分复杂,何种成分及其作用于肠道菌群的药理机制尚不明确。植物类中药中,多糖是一类重要的有效成分。文献已报道中药多糖具有多种生物活性[3]。中药提取物中含有的多糖类物质如N-乙酰葡萄糖胺多聚物对肠道菌群有促进作用[4]。但在人类饮食中,许多复杂的植物多糖由于不溶性或人类编码水解酶缺乏导致抗降解[5~7]。拟杆菌和厚壁菌是肠道丰度最大且在肠道微生态响应中最为重要的菌群之一,为中药基于微生态起效应的主要靶点,尤其是拟杆菌。而且,拟杆菌在多糖底物利用中的作用也尤为突出[8]。本研究选用治疗脾胃虚寒的经典基础方理中汤及降解多糖最有特色的两株拟杆菌(多形拟杆菌、脆弱拟杆菌)进行实验;同时,为体现拟杆菌和厚壁菌利用碳源的差异性,我们还选用了两株临床分离的厚壁菌进行培养。本研究观察了不同浓度理中汤多糖作为碳源对肠道拟杆菌及厚壁菌体外生长的影响,进一步探讨理中汤调节肠道菌群的作用机制,为理中汤的临床应用提供微生态学依据。
1 材料与方法
1.1 药物、菌株与主要实验材料药物 理中汤(党参6 g、干姜9 g、炙甘草6 g、白术12 g)购于江西中医药大学附属医院。菌株:多形拟杆菌(ATCC29148)、脆弱拟杆菌(ATCC25285)、梭菌(C6)、艰难梭菌(SH186);所收集的菌液进行DNA提取,扩增16S rRNA并到NCBI数据库上进行比对,确定为目的菌株。脑心浸液肉汤(BHI)固体培养基、BHI液体培养基(Oxoid公司),NaCl、(NH4)2SO4、L-半胱氨酸、琼脂(上海生物工程有限公司),La Taq酶(Takara公司),EB替代染料(北京普利莱基因技术有限公司),细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)。厌氧工作站(MarkⅡ,荷兰Mark公司),显微镜(Leica DM2500,德国徕卡仪器有限公司),超净工作台(SW-CJ-2D,苏州净化设备有限公司),紫外可见分光光度计(UV-2012C,苏州江东精密仪器有限公司),生化培养箱(SPX-150B-Z,上海光都仪器设备有限公司),台式高速离心机(H1650,湖南湘仪实验室仪器开发有限公司),pH计(pH400,上海安莱立思仪器科技有限公司)。
1.2 理中汤多糖的提取 采用水提醇沉法提取理中汤总多糖,用sevag试剂去除粗多糖中的蛋白质,然后用大孔阴离子交换树脂去除色素得到后续实验中需要的理中汤多糖(多糖含量94.2%,蛋白含量0.65%)。
1.3 菌株分组及理中汤多糖的用法 将两株典型肠道拟杆菌(多形拟杆菌和脆弱拟杆菌)及两株厚壁菌(梭菌和艰难梭菌)分别分为多糖组、葡萄糖组、BHI组培养。多糖组中多形拟杆菌分别以含1%、5%、10%、20%、30%、40%的理中汤多糖培养基培养,脆弱拟杆菌分别以含1%、5%、10%、20%、30%、40%、50%、60%的理中汤多糖培养基培养;葡萄糖组以含葡萄糖的培养基培养;BHI组以含BHI的培养基培养。每组做3个生物学重复。将各组摇瓶放入厌氧罐中,充入无氧混合气(80%N2、10%H2、10%CO2),厌氧罐放入恒温箱37℃培养。
1.4 细菌生长观察 拟杆菌分别于培养8、14、20、26、32、38、44、50、56 h,厚壁菌分别于培养8、14、20、26、32、38 h取各组菌液1 mL,于12000 r/min离心3 min,去上清,用双蒸水重悬,再用分光光度计在波长为600 nm处测定OD值。
1.5 细菌含量测定 将细菌放在BHI液体培养基中培养至稳定期后取菌悬液1 mL并测定其OD值,将其等梯度稀释10-7~10-9后,取稀释后各梯度的菌悬液0.1 mL涂布至BHI固体培养基,每梯度做3个生物学重复,厌氧处理后置于恒温箱37 ℃培养,对生成的菌落进行计数,取其平均值,根据公式:细菌数量=菌落计数平均值×稀释倍数,换算成不同OD值所对应的细菌数量。
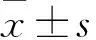
2 结果
2.1 各组多形拟杆菌浓度比较 ①不同浓度的理中汤多糖培养下的比较。按多形拟杆菌体外生长达到峰值的生长时间比较:40%、30%、20%、10%、5%、1%浓度理中汤多糖组的多形拟杆菌分别在培养44、44、32、38、44、44 h时浓度达峰值。按多形拟杆菌体外生长最大值进行排序依次为:30%、40%、20%、10%、5%、1%理中汤多糖组。②理中汤多糖和BHI碳源培养下的比较。按多形拟杆菌体外生长达到峰值的生长时间比较:BHI组的多形拟杆菌在培养26 h时浓度达峰值,较理中汤多糖组达峰值的时间更短;按多形拟杆菌体外生长最大值比较:20%和30%浓度多糖组细菌生长至32h后浓度均高于BHI组。③理中汤多糖和葡萄糖碳源培养下的比较。按多形拟杆菌体外生长达到峰值的生长时间比较:葡萄糖组的多形拟杆菌在培养56 h时浓度达峰值,较所有理中汤多糖组达峰值的时间更长;按多形拟杆菌体外生长最大值比较:5%及以上浓度的多糖组细菌生长至14 h后浓度均高于葡萄糖组。④BHI碳源和葡萄碳源培养下的比较:按多形拟杆菌体外生长达到峰值的生长时间比较。BHI组的多形拟杆菌较葡萄糖组达峰值的时间更短;按多形拟杆菌体外生长最大值比较:不同培养时间BHI组多形拟杆菌浓度均高于葡萄糖组。以上结果表明:三种不同碳源(理中汤多糖、BHI碳源、葡萄糖)培养基对于多形拟杆菌体外生长的影响存在明显的差异,从多形拟杆菌体外生长达到峰值的生长时间上看,BHI组为最短,与BHI作为厌氧细菌实验最常用的碳源的情况相符;但从按多形拟杆菌体外生长最大值上看,20%和30%浓度理中汤多糖组则高于BHI组;5%及以上浓度的多糖组细菌生长至14 h后浓度均高于葡萄糖组;同时,不同浓度的理中汤多糖的实验表示:当多糖浓度为1%至20%时,多形拟杆菌的生长随多糖浓度上升而增加,但高浓度多糖中30%浓度组稍优于40%浓度组。以上提示:理中汤多糖是一种适合多形拟杆菌生长的优势碳源,对于多形拟杆菌体外生长的最优浓度为30%(P均<0.05)。
2.2 各组脆弱拟杆菌浓度比较 ①不同浓度的理中汤多糖培养下的比较。按脆弱拟杆菌体外生长达到峰值的生长时间比较:60%、50%、40%、30%、20%、10%、5%、1%浓度理中汤多糖组的脆弱拟杆菌分别在培养38、38、56、26、26、56、44、44 h时浓度达峰值。按脆弱拟杆菌体外生长最大值进行排序依次为:50%、30%、40%、20%、60%、10%、5%、1%理中汤多糖组。②理中汤多糖和BHI碳源培养下的比较。按脆弱拟杆菌体外生长达到峰值的生长时间比较:BHI组的脆弱拟杆菌在培养20h时浓度达峰值,较理中汤多糖组达峰值的时间更短;按多形拟杆菌体外生长最大值比较:30%和50%浓度多糖组细菌生长至26 h后浓度高于BHI组,40%浓度多糖组细菌生长至38 h后浓度高于BHI组。③理中汤多糖和葡萄糖碳源培养下的比较。按脆弱拟杆菌体外生长达到峰值的生长时间比较:葡萄糖组的多形拟杆菌在培养56 h时浓度达峰值;较10%和40%的理中汤多糖组达峰值的时间更短,较20%、30%、50%、60%理中汤多糖组达峰值的时间更长;按脆弱拟杆菌体外生长最大值比较:不同培养时间20%、30%、40%、50%多糖组脆弱拟杆菌浓度均高于葡萄糖组。④BHI碳源和葡萄碳源培养下的比较。按脆弱拟杆菌体外生长达到峰值的生长时间比较:BHI组的脆弱拟杆菌较葡萄糖组达峰值的时间更短;按脆弱拟杆菌体外生长最大值比较:不同培养时间BHI组脆弱拟杆菌浓度均高于葡萄糖组。以上结果表明:三种不同碳源(理中汤多糖、BHI碳源、葡萄糖)培养基对于脆弱拟杆菌体外生长的影响存在明显的差异,从脆弱拟杆菌体外生长达到峰值的生长时间上看,BHI组为最短,与BHI作为厌氧细菌实验最常用的碳源的情况相符;但从按脆弱拟杆菌体外生长最大值上看,30%和50%浓度多糖组细菌生长至26 h后浓度高于BHI组,40%浓度多糖组细菌生长至38 h后浓度高于BHI组。不同培养时间20%、30%、40%、50%多糖组脆弱拟杆菌浓度均高于葡萄糖组;同时,不同浓度的理中汤多糖的实验表示:当多糖浓度为1%至10%时,脆弱拟杆菌的生长随多糖浓度上升而增加,但高浓度多糖中脆弱拟杆菌的生长并不随多糖浓度的增加呈正态分布。以上提示:理中汤多糖是一种适合拟杆菌生长的优势碳源,对于脆弱拟杆菌体外生长的最优浓度为50%(P均<0.05)。
2.3 各组梭菌浓度比较 各组梭菌均于培养8h开始生长。BHI组的梭菌在培养20 h浓度达峰值;葡萄糖组的梭菌在培养38h浓度达峰值;40%、30%、20%、10%、5%、1%浓度多糖组的梭菌分别在培养38、38、32、20、32、38 h浓度达峰值。不同培养时间BHI组梭菌浓度均高于葡萄糖组和多糖组(P均<0.05)。
2.4 各组艰难梭菌浓度比较 BHI组的艰难梭菌在培养16 h浓度达峰值,为(20.010±1.016)×1010CFU/mL,葡萄糖组和多糖组的艰难梭菌未见生长。
3 讨论
中医传承的整体观念与微生态平衡理论不谋而合。肠道菌群对维持机体健康至关重要,与多种疾病密切相关。何种成分在中药微生态机制中起主要作用,这是中医药微生态研究的重要课题之一。多糖作为中药中重要的有效成分,其药理作用不断被发掘。研究[9]证明黄芪、白术、防风按一定比例提取的复合多糖能提高免疫功能低下小鼠的脾指数。但以多糖为靶点研究中药复方对肠道菌群的作用机制并不多见,是中医药微生态研究的一个新方向。
理中汤运用于各科疾病的治疗疗效显著,相关基础研究也取得了很大进展。成云水等[10]发现理中汤治疗小儿高热效果明显。王晓英等[11]证明加味附子理中汤配合针灸治疗早搏疗效显著。王宇飞等[12]证明加味理中汤联合穴位注射治疗反流性食管炎疗效较好。同时,理中汤对慢性结肠炎和功能性消化不良也有较好疗效[13,14]。也有研究[15]发现理中汤可调节D-IBS大鼠胃肠转运功能和血清及小肠的SP、CCK水平,影响抗生素相关性腹泻模型中的肠道菌群分布等。然而目前从碳源角度解释理中汤调节肠道菌群机制的研究仍旧缺失。
鉴于不同菌群利用多糖能力的差异,在菌种选择上,本研究选用的是在正常人体肠道中分布超过90%的细菌:拟杆菌和厚壁菌。尤其是拟杆菌,对环境应变能力敏感,其基因组编码大量糖基水解酶、糖代谢过程相关酶,可帮助宿主有效利用多糖[16]。因此,我们选用了降解多糖最有特色的两株拟杆菌,即多形拟杆菌和脆弱拟杆菌。同时,为体现不同菌株利用碳源的差异性,我们还选用了两株厚壁菌进行培养。我们提取了高浓度、低蛋白的理中汤多糖,以不同浓度的理中汤多糖加入到基本培养基中作为惟一碳源,厌氧处理后对两株拟杆菌及两株厚壁菌进行恒温培养,观察理中汤多糖对拟杆菌和厚壁菌体外生长的影响。
本研究结果显示,对于两株拟杆菌,多糖组细菌浓度高于BHI组,BHI组高于葡萄糖组,其中30%浓度多糖组的多形拟杆菌浓度最高,50%浓度多糖组的脆弱拟杆菌浓度最高。这表明理中汤可以基于多糖成份影响拟杆菌的体外生长,且影响程度和多糖含量有关,细菌浓度并不随着多糖浓度增加而增加;而且,一定浓度的理中汤多糖较其他碳源更能影响拟杆菌体外生长。对两组厚壁菌生长情况进行观察发现,BHI组的梭菌浓度高于多糖组和葡萄糖组;仅BHI组的艰难梭菌有生长,而葡萄糖组和多糖组的艰难梭菌未见生长。上述结果提示不同浓度的理中汤多糖均能影响典型拟杆菌的体外生长,相对于BHI和葡萄糖碳源的影响,理中汤多糖是一种适合拟杆菌生长的优势碳源,对于多形拟杆菌和脆弱拟杆菌体外生长的最优浓度分别为30%和50%;但理中汤多糖对厚壁菌的生长促进作用不明显,甚至有抑制作用。我们认为,中药复方理中汤多糖作为碳源可促进典型肠道拟杆菌的增长,这种碳源机制使得肠道拟杆菌在理中汤多糖成分的影响下具有竞争优势,从而调节肠道菌群结构。同时,本实验中不同浓度理中汤多糖对拟杆菌生长影响的差异性可为临床用药剂量和用药周期提供参考。
