外源粪菌干预对受体猪肠道屏障功能的影响研究
2018-03-20耿世杰程赛赛胡栾莎岳晓敬韩新燕
耿世杰,李 媛,程赛赛,胡栾莎,岳晓敬,韩新燕
(浙江大学动物科学学院,农业部华东动物营养与饲料重点实验室,浙江杭州 310058)
在动物肠道健康领域,肠道内的微生物群落由于能发挥各种重要功能,已引起越来越多研究者的广泛关注。大量研究表明,肠道菌群不仅参与肠道内多项代谢进程,还在机体肠屏障功能的构建和黏膜免疫系统的成熟方面发挥重要作用[1]。外源粪菌干预是一种直接将健康外源供体的粪便菌群移植到受体胃肠道内进而重塑消化道菌群结构,促进肠道健康的微生态调节途径[2]。在医学上,通过粪菌移植(Fecal Microbiota Transplantation,FMT)的方式进行外源粪菌干预可以有效治疗一些难治性胃肠疾病,例如艰难梭菌感染和炎症性肠病[3],而且已有研究表明外源粪菌还能发挥调节受体黏膜免疫应答和肠道生理功能的作用[4]。在动物生产上,有关粪菌移植能否通过提升肠屏障功能促进动物肠道健康的研究鲜有报道。
哺乳仔猪的消化道结构尚未发育完善、肠黏膜屏障尚不健全,其作为粪菌移植受体有利于观察与分析外源粪菌干预对肠道功能的调节作用。金华猪是我国著名的地方猪种,除肉质好、繁殖率高外,在面对应激时还具有更强的抗逆性和维持肠道功能稳态的能力[5]。本研究选用健康成年金华猪作为粪菌移植供体,通过对杜×长×大三元杂交哺乳仔猪进行粪菌移植,探究外源粪菌干预对受体猪肠道屏障功能的影响,进而为粪菌移植技术在动物生产领域的应用提供理论依据。
1 材料与方法
1.1 试验材料 选取未使用药物或药物性饲料添加剂3个月以上、无消化紊乱症状的80 kg左右健康金华猪作为粪菌移植供体,采集新鲜粪样并参考Pang等[6]方法制备粪菌悬液。Trizol试剂盒、反转录试剂盒等均购自Invitrogen公司。荧光定量试剂盒购自Applied Biosystems公司。组织总蛋白提取试剂盒及蛋白质免疫印迹(Western Blot,WB)一抗购自Santa Cruz Biotechnology,二抗购自Thermo Pierce公司。二喹啉甲酸(Bicinchoninic Acid,BCA)法蛋白浓度测定试剂盒购自碧云天生物公司。分泌型免疫球蛋白A阳性(SIgA+)细胞免疫组织化学分析一抗购自Bethyl Laboratories,二抗购自DAKO公司。
1.2 试验动物与设计 试验选用初生重相近、胎次相同、同日出生的杜×长×大三元杂交哺乳仔猪12窝,随机分为2组,每组6个重复(窝),每个重复(窝)10~12头仔猪。试验组1~10日龄隔天灌喂1 mL金华猪粪菌悬液进行外源粪菌干预;对照组灌喂等量无菌0.1 mol/L无菌磷酸盐缓冲液(PBS,pH=7.2,含10%甘油)。试验期至仔猪27日龄(断奶前1 d),从10日龄开始对所有仔猪补充相同教槽料进行诱食,试验期间仔猪自由哺乳进食和饮水。
1.3 样品采集与指标测定
1.3.1 样品采集 分别于12日龄和27日龄每组随机选取6头仔猪,肌肉注射4%戊巴比妥钠溶液(40 mg/kg BW)进行麻醉,待麻醉完全后屠宰取样。屠宰前将仔猪置于保温箱内过夜禁食12 h,宰前称重。肠道黏膜样品的收集与保存:截取回肠和结肠中部约10 cm,纵向剖开,在生理盐水中将内容物洗净;用玻璃棒快速刮取肠道黏膜样品,保存于-80℃冰箱中待测。肠道镜检样品的收集与保存:纵向剖开十二指肠、空肠和回肠,于相同位置分别取长度约1 cm的肠段,在生理盐水中轻轻漂洗去除肠壁附着内容物,随后使肠腔面朝上平铺在滤纸上将液体吸干,浸入10%甲醛固定液并置于4℃冰箱中保存用于制作石蜡切片。
1.3.2 生长性能和腹泻率测定 在12日龄和27日龄时,试验仔猪绝食12 h,自由饮水,以重复为单位对试验仔猪进行空腹称重,计算试验期间平均日增重(ADG)。
仔猪腹泻率=腹泻仔猪数×腹泻时间/(仔猪总数×27)×100%
1.3.3 肠道光镜切片的制作与显微测量 固定液中组织块修整为适当大小,流水冲洗24 h。冲洗好的组织置于Leica TP1020脱水机脱水、透明与浸蜡,使用Leica EG1160组织包埋仪包埋。使用Leica RM2135旋转切片机将组织块切为厚度6 μm的切片,随后将切片置于Leica HI1210烤片机上烤片。将烤好的载玻片置于Leica Autostain BRXL染色机中进行苏木精-伊红(Hematoxylin-eosin,HE)染色,随后使用二甲苯透明,树胶加盖玻片封片。使用Leica专用万能显微镜数码拍照,光镜下使用Leica Qwin软件进行定量分析,每个样品观察6个非连续性4 μm纵切片,每张纵切片测定10个绒毛高度和隐窝深度。
1.3.4 肠黏膜杯状细胞数测定 ①石蜡切片脱蜡至水。②0.5%高碘酸水溶液氧化10~15 min。③流水冲洗数分钟,蒸馏水换洗2次。④雪夫试剂暗处浸染30~40 min。⑤流水冲洗10 min。⑥苏木素复染核30 ~60 s,1%盐酸水溶液分化3 s,氨水返蓝。⑦无水乙醇脱水(两缸各5 min)。⑧正丁醇处理30 s。⑨二甲苯透明(两缸各5 min),中性树胶封片。⑩糖原高碘酸-雪夫(Periodic Acid-schiff,PAS)染色后在光镜下观察,红色糖原染色细胞即为杯状细胞,高倍镜下随机选择6个视野统计杯状细胞数量进行比较。
1.3.5 黏蛋白基因Muc2mRNA相对表达量测定 根据GenBank已报道的猪Muc2和GAPDH基因序列,使用Primer Premier 6.0软件设计相应特异性引物,引物由生工生物工程(上海)股份有限公司合成(表1)。
取出-80℃保存的回肠和结肠样品50~100 mg,按照Trizol试剂盒说明书(Invitrogen,货号:12183-555)提取总RNA,使用紫外分光光度计检测RNA的质量和浓度,结果显示OD值均在1.8~2.0。反转录按照SuperScript™ III First-Strand Synthesis SuperMix for qRTPCR试剂盒说明书进行操作(反应体积为20 μL)。按照Power SYBR®Green PCR Master Mix荧光定量试剂盒说明书加入相应反应试剂(Applied Biosystems,货号:4367659),反应体积为20 μL,组成为8.0 μL SDW,10 μL Power SYBR® Green Master Mix,0.5 μL 上 游引物(10 μmol/L),0.5 μL 下游引物(10 μmol/L),1 μL cDNA。扩增条件均为95℃预变性30 s,95℃变性 5 s,60℃ 退火 34 s,95℃ 15 s,60℃ 60 s,40个循环之后检测荧光信号。每个样品做3个重复,每个样品目标基因mRNA相对表达量=2-△△Ct。

表1 PCR反应的引物序列
1.3.6 黏蛋白Muc2和紧密连接蛋白ZO-1、Occludin相对表达量测定 使用T-PER Tissue Protein Extraction Reagent总蛋白提取试剂盒(Thermo Pierce,货号:78510)进行组织总蛋白提取,使用BCA定量试剂盒(碧云天,货号:P0010)进行总蛋白定量。配置分离胶和浓缩胶对样品总蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)分析。聚偏二氟乙烯(Polyvinylidene Difluoride,PVDF)膜在甲醇中浸泡后转移至三羟甲基氨基甲烷-甘氨酸(Tris-Glycine)转移缓冲液中平衡,SDS-PAGE凝胶在Tris-Glycine转移缓冲液平衡,随后以恒压全湿转膜。转膜结束后放入吐温-三羟甲基氨基甲烷缓冲盐水缓冲液(Tween-tris Buffered Saline, T-TBS)室温封闭,使用T-TBS漂洗。将一抗(表2)以一定比例溶于T-TBS,4℃孵育过夜,使用T-TBS漂洗。

表2 一抗信息
二抗溶于T-TBS室温放置1 h,使用T-TBS漂洗5次。二抗为Goat anti-Mouse IgG(H+L)Secondary Antibody(Thermo Pierce,货号:31160),Goat anti-Rabbit IgG(H+L)Secondary Antibody(Thermo Pierce,货号:31210),稀释度为 1:5000。使用 SuperSignal®West Dura Extended Duration Substrate,按说明书操作,制备约1 mL增强化学发光(Enhanced Chemiluminescence,ECL)工作液,室温孵育转印膜1 min,然后去除多余ECL试剂,保鲜膜密封,暗盒中放上X-ray film曝光5~10 min后进行显影和定影。采用Image J软件分析条带的光密度值,每个条带重复3次。
目的蛋白相对表达量=(目的蛋白光密度值/内参光密度值)×10n
1.3.7 分泌型免疫球蛋白A阳性(SIgA+)细胞数测定 ①石蜡切片脱蜡至水。②切片置于乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)抗原修复缓冲液(PH=9.0)中进行抗原修复,冷却后置于PBS(PH=7.4)中晃动洗涤。③放入3%过氧化氢溶液避光孵育,随后置于PBS(PH=7.4)中晃动洗涤。④滴加3%牛血清白蛋白(Bovine Serum Albumin,BSA)或者10%正常兔血清覆盖组织,室温封闭30 min。⑤甩掉封闭液,切片滴加一抗(山羊抗猪SIgA抗体),4℃孵育。⑥置于PBS(PH=7.4)中晃动洗涤,稍甩干后滴加二抗(山羊抗兔IgG抗体-HRP多聚体),室温孵育50 min。⑦置于PBS(PH=7.4)中晃动洗涤,稍甩干后滴加二氨基联苯胺(Diaminobenzidine,DAB)显色液,显微镜下控制显色时间,冲洗切片终止显色。⑧Harris苏木素复染3 min左右,1%盐酸酒精分化数秒,氨水返蓝。⑨将切片脱水透明,中性树胶封片。⑩显微镜镜检,图像采集并分析。
1.4 统计分析 数据采用Excel完成整理,使用SPSS 23.0软件对数据进行t检验,P<0.05为差异显著。试验数据均以平均值±标准差表示。
2 结 果
2.1 外源粪菌干预对受体猪生长性能的影响 由表3可知,试验组1~27日龄仔猪的ADG与成活率显著高于对照组(P<0.05),腹泻率显著低于对照组(P<0.05)。

表3 外源粪菌干预对受体猪生长性能的影响
2.2 外源粪菌干预对受体猪肠道形态的影响 由表4可知,试验组12日龄回肠绒毛高度/隐窝深度显著高于对照组(P<0.05),其他肠道形态指标与对照组相比无显著差异(P>0.05)。27日龄时,试验组十二指肠、空肠和回肠隐窝深度均显著低于对照组(P<0.05),空肠和回肠绒毛高度/隐窝深度显著高于对照组(P<0.05),其他肠道形态指标与对照组相比无显著差异(P>0.05)。
2.3 外源粪菌干预对受体猪肠道屏障功能的影响
2.3.1 外源粪菌干预对肠道杯状细胞数和黏蛋白Muc2表达的影响 由图1可知,与对照组相比,试验组回肠和结肠杯状细胞分布面积增加,且含有大量黏蛋白分泌颗粒。由表5可知,试验组12日龄和27日龄回肠与结肠杯状细胞数均显著高于对照组(P<0.05)。
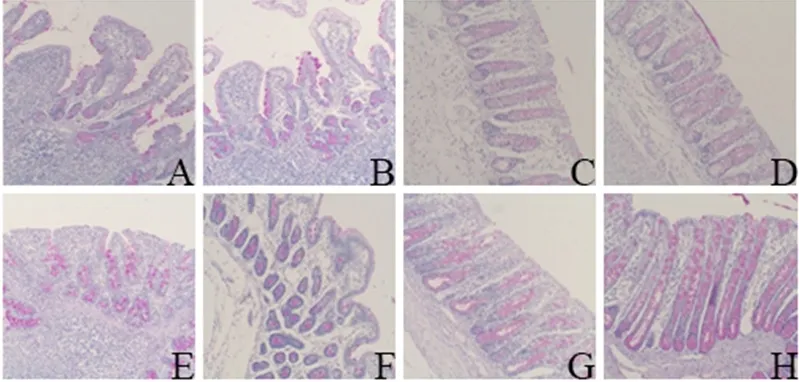
图1 肠道杯状细胞PAS染色图(40×)
外源粪菌干预对肠道黏蛋白基因Muc2的mRNA相对表达量及黏蛋白表达的影响结果见图2、表6和表7。与对照组相比,试验组12日龄回肠和结肠Muc2mRNA相对表达量和黏蛋白表达水平均显著提高(P<0.05);27日龄时,试验组结肠Muc2mRNA相对表达量和黏蛋白表达水平均显著高于对照组(P<0.05),回肠Muc2mRNA相对表达量和黏蛋白表达水平与对照组相比无显著差异(P>0.05)。
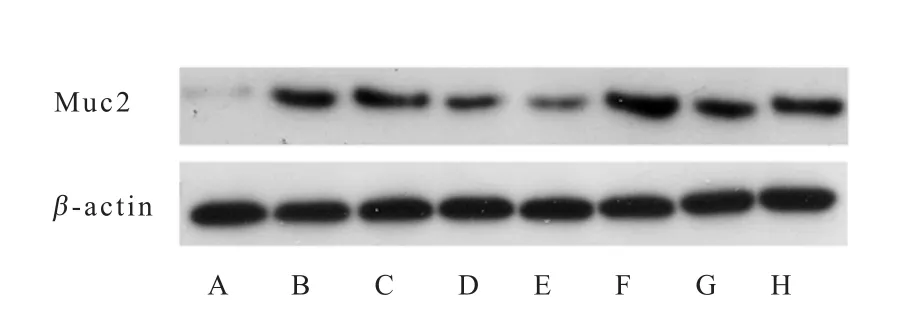
图2 肠道黏蛋白Muc2代表性Western blot蛋白条带
2.3.2 外源粪菌干预对肠道紧密连接蛋白ZO-1和Occludin蛋白表达的影响 外源粪菌干预对12日龄肠道紧密连接蛋白ZO-1和Occludin蛋白表达的影响结果如图3和表8所示。与对照组相比,试验组12日龄回肠和结肠ZO-1、Occludin蛋白表达水平显著提高(P<0.05)。
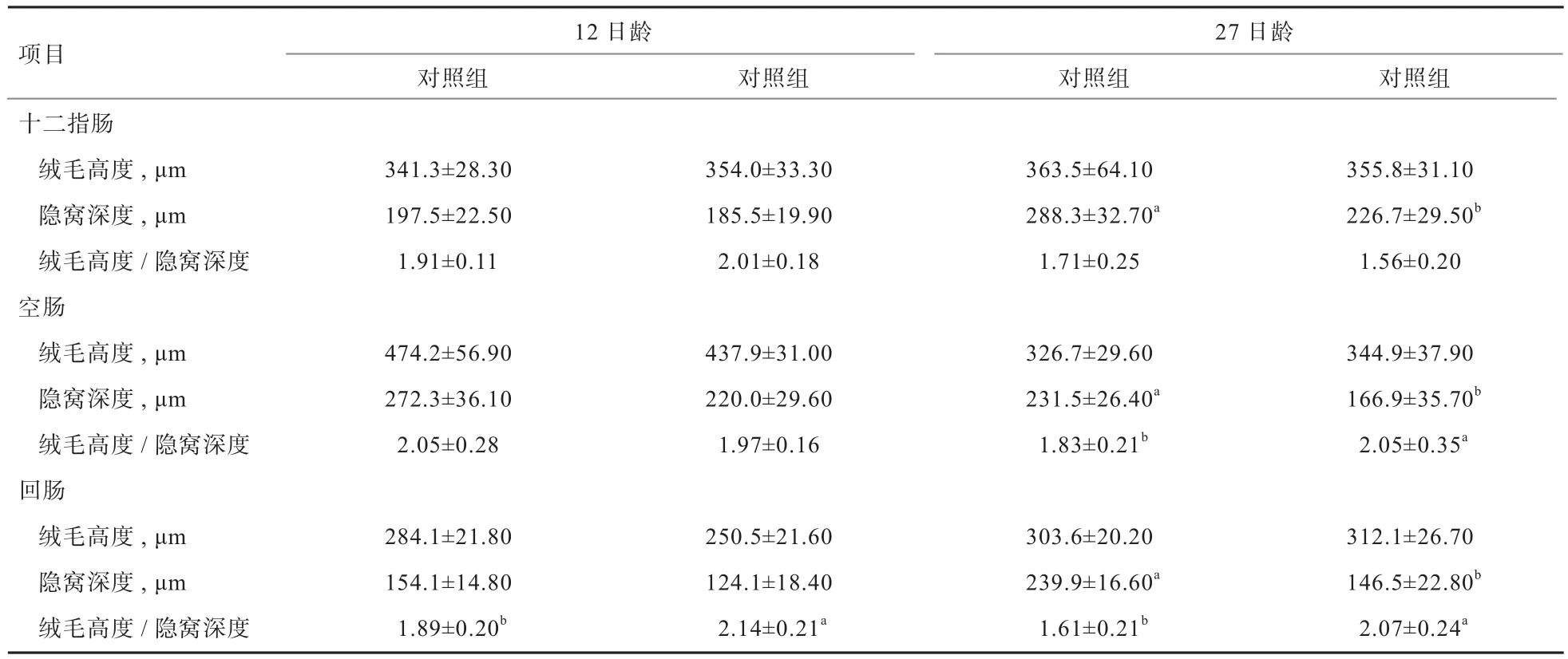
表4 外源粪菌干预对受体猪肠道形态的影响

表5 外源粪菌干预对肠道杯状细胞数量的影响

表6 外源粪菌干预对肠道黏蛋白基因Muc2 mRNA相对表达量的影响

图3 肠道紧密连接蛋白ZO-1和Occludin代表性Western blot蛋白条带

图4 肠道SIgA+细胞免疫组织化学分析(200×)
2.3.3 外源粪菌干预对肠道SIgA+细胞数的影响 肠道SIgA+细胞免疫组织化学分析结果如图4所示,对照组和试验组回肠、结肠均出现阳性染色。进一步进行光密度分析的结果(表9)表明,试验组12日龄结肠SIgA+细胞光密度值显著高于对照组(P<0.05),而回肠SIgA+细胞光密度值与对照组相比无显著差异(P>0.05);27日龄时,试验组回肠与结肠SIgA+细胞光密度值与对照组相比均无显著差异(P>0.05)。
3 讨 论
3.1 外源粪菌干预对受体猪生长性能及肠道形态的影响多项研究表明肠道微生物与动物机体的体重、生长具有显著相关性,如Ramayo-Caldas等[7]对猪肠道微生物相互作用网络进行分析,首次发现肠道菌群与猪生长性状密切相关;Han等[8]通过16S rDNA高通量测序也发现,高体重猪的肠道菌群多样性显著高于低体重猪,同时高体重猪具有更高水平的厚壁菌门以及厚壁菌门∶拟杆菌门,该研究通过对2种猪的肠道菌群进行PICRUSt功能预测分析进一步发现,高体重猪的肠道菌群具有与物质降解相关通路更高水平的富集。本试验表明,外源粪菌干预在一定程度上提高了受体猪的生长性能。笔者认为,外源粪菌干预对受体猪生长性能的影响可能由2个方面决定:一方面,外源粪菌干预能提高移植受体肠道菌群的多样性,促进菌群将机体自身无法利用的多种营养物质(例如未消化的多糖和蛋白质等)作为底物进行发酵,并最终生成可被肠道和菌群直接吸收利用的物质,进而提高机体对营养物质的消化与利用效率[9];另一方面,外源粪菌干预促进了受体猪肠道结构的发育并增强了消化吸收功能。O'loughlin等[10]研究发现,由于肠道绒毛萎缩和隐窝肥大而导致对营养物质、水分和电解质消化与吸收作用减弱是诱发腹泻的重要因素。而幼龄哺乳动物腹泻会严重影响机体正常的生长发育,进而导致生长性能降低和死亡率升高。本研究结果表明,外源粪菌干预能显著促进受体猪肠道形态发育,提高其对营养物质的消化与吸收效率,进而减少腹泻的产生。

表7 外源粪菌干预对肠道黏蛋白Muc2蛋白表达的影响

表8 外源粪菌干预对肠道紧密连接蛋白ZO-1和Occludin蛋白表达的影响

表9 外源粪菌干预对肠道SIgA+细胞数量的影响
3.2 外源粪菌干预对受体猪肠道屏障功能的影响 黏蛋白、紧密连接蛋白和分泌型免疫球蛋白A(SIgA)是机体肠道屏障功能的3个重要组成部分。Muc2是肠道黏液层中最主要的黏蛋白,由杯状细胞分泌,能高效抑制有毒有害物质对肠上皮细胞的损伤并参与肠道化学屏障功能的构建。肠道紧密连接蛋白ZO-1和Occludin是肠道上皮屏障的重要组成成分,其能有效阻止肠腔内毒素、炎性介质及细菌等物质的旁细胞转运,维持肠道上皮屏障的完整性。SIgA+细胞是由肠道固有层内的B细胞经增殖、分化形成的成熟浆细胞,其合成和分泌的SIgA是机体肠道免疫屏障中的主要抗体,能使肠道免受病原体和毒素的危害。
本试验发现,对受体仔猪进行外源粪菌干预可增加肠道杯状细胞和SIgA+细胞数,提高黏蛋白和紧密连接蛋白表达,进而实现对受体仔猪肠道屏障功能的调节。大量研究表明,肠道菌群经自身合成和分解所生成的代谢产物不仅能作为营养物质被肠道上皮细胞吸收和利用,还能作为调节机体肠屏障功能的信号分子发挥生理调控作用。例如,无法被动物机体自身消化酶所降解的植物性多糖能够在结肠厌氧共生菌丁酸弧菌属和梭菌属等细菌的发酵作用下生成短链脂肪酸乙酸、丙酸和丁酸。Gaudier等[11]研究表明,丁酸除了作为结肠上皮细胞的主要能源物质之外,还能促进杯状细胞分化和黏蛋白表达进而增强肠道黏膜免疫能力。除此之外,肠道双歧杆菌生成的乙酸能阻止肠出血性大肠杆菌诱导的肠上皮细胞凋亡和炎症反应进而维持上皮细胞完整性和保护肠道免受感染[12]。肠道菌群代谢色氨酸生成的吲哚及其衍生物同样能在肠屏障功能的维持方面发挥重要作用。Escherichia coli是吲哚的经典合成菌,且吲哚能作为一种“群体感应信号”调节E.coli和其他细菌的毒性和生物膜形成过程,并且对肠道具有有益作用[13]。有研究表明,肠道共生菌生成的吲哚能通过促进结肠上皮细胞紧密连接和黏附连接表达增强肠道上皮屏障功能[14]。Wlodarska等[15]在最近的一项研究中也发现,机体肠道内消化链球菌属的代谢产物吲哚丙烯酸能对肠上皮屏障功能发挥有益作用并帮助缓解肠道炎症反应。除外源性物质之外,肠道菌群对内源性物质胆汁酸的代谢同样能影响肠屏障功能。在进入肠道之后,胆汁酸除了发挥帮助机体吸收和运输饮食中脂肪的作用之外,还能激活肠道内的特异性受体例如法尼酯X受体(Farnesoid X Receptor,FXR)或G蛋白偶联受体(G Proteincoupled Receptor,GPCR)及其下游相关信号通路进而影响肠道免疫功能[16-17]。由于具有胆汁酸盐水解酶(Bile Salt Hydrolase,BSH)和脱羟基酶活性的特定细菌群落能够影响机体内的胆汁酸组成,并且胆汁酸受体结合不同种类胆汁酸的亲和度也各不相同,当肠道微生态结构发生改变时,菌群能通过影响机体内胆汁酸的组成进而对胆汁酸受体相关信号通路进行调节并影响肠道屏障功能和免疫应答[18]。外源粪菌干预可能通过改变肠道菌群物质代谢途径,促进肠道屏障功能相关代谢产物的合成及下游信号通路的激活[2],进而调节受体猪肠道屏障功能,然而其具体机制仍有待进一步研究。
4 小 结
外源粪菌干预能通过增加肠道杯状细胞和SIgA+细胞数、提高黏蛋白和紧密连接蛋白表达的方式调节受体猪肠道屏障功能,具有维持猪肠道功能稳态和促进肠道健康的作用。
[1] Hooper L V, Macpherson A J. Immune adaptations that maintain homeostasis with the intestinal microbiota[J]. Nat Rev Immunol, 2010, 10(3): 159.
[2] Khoruts A, Sadowsky M J. Understanding the mechanisms of faecal microbiota transplantation[J]. Nat Rev Gastro & Hepat,2016, 13(9): 508-516.
[3] Paramsothy S, Kamm M A, Kaakoush N O,et al. Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial[J]. Lancet, 2017,389(10075): 1218-1228.
[4] Diao H, Yan H L, Xiao Y,et al. Intestinal microbiota could transfer host Gut characteristics from pigs to mice[J]. BMC Microbiol, 2016, 16(1): 238.
[5] Gao Y, Han F, Huang X,et al. Changes in gut microbial populations, intestinal morphology, expression of tight junction proteins, and cytokine production between two pig breeds after challenge with K88: A comparative study[J]. J Anim Sci, 2013,91(12): 5614-5625.
[6] Pang X, Hua X, Yang Q,et al. Inter-species transplantation of gut microbiota from human to pigs[J]. ISME J, 2007, 1(2): 156-162.
[7] Ramayo-Caldas Y, Mach N, Lepage P,et al. Phylogenetic network analysis applied to pig gut microbiota identifies an ecosystem structure linked with growth traits[J]. ISME J, 2016,10: 2973-2977.
[8] Han G G, Lee J Y, Jin G D,et al. Evaluating the association between body weight and the intestinal microbiota of weaned piglets via 16S rRNA sequencing[J]. Vet Microbiol, 2016, 196:55-62.
[9] Fan P, Liu P, Song P,et al. Moderate dietary protein restriction alters the composition of gut microbiota and improves ileal barrier function in adult pig model[J]. Sci Rep-UK, 2017, 7:43412.
[10] O'loughlin E V, Scott R B, Gall D G. Pathophysiology of infectious diarrhea: changes in intestinal structure and function[J]. J Pediatr Gastr Nutr, 1991, 12(1): 5-20.
[11] Gaudier E, Jarry A, Blottiere H M,et al. Butyrate specifically modulates MUC gene expression in intestinal epithelial goblet cells deprived of glucose[J]. Am J Physiol-Gastr L, 2004,287(6): G1168-G1174.
[12] Fukuda S, Toh H, Hase K,et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J].Nature, 2011, 469(7331): 543.
[13] Lee J, Jayaraman A, Wood T K. Indole is an inter-species biofilm signal mediated by SdiA[J]. BMC Microbiol, 2007,7(1): 42.
[14] Shimada Y, Kinoshita M, Harada K,et al. Commensal bacteriadependent indole production enhances epithelial barrier function in the colon[J]. PLoS One, 2013, 8(11): e80604.
[15] Wlodarska M, Luo C, Kolde R,et al. Indoleacrylic Acid Produced by Commensal Peptostreptococcus Species Suppresses Inflammation[J]. Cell Host Microbe, 2017, 22(1):25-37.
[16] Gadaleta R M, Van Erpecum K J, Oldenburg B,et al. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease[J]. Gut, 2011,60(4): 463-472.
[17] Cipriani S, Mencarelli A, Chini M G,et al. The bile acid receptor GPBAR-1 (TGR5) modulates integrity of intestinal barrier and immune response to experimental colitis[J]. PLoS One, 2011, 6(10): e25637.
[18] Li T, Chiang J Y L. Bile acid signaling in metabolic disease and drug therapy[J]. Pharmacol Rev, 2014, 66(4): 948-983.
