发酵天数对裹包全混合日粮发酵品质及有氧稳定性的影响
2018-03-20叶建敏孙凯晶赵雪娇邱胜桥张永根
刘 岩,叶建敏,孙凯晶,赵雪娇,邱胜桥,董 博,张永根*
(1.东北农业大学动物科学技术学院,黑龙江哈尔滨 150030;2.黑龙江省畜牧总站,黑龙江哈尔滨 150069;3.黑龙江蓬勃草业有限公司,黑龙江安达 151400)
全混合日粮(TMR)是根据反刍动物不同生长发育阶段的营养需求,将精饲料、粗饲料、矿物质、维生素等按照适当比例配制的一种营养相对平衡的全价日粮。TMR具有改善适口性、提高干物质采食量、保证奶牛采食均衡、降低饲料成本、保护瘤胃健康、降低奶牛发病率、提高产奶量等功能[1]。但是TMR在实际应用过程中也存在一些问题,特别是为了保证日粮的混合均匀度和提高适口性,防止动物挑食,往往需要在搅拌过程中添加水(饲料含水量一般控制在40%~50%),由于TMR营养成分含量高,好氧性微生物较活跃,从而使得TMR容易霉烂变质,造成饲料营养物质损失,不利于长期贮存和商品化运输[2]。
为克服上述问题,日本在20世纪90年代率先开发了TMR发酵技术,将生产好的TMR用自动打捆裹膜机将其压实裹包起来,造成密封厌氧环境进行发酵。通过此发酵方式可以有效利用非常规饲料资源,降低饲料成本,方便商品化运输,不仅延长了TMR保存时间,还可提高原料的营养价值利用率[3],提高奶牛生产性能,饲喂效果明显[4]。本试验旨在评价不同发酵时间发酵全混合日粮(Fermented Total Mixed Ration,FTMR)的发酵品质及有氧稳定性,以期为FTMR在牧场中应用提供理论依据。
1 材料与方法
1.1 TMR配方 TMR由安达市蓬勃牧草有限公司提供。日粮组成及营养成分见表1。
1.2 FTMR制作 在TMR料中添加购自日本的发酵菌剂,主要成分为植物乳酸杆菌。自动打捆裹膜机拉伸膜裹包TMR,自动挤压打捆裹包为圆柱形,高52 cm,直径为55 cm。自动挤压打捆裹包时间为2 min,层数为7层。含水量控制在45%左右,制成FTMR。膜袋子外面贴上标签,注明名称、重量、编号、制作时间、制作人等内容,将制作好的FTMR存放在室内干燥地面上贮存。
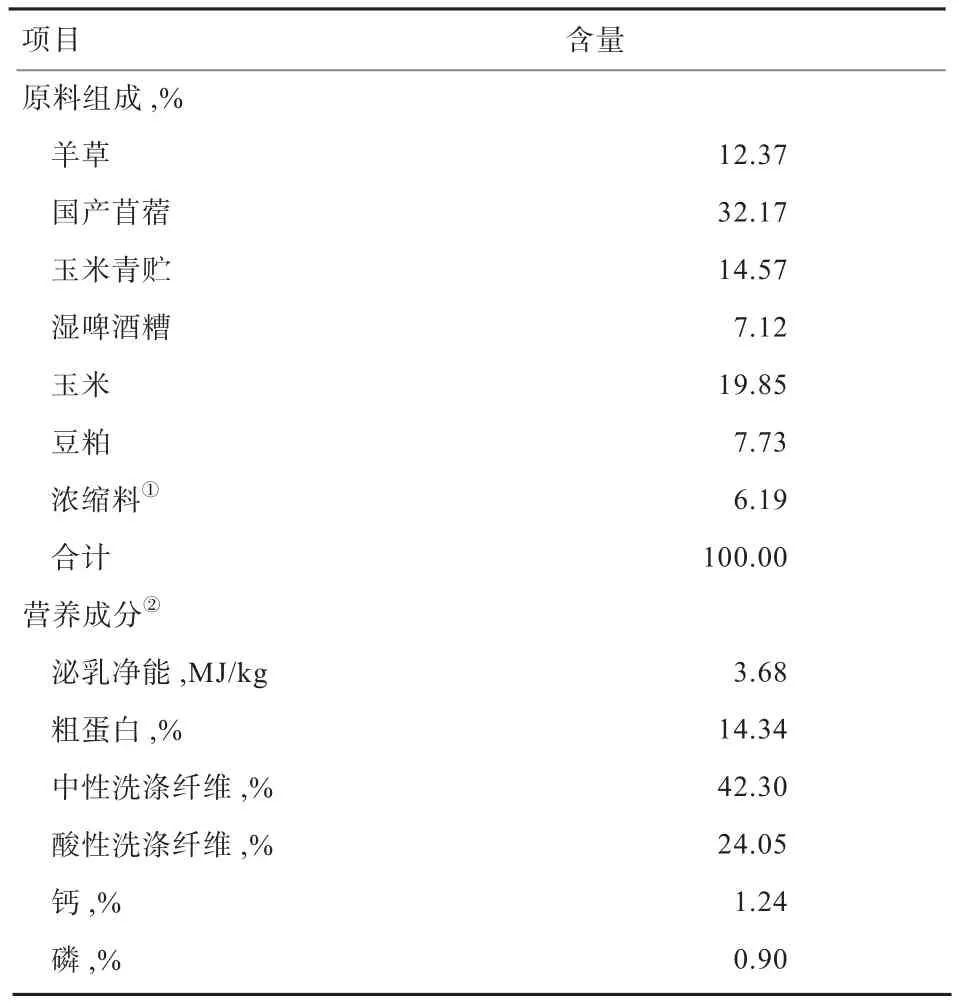
表 1 试验日粮组成及营养成分
1.3 试验设计及样品采集 试验采用单因素试验设计。于发酵0、3、7、15、30 d取样,分别标记为D0、D3、D7、D15、D30 共5个处理组,每个处理组设8个重复。分别在发酵完成时用自制的取样器分别沿着裹包的纵轴上、中、下及对轴共6个点取样,样品混合均匀,四分法取样,部分样品65℃烘干48 h,制备风干样,用于常规营养成分测定。每份鲜样取出10 g,置于250 mL锥形瓶中,加入90 mL去离子水,4℃下制备浸提液,用于测定pH、乳酸(LA)、氨态氮(NH3-N)、挥发性脂肪酸(VFA)。在8个重复中随机选取3个重复,取样用于测定微生物及有氧稳定性。
1.4 测定指标及方法
1.4.1 营养成分测定 饲料样品干物质(DM)、粗蛋白(CP)、粗脂肪(EE)、粗灰分(Ash)等常规营养指标按照AOAC方法[5]进行分析;中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)依照Van Soest等[6]方法进行测定;淀粉含量参照张旭等[7]方法测定。
1.4.2 发酵指标测定 用Sartorius PB-10型pH测定仪立即测定浸提液pH;浸提液NH3-N采用苯酚-次氯酸钠比色法测定[8],结果表示为NH3-N占总氮(TN)的比例;浸提液LA含量采用Waters-600型高效液相色谱仪测定;浸提液中乙酸(AA)、丙酸(PA)和丁酸(BA)含量采用岛津GC-2010气相色谱仪测定。
1.4.3 微生物数量测定 取10 g鲜样品,加入90 mL无菌生理盐水浸提30 min,吸取浸提液梯度稀释,分别涂布于MRS琼脂、PDA培养基进行乳酸菌和酵母菌活菌数量测定[9]。霉菌总数测定依照中华人民共和国国家标准《饲料中霉菌总数的测定》(GB 13092-2006)[10]进行测定。计数单位表示为每克发酵料中所含有菌落形成单位(log10CFU/g),鲜重基础(FM)。
1.4.4 有氧稳定性测定 利用泡沫箱作为保温隔热系统,于外部均匀打孔,保证箱体通气,以3 L聚乙烯塑料桶作为物料盛装系统,采用MDL-1048A高精度多通道温度记录仪检测温度,同时测定环境温度,每隔1 h记录温度,样品温度高于室温2℃说明样品开始腐败。设置D0、D3、D7、D15、D30 共5个处理组,每组3个重复,分别在有氧暴露1、3、5 d取样,测定营养指标、发酵指标及微生物含量。
1.5 统计分析 试验数据采用Excel软件整理后,采用SAS 9.4软件中GLM模块进行单因素方差分析,采用Duncan's法进行显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 不同发酵天数对FTMR营养物质含量的影响 由表2可见,FTMR中的DM随着发酵时间延长呈下降趋势,D7、D15、D30组 DM 差异不显著(P>0.05);CP、NDF随着贮存时间延长无显著变化(P>0.05);ADF、EE、Ash含量随着贮存时间延长呈逐渐增加趋势;淀粉含量随着贮存时间延长呈降低趋势。

表 2 不同贮存时间对FTMR营养物质含量的影响(DM基础) %
2.2 不同发酵天数对FTMR发酵品质的影响 由表3可见,随着时间延长pH呈降低趋势,D3、D7、D15、D30组显著高于D0组(P<0.05);LA含量随着时间延长呈上升趋势,D15和D30组显著高于D0、D3组(P<0.05);D7、D15、D30组AA含量显著高于其他2组(P<0.05);PA仅在D7组和D30组检出,且组间差异显著(P<0.05);BA在整个发酵过程中并未检出;LA/AA呈先升高后降低趋势,D7、D15、D30组显著低于其他2组(P<0.05);NH3-N含量呈上升趋势,D7、D15组差异不显著(P>0.05);D3、D7、D15组乳酸菌数量显著高于其他2组(P<0.05);D0、D3、D7组酵母菌数量显著低于D30组(P<0.05);D3、D7、D15、D30组霉菌数量显著低于D0组(P<0.05)。
2.3 不同发酵天数FTMR有氧稳定性变化
2.3.1 有氧稳定时间 由图1可看出,D0和D3组分别在暴露于空气中52 h和85 h时,样品温度高于环境温度2℃,而D7、D15、D30组在暴露期间,样品温度始终未高于环境温度2℃。
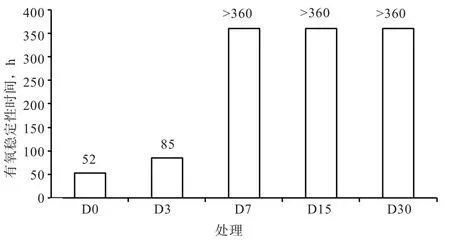
图 1 FTMR的有氧稳定性
2.3.2 有氧暴露期间化学及微生物变化 由表4可见,随着有氧暴露时间延长,各组pH逐渐上升,D0和D3组暴露5 d的pH显著高于其他暴露天数(P<0.05);各组AA含量随着有氧暴露时间延长呈下降趋势,D0和D3组暴露5 d的AA含量显著低于暴露0、1 d(P<0.05);随着有氧暴露时间延长,各组LA含量呈逐渐下降变化趋势,D0、D3、D15、D30组暴露5 d的LA含量均显著低于未暴露(P<0.05);在有氧暴露期间,各组酵母菌、霉菌数量均随着有氧暴露时间延长呈上升趋势,D0组在暴露第5天时酵母菌数目大于5 log10CFU/g,D0和D3组在暴露第5天时霉菌数目均大于5 log10CFU/g。
3 讨 论
3.1 不同发酵天数FTMR营养物质分析 试验中FTMR随着发酵时间延长,DM呈降低趋势,这可能是因为贮存后物料的呼吸和发酵作用使DM有所损失,此结果与李成会等[11]研究结果一致。CP含量随着发酵时间延长与D0组相比有增加现象,可能原因是发酵引起DM损失相应地增加了这些营养物质含量。NDF含量随着发酵时间延长有一定量的减少,ADF含量增加。淀粉含量随着贮存时间延长呈降低趋势,这可能是FTMR发酵过程中青贮初期细胞呼吸和酶解过程所导致,也可能是由于添加乳酸菌剂增加了青贮中有效乳酸菌数量,大量乳酸菌发酵利用了部分淀粉导致淀粉含量降低。EE和Ash含量随着发酵时间延长不断增加,可能是因为DM损失引起两者含量相应的增加。
3.2 不同发酵天数FTMR发酵指标分析 根据Catchpoole等[12]报道,高品质青贮pH应低于4.2,LA含量介于3%~13% DM,NH3-N/ TN小于10%,BA含量小于0.2%DM。本试验中,FTMR的pH随着发酵时间延长呈降低趋势,30 d时pH仍未降至4.2以下,但FTMR仍能良好保存,这可能与乳酸菌活性较低或FTMR的DM较高有关,这与Meeske等[13]研究结果一致。另一方面,较高的DM对有害微生物生长有抑制作用,降低其对蛋白质等营养成分的降解[14],这也能体现在整个发酵过程中,NH3-N始终小于3.5% DM。LA含量在7 d后大于3% DM,达到标准,AA含量在7 d后趋于稳定且小于2.1% DM,PA只在7 d和30 d检出且小于0.2%DM,BA在整个发酵过程中并未检出,这说明FTMR在发酵7 d后发酵品质良好。乳酸菌数量呈先上升后下降趋势,这是由于发酵后期受到LA和AA的抑制作用。酵母菌数量始终小于5 log10CFU/g,霉菌数量呈下降趋势,说明发酵过程中并未发生腐败变质。
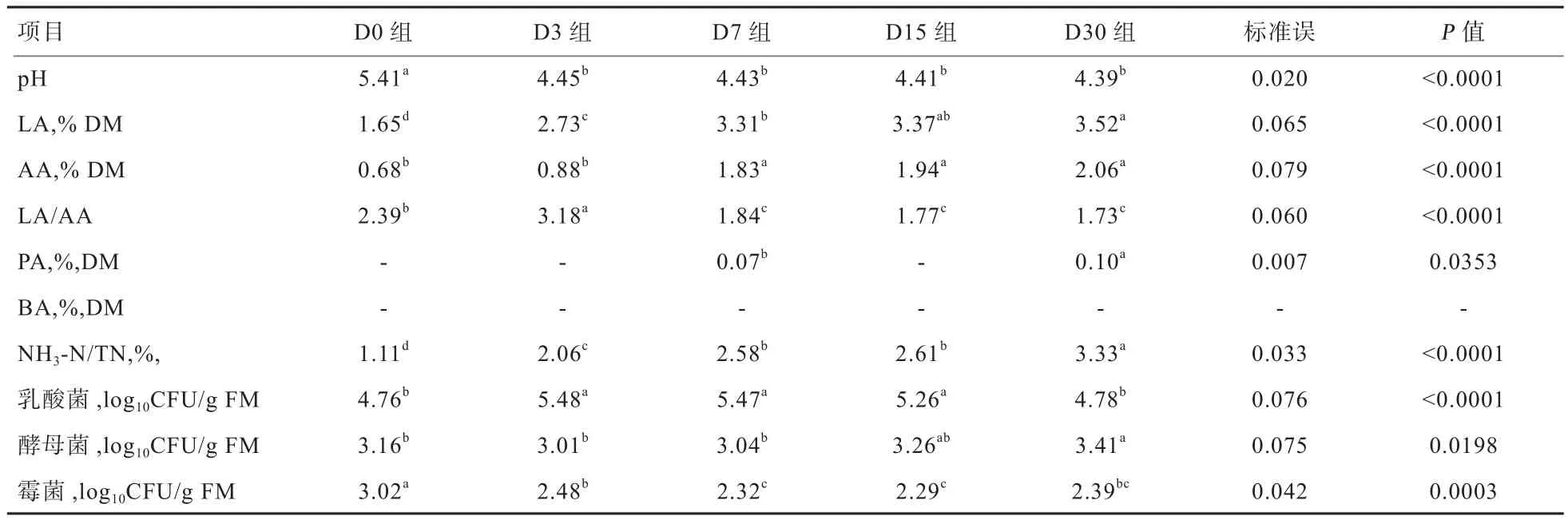
表 3 不同贮存时间对FTMR发酵品质的影响
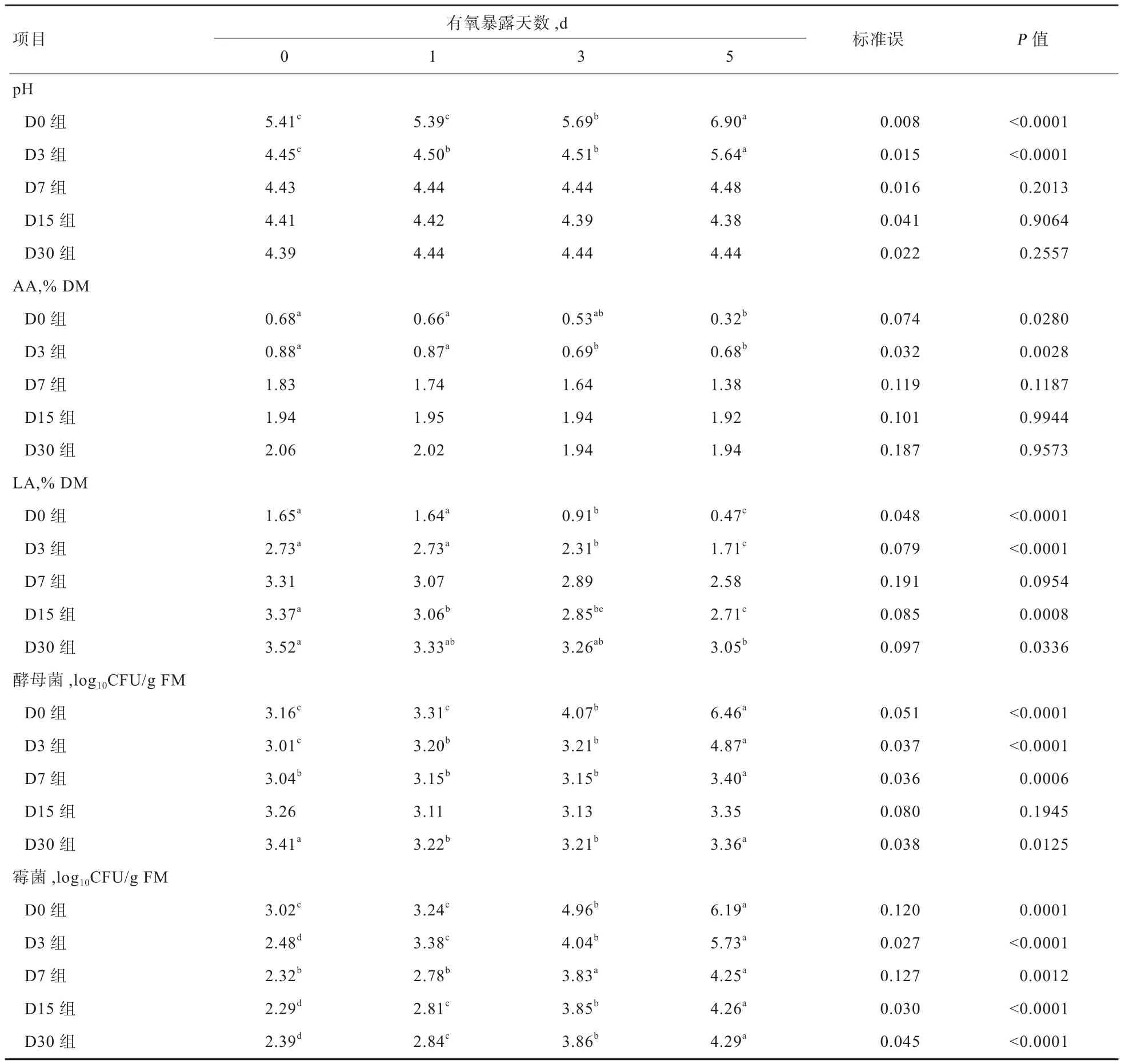
表 4 FTMR有氧暴露期间化学及微生物成分变化
3.3 不同发酵天数FTMR有氧稳定性变化分析 FTMR开包后,发酵环境由厌氧环境变成有氧环境,好氧性微生物开始大量繁殖,导致LA含量下降,pH升高,同时产生热量导致温度上升[15]。在有氧暴露期间,温度变化直观反映微生物活动情况,本试验中,D0组和D3组分别在暴露于空气中52 h和85 h时,样品温度高于环境温度2℃,发生腐败,而其他3组在暴露期间没有发生腐败现象。D0组和D3组在暴露第5天后pH显著升高至6.90和5.64,而其他3组pH无显著变化,这表明D0和D3组在暴露第5天时已经发生腐败。这可能是由于D0和D3组AA含量较低且在暴露第5天后显著降低导致。Wilkinson等[16]认为,在有氧暴露阶段AA可以有效地抑制酵母菌、霉菌和真菌的繁殖,其含量是预测青贮饲料有氧稳定性优劣的主要指标之一。Schmidt等[17]发现,青贮物中含有较高浓度的AA是青贮有氧稳定性提高的基本原因,且AA浓度越高,有氧腐败时间相应地延长。通常情况下,青贮饲料的腐败变质主要由酵母菌增殖引起,当青贮饲料中酵母菌数目大于5 log10CFU/g时,青贮饲料易发生腐败变质[18]。本试验在有氧暴露期间,D0组在暴露第5天时,酵母菌数目大于5 log10CFU/g,说明D0组在暴露第5天已经发生了腐败。
4 结 论
试验结果表明,TMR经裹包发酵处理后,pH降低,LA、AA、NH3-N含量上升,且7 d后表现出良好的发酵品质,同时具有较高的有氧稳定性。
[1] 陈前岭, 陈连民, 张军, 等. 全混合日粮(TMR)饲喂技术在奶牛养殖生产中应用的研究进展[J]. 饲料工业, 2014,35(24): 54-58.
[2] 张广凤, 朱风华, 王利华, 等. 发酵全混合日粮的生产及应用[J]. 黑龙江畜牧兽医, 2014(19): 108-111.
[3] Wang J, Wang J Q, Bu D P,et al. Effect of storing total mixed rations anaerobically in bales on feed quality[J]. Anim Feed Sci Tech, 2010, 161(3): 94-102.
[4] Oliveira A S, Weinberg Z G, Ogunade I M,et al. Meta-analysis of effects of inoculation with homofermentative and facultative heterofermentative lactic acid bacteria on silage fermentation,aerobic stability, and the performance of dairy cows[J]. J Dairy Sci, 2017, 100(6):4587-4603.
[5] AOAC. Official Methods of Analysis[M]. 15th ed, Arlington,VA, USA: Association of Official Analytical Chemists, 1990.
[6] Van Soest P V, Robertson J, Lewis B. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. J Dairy Sci, 1991, 74(10): 3583-3597.
[7] 张旭, 蒋桂韬, 王向荣, 等. 酶法测定谷物副产品中淀粉含量[J]. 广东饲料, 2013, 22(10): 33-35.
[8] 原现军, 王奇, 李志华, 等. 添加糖蜜对青稞秸秆和多年生黑麦草混合青贮发酵品质及营养价值的影响[J]. 草业学报,2013, 22(3): 116-123.
[9] Whiter A G, Jr L K. The Effect of a dry or liquid application of lactobacillus plantarum, MTD1 on the fermentation of alfalfa silage[J]. J Dairy Sci, 2001, 84(10): 2195.
[10] 全国饲料工业标准化技术委员会. GB/T 13092-2006饲料中霉菌总数的测定[S]. 北京: 中国标准出版社, 2006.
[11] 李成会, 郝晓辉, 李建国. 裹包技术在后备奶牛全混合日粮贮存中的应用[J]. 江苏农业科学, 2012, 40(1): 176-179.
[12] Catchpoole V R, Henzell E F. Silage and silage-making from tropical herbage species[J]. Herbage Abstracts, 1971, 41(3):213-221.
[13] Meeske R, Merwe G D V D, Greyling J F,et al. The effect of adding an enzyme containing lactic acid bacterial inoculant to big round bale oat silage on intake, milk production and milk composition of Jersey cows[J]. Anim Feed Sci Tech, 2000,97(4): 159-167.
[14] 邱小燕, 原现军, 郭刚, 等. 添加糖蜜和乙酸对西藏发酵全混合日粮青贮发酵品质及有氧稳定性影响[J]. 草业学报,2014, 23(6): 111-118.
[15] Chen L, Guo G, Yuan X,et al. Effect of applying molasses and propionic acid on fermentation quality and aerobic stability of total mixed ration silage prepared with whole-plant corn in tibet[J]. Asian-Aust J Anim, 2014, 27(3): 349-356.
[16] Wilkinson J M, Davies D R. The aerobic stability of silage: key findings and recent developments[J]. Grass Forage Sci, 2013,68(1): 1-19.
[17] Schmidt R J, Jr L K. The effects of Lactobacillus buchneri, with or without a homolactic bacterium on the fermentation and aerobic stability of corn silages made at different locations[J]. J Dairy Sci, 2010, 93(4): 1616.
[18] McDonald P, Henderson A R, Heron S J E. The Biochemistry of Silage[M]. 2th ed. Aberystwyth : Cambrian Printers Ltd, 1991.
