藤黄酸对非小细胞肺癌A549细胞凋亡及Bcl-2、Bax、P53基因表达的影响
2018-03-20郭晓彤魏优蕾雷加吉李广华徐广全
郭晓彤 魏优蕾 雷加吉 李广华 徐广全
(哈尔滨医科大学附属第二医院胸外科,黑龙江 哈尔滨 150001)
非小细胞肺癌(NSCLC)是肺癌的主要病理类型,约占全部肺癌的80%〔1〕。在过去的几十年里,手术、放化疗、新辅助治疗等是肺癌的主要治疗手段,虽然挽救了部分患者的生命,但疗效仍非常有限,其中Ⅲa、Ⅲb及Ⅳ期的NSCLC患者5年生存率仅为19%、7%和2%〔2〕。由此可见,筛选开发新一代高效低毒性的抗肺癌药物意义重大。藤黄酸是中药藤黄的主要成分,既往研究已经证实〔3,4〕其能有效抑制多种(如肝癌、乳腺癌、结直肠癌及前列腺肿瘤等)癌细胞增殖。然而,藤黄酸对NSCLC A549细胞凋亡的影响及机制尚未完全阐明。本研究观察不同浓度的藤黄酸对NSCLC A549细胞凋亡及B淋巴细胞瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)、P53表达的影响。
1 材料和方法
1.1主要材料 A549细胞购自上海信裕生物科技有限公司,藤黄酸(分子式C38H44O8,分子量628.76 D,纯度≥98%)购于成都瑞芬思生物科技有限公司,胎牛血清、F12-K细胞培养基、0.25%胰酶-0.02%乙二胺四乙酸(EDTA)、磷酸缓冲盐溶液(PBS)等均购自美国Gibco公司,Bcl-2多克隆抗体、Bax多克隆抗体、P53多克隆抗体及PUMA多克隆抗体购于Cell Signaling Technology公司,Annexin V-FITC/PI双染色凋亡细胞检测试剂盒购于碧迪医疗器械(上海)有限公司(BD),细胞裂解液自行配制,酶标仪为芬兰Labsystems公司,流式细胞仪购于美国Becton Dickinson公司,CO2培养箱购自日本SANYO公司。
1.2方法
1.2.1A549细胞培养、冻存、复苏 A549细胞采用F12-K完全培养基于37℃、5%CO2、饱和湿度的培养箱中常规培养,待细胞密度达90%左右且生长状态良好时加入0.25%胰酶-0.02% EDTA消化,密切观察,待细胞变圆后加入完全培养基使消化反应停止,常规方法收集细胞悬液,以800 r/min室温离心5 min后采用完全培养基重悬细胞,传代于培养皿中继续培养。当细胞密度达90%左右且生长状态良好时消化(具体方法同上)收集细胞,离心去上清后采用细胞冻存液重悬细胞,重悬的细胞转移至冻存管,在4℃冰箱放置0.5 h后转移至-80℃冰箱保存。实验时取出冻存的细胞,在37℃水浴中复苏,离心去上清后采用完全培养基重悬细胞,重悬的细胞装于培养瓶中,在37℃、5% CO2、饱和湿度的培养箱中继续培养。
1.2.2A549细胞凋亡实验 取对数生长期的A549细胞,采用0.25%胰酶-0.02% EDTA消化,离心后收集细胞并采用完全培养基重悬,然后将重悬的细胞置于镜下计数,将细胞浓度调整为1.0×105个/ml,以3 ml/孔的量接种于6孔板,然后将其置于37℃、5% CO2、饱和湿度的培养箱中继续培养,待细胞融合率达到60%左右时去培养液并采用PBS常规清洗3次,根据实验需求分为空白对照组、藤黄酸2.5、5.0和10.0 μmol/L组,空白对照组加入完全培养基3 ml,藤黄酸2.5、5.0和10.0 μmol/L组加入3 ml含藤黄酸2.5、5.0和10.0 μmol/L的培养基,置于37℃、5% CO2、饱和湿度的培养箱中培养24 h,加入0.25%胰酶消化收集细胞,采用PBS按1∶1重悬细胞,取重悬后的单细胞悬液100 μl分装于两支试管,其中一支加入5 μl的Annexin V-FITC,另一只加入10 μl的PI,混匀后将两支试管中的悬液合装,轻震荡混匀后避光孵育15 min,在流式细胞仪检测525 nm波长处V-FITC荧光强度,在流式细胞仪610 nm波长处检测PI荧光强度,采集数据用Flow Jo软件进行处理。
1.2.3MTT检测A549细胞生长情况 细胞制备、收集、铺板等同凋亡实验,接种于96孔板中加入100 μl含5×103个细胞悬浮液继续培养,培养条件同凋亡实验,将50 mmol/L的藤黄酸母液用完全培养基稀释成0.5、1.0、2.5、5.0和10.0 μmol/L的培养液,根据不同的培养液浓度分为0.5、1.0、2.5、5.0和10.0 μmol/L五组,各孔加入100 μl含药培养基,每样浓度设置6个复孔,分别于干预24、48、72 h后加入MTT储存液10 μl,继续培养3 h,1 200 r/min离心5 min,去除上清液后每孔加入150 μl的DMSO并低速震荡10 min使结晶充分溶解,将96孔板置于酶标仪,以490 nm波长检测各孔吸光值,计算细胞存活率。
1.2.4Western印迹实验 取对数生长期的A549细胞用0.25%胰酶消化,离心、收集细胞、细胞重悬及细胞计数方法同凋亡实验,将细胞浓度调整为1.5×105个/ml,接种于60 mm的培养皿,每培养皿中3 ml相当于4.5×105个细胞,置于37℃、5%CO2、饱和湿度的培养箱中贴壁过夜,融合率达60%左右时去原培养液,PBS清洗3次,分别加入3 ml完全培养基(空白对照组)和3 ml含藤黄酸2.5、5.0、10.0 μmol/L的培养基,置于37℃、5% CO2、饱和湿度的培养箱中继续培养24 h,PBS清洗3次,每培养皿中加入200 μl裂解液,刮取细胞集中于裂解液,转移至1.5 ml离心管,充分裂解30 min,12 000 r/min 4℃离心5 min,取上清保存至600 μl离心试管,测定P53蛋白水平及其下游基因Bcl-2、Bax和PUMA的表达水平〔5〕。P53蛋白以750 nm为检测波长,酶标仪读取各孔吸光值,绘制标准曲线,计算样品浓度,Bcl-2、Bax和PUMA基因表达在电泳分离目标蛋白后常规处理,化学发光后采用Quantity One图像分析软件进行分析处理,计算其相对表达量〔6〕。
1.3统计学方法 采用SPSS23.0软件行t检验或方差分析。
2 结 果
2.1藤黄酸对A549细胞凋亡率的影响 干预24 h后,空白对照组A549细胞凋亡率为(7.82±1.34)%,藤黄酸2.5 μmol/L组为(22.46±3.47)%,藤黄酸5.0 μmol/L组为(41.37±6.28)%,藤黄酸10 μmol/L组为(66.67±5.48)%,4组比较差异有统计学意义(P<0.05)。随着藤黄酸浓度的上升,A549细胞凋亡率呈上升趋势,两两比较差异均有统计学意义(P<0.05)。
2.2藤黄酸对A549细胞生长情况的影响 采用藤黄酸干预的各组A549细胞的生长均受到一定程度的抑制,且存在剂量、时间关系,不同浓度的藤黄酸干预组A549细胞存活率均低于空白对照组,随着时间的推移,各干预组A549细胞存活率降低(P<0.05)。见表1。
2.3藤黄酸对A549细胞P53、Bcl-2、Bax、PUMA表达水平的影响 干预24 h后,P53、Bax、PUMA的相对表达量随着藤黄酸浓度的增加而增加,且2.5、5.0、10.0 μmol/L组均高于空白对照组(P<0.05);但Bcl-2的相对表达量随着藤黄酸浓度的增加而降低,且2.5、5.0、10.0 μmol/L组低于空白对照组(P<0.05)。见表2。

表1 不同浓度藤黄酸对A549细胞生长的影响
与空白对照组比较:1)P<0.05;与24 h比较:2)P<0.05
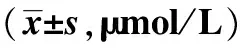
表2 不同浓度藤黄酸对A549细胞P53、Bcl-2、Bax、PUMA表达水平的影响
与空白对照组比较:1)P<0.05;与2.5 μmol/L组比较:2)P<0.05;与5.0 μmol/L组比较:3)P<0.05
3 讨 论
最新流行病学调查显示〔7〕,I期患者约占NSCLC总数的24%,Ⅱ期约占NSCLC总数的11%,而Ⅲ期患者约占NSCLC总数的24%,Ⅳ期的患者约占NSCLC总数的41%。以上数据表明,NSCLC以Ⅲ期和Ⅳ期(即中晚期)为主,而Ⅲ期、Ⅳ期NSCLC患者的5年生存率较低〔1,2〕,由此可见NSCLC的临床治疗仍面临严峻的挑战。以铂类为基础的一线化疗方案的临床疗效已进入平台期,因而迫切需要开发针对NSCLC的新治疗模式及新型药物。与化学合成药物相比,从天然药用植物分离获得抗肿瘤药物具有研发周期短、研发费用较低、毒副作用较小、作用机制广泛等优势。中医认为肺癌最初起于痰浊之邪,痰浊壅肺,肺失宣发肃降,给予清热解毒、活血化瘀类中药可获益〔8,9〕。藤黄酸是中药藤黄的主要活性成分,藤黄是植物藤黄分泌的干燥树脂,性寒味酸、辛、涩,可有效抑制多种肿瘤细胞增殖〔10,11〕。另有研究表明〔12,13〕,有效浓度的藤黄酸不会明显抑制正常造血,是一种具有良好前景的抗肿瘤活性药物成分,但其对NSCLC A549细胞凋亡的影响及机制都尚未阐明,还需进一步研究。
本研究显示,藤黄酸可促进A549细胞凋亡,抑制NSCLC A549细胞增殖,且存在剂量、时间关系。藤黄酸可活化P53蛋白及其下游靶基因Bax、PUMA表达。Bax和PUMA基因均为粗凋亡基因,同时抑制抗凋亡基因Bcl-2基因活化,从而起到促A549细胞凋亡,抗A549细胞增殖的作用。既往研究显示〔14,15〕,中药活性成分抗肿瘤主要通过上调细胞内反应性氧自由基(ROS)含量引起DNA损伤、线粒体通透性改变及粗凋亡内容物释放而实现。而ROS是稳定P53转录活性或表达上调的重要因素,可延长P53蛋白的半衰期、上调P53表达。P53作为转录因子可调控其下游靶基因的表达,Bax、PUMA等促凋亡基因可在P53诱导下表达上调,而抗凋亡基因Bcl-2表达下调,藤黄酸对A549的凋亡作用与其可诱导P53表达有关〔16〕。
综上所述,藤黄酸可能通过增加反应性ROS含量使P53表达水平上调,而P53表达上调可诱导其下游促凋亡基因Bax和PUMA表达上调,抗凋亡基因Bcl-2表达下调,从而促进A549细胞凋亡和抑制A549细胞增殖,其促进A549细胞凋亡存在剂量与疗效的关系,抑制A549细胞凋亡存在剂量、时间与疗效的关系。
1金静思,贺巾钊,周黎明,等.非小细胞肺癌分子靶向治疗药物的现状及进展〔J〕.中国肿瘤临床,2015;42(17):881-5.
2王 新,王 静.CTX+5-FU+DDP支气管动脉化疗栓塞对IIIa-IIIb期NSCLC恶性程度的影响〔J〕.海南医学院学报,2017;23(6):805-8.
3Xia G,Wang H,Song Z,etal.Gambogic acid sensitizes gemcitabine efficacy in pancreatic cancer by reducing the expression of ribonucleotide reductase subunit-M2 (RRM2)〔J〕.J Exp Clin Cancer Res,2017;36(1):107.
4黄 瑞,郭 盼,刘勃缨,等.藤黄酸纳米结构脂质载体的制备及抗肿瘤作用初步评价〔J〕.天津中医药,2017;34(1):62-5.
5Matsumoto M,Nakajima W,Seike M,etal.Cisplatin-induced apoptosis in non-small-cell lung cancer cells is dependent on Bax-and Bak-induction pathway and synergistically activated by BH3-mimetic ABT-263 in p53 wild-type and mutant cells〔J〕.Biochem Biophys Res Commun,2016;473(2):490-6.
6Kubo N,Noda SE,Takahashi A,etal.Radiosensitizing effect of carboplatin and paclitaxel to carbon-ion beam irradiation in the non-small-cell lung cancer cell line H460〔J〕.J Radiat Res,2015;56(2):229-38.
7Arrieta O,Cardona AF,Martín C,etal.Updated frequency of EGFR and KRAS mutations in nonsmall-cell lung cancer in Latin America:The Latin-American Consortium for the investigation of lung cancer (CLICaP)〔J〕.J Thorac Oncol,2015;10(5):838-43.
8税永平.中央型小细胞肺癌CT征象分布与中医辨证分型规律的关系研究〔J〕.四川中医,2016;34(5):73-5.
9范春雷,李泽庚,童佳兵,等.肺癌中医证型与现代医学分期关系研究进展〔J〕.中国中医药信息杂志,2016;23(5):134-6.
10Pan H,Jansson KH,Beshiri ML,etal.Gambogic acid inhibits thioredoxin activity and induces ROS-mediated cell death in castration-resistant prostate cancer〔J〕.Oncotarget,2017;8(44):77181-94.
11张文典,徐祖敏,余忠华,等.藤黄酸的抗肿瘤机制〔J〕.国际肿瘤学杂志,2016;43(4):293-5.
12吴培云,李国转,姚 亮,等.藤黄酸B聚乙二醇单甲醚化脂质体的制备及大鼠体内药动学的研究〔J〕.中草药,2017;48(8):1553-60.
13祝 婕,王 萌,朱 彦,等.藤黄酸的心脏毒性及其基于细胞表型的多指标量化表征〔J〕.中国药理学与毒理学杂志,2017;31(1):73-9.
14黄 娟,曾祥龙,张乾勇,等.白藜芦醇通过上调脂肪变性HepG2细胞Sirt3表达改善线粒体功能〔J〕.第三军医大学学报,2017;39(6):536-40.
15张曼丽,王慧慈,柳金金,等.戊地昔布通过上调ROS诱导人乳腺癌MCF-7细胞凋亡〔J〕.基础医学与临床,2015;35(4):491-5.
16Foggetti G,Ottaggio L,Russo D,etal.Gambogic acid counteracts mutant p53 stability by inducing autophagy〔J〕.Biochim Biophys Acta,2017;1864(2):382-92.
