促血管生成microRNA在冠状动脉疾病诊断中的作用及其与疾病严重程度的关系
2018-03-20郭观华黄自明陈丽萍
郭观华,黄自明,陈丽萍
(湛江中心人民医院心内二科,广东 湛江 524037)
冠状动脉疾病 (coronary artery disease,CAD)是一种常见的心血管疾病 (cardiovascular disease,CVD) ,是造成全球死亡率上升的主要原因之一[1]。心脏核磁共振、单光子发射计算机断层显像和血管造影常用于CAD的诊断,准确率较高,但不稳定的图像质量和有创的检查方式限制了其临床应用,因此寻找一种创伤更小、准确率更高的检查手段已成为临床关注的重点[2]。
mircoRNA (miRNA) 是一类长度为19~25个核苷酸的短链非编码RNA,能够通过启动RNA的降解抑制RNA的转录,在转录后水平调节靶基因的表达[3]。研究[4]表明,miRNA在CAD的病理过程中发挥着重要作用,如miR-206能够通过调控血管内皮生长因子的表达延缓CAD的进展。血管生成在CAD的发病机制中有重要作用,某些miRNA具有调控血管生成的功能,然而,这些血管生成相关miRNA在CAD中的作用尚不明确。因此,本研究从以往的研究中筛选出20个与血管生成有关的miRNA,探讨了这些miRNA在CAD诊断中的作用及其与CAD疾病严重程度的关系。
1 材料与方法
1.1 研究对象
本研究分为探索阶段和验证阶段。探索阶段旨在从小样本中初步筛选CAD患者中的血管生成相关差异表达miRNAs (differently expressed microRNA,DEMs) ,验证阶段旨在从较大的样本中检验血管生成相关DEMs在CAD患者与HCs中的表达差异及其与CAD发病风险和疾病严重程度的关系。
在探索阶段,选取2015年4月至7月于湛江中心人民医院经血管造影确诊为CAD的患者10例,排除心脏射血分数受损、心衰、不稳定CAD或急性心肌损伤的患者。同时选取10例无CAD证据的健康受试者作为健康对照 (health control,HCs)。排除标准:有白血球减少症病史;血小板减少症;严重感染;CVD;有脑血管疾病或恶性病史;肝功能或肾功能衰竭。
在验证阶段,选取2015年4月至2016年9月入院的142例CAD患者及140例HCs,入组及排除标准同探索阶段。本研究经湛江中心人民医院伦理委员会批准并获得所有受试者知情同意。
1.2 CAD患者基本信息
采用Gensini评分系统评估CAD患者疾病严重程度。包括计算血管腔的狭窄程度以及心脏病变和斑块的X线表现。每处病变的积分为狭窄程度评分乘以病变部位评分。管腔狭窄程度分为25%,50%,75%,90%,99%和全闭,对应分数为1,2,4,8,16和32分。病变部位评分为:左主干病变,5分;左前降支病变,2.5分;左回旋支病变,2.5分;左前降支中段病变,1.5分;右主干病变、左前降支远端病变、后外侧动脉病变以及钝缘支动脉病变,1分;其他动脉病变,0.5分。
1.3 样本采集与处理
采集CAD患者及HCs外周血样本,并置于EDTA-3k管中保存。室温放置2 h后,4 ℃下3 000 r/min离心10 min,提取血浆,4 ℃下12 000 r/min离心15 min。于-80 ℃冻存。
1.4 实时荧光定量PCR
采用TRIzol LS Reagent试剂盒 (美国Ambion公司) 抽提总RNA。采用PrimerScript Real-time试剂盒(日本TaKaRa公司) 进行逆转录,并采用SYBR Premix Ex TaqTMⅡ (日本TaKaRa公司) 染料法测定备选RNA的相对表达量。以U6作为内参基因,最后结果通过方程2-ΔΔCt计算。
1.5 统计学分析
采用SPSS 21.0软件进行统计学分析。计数资料用频数 (百分位数) 表示,计量资料用±s或中位值(25分位值~75分位值) 表示。2组间差异比较采用t检验或Mann-Whitney检验。采用Spearman相关分析DEMs表达水平与Gensini评分的关系。采用单元及多元逻辑回归分析CAD的风险因素。制作受试者工作特征 (receiver operating characteristic,ROC) 曲线对备选miRNA对于CAD的诊断价值进行分析。P <0.05为差异有统计学意义。
2 结果
2.1 探索阶段DEMs
如表1所示,探索阶段CAD患者及HCs的平均年龄、男女比例、体质量指数均无统计学差异,具有可比性。
如表2所示,探索阶段CAD患者miR-19a、miR-92a、miR-126、miR-130a、miR-210、miR-221、miR-296和miR-378的表达水平均显著低于HCs,差异有统计学意义 (P < 0.05) 。探索阶段DEMs均被纳入验证阶段进行分析。
2.2 验证阶段DEMs
如表3所示,验证阶段CAD患者与HCs平均年龄、男女比例、体质量指数等一般信息无统计学差异。
如图2所示,验证阶段CAD患者miR-126、miR-130a、miR-210和miR-378的表达量显著低于HCs (均P < 0.05) 。然而,2组间miR-19a (P = 0.170) 、miR-92a(P = 0.108) 、miR-221 (P = 0.108) 和miR-296 (P =0.966) 的相对表达量并无统计学差异。

表1 探索阶段CAD患者与HCs一般资料Tab.1 Characteristics of CAD patients and healthy controls in exploration stage

表2 探索阶段20个血管生成相关miRNAs在CAD患者和HCs中的表达量Tab.2 Expression of 20 angiogenic miRNAs in CAD patients and HCs in exploration stage
表3 验证阶段CAD患者与HCs一般资料Tab.3 Characteristics of CAD patients and HCs in validation stage
2.3 DEMs与CAD患病风险
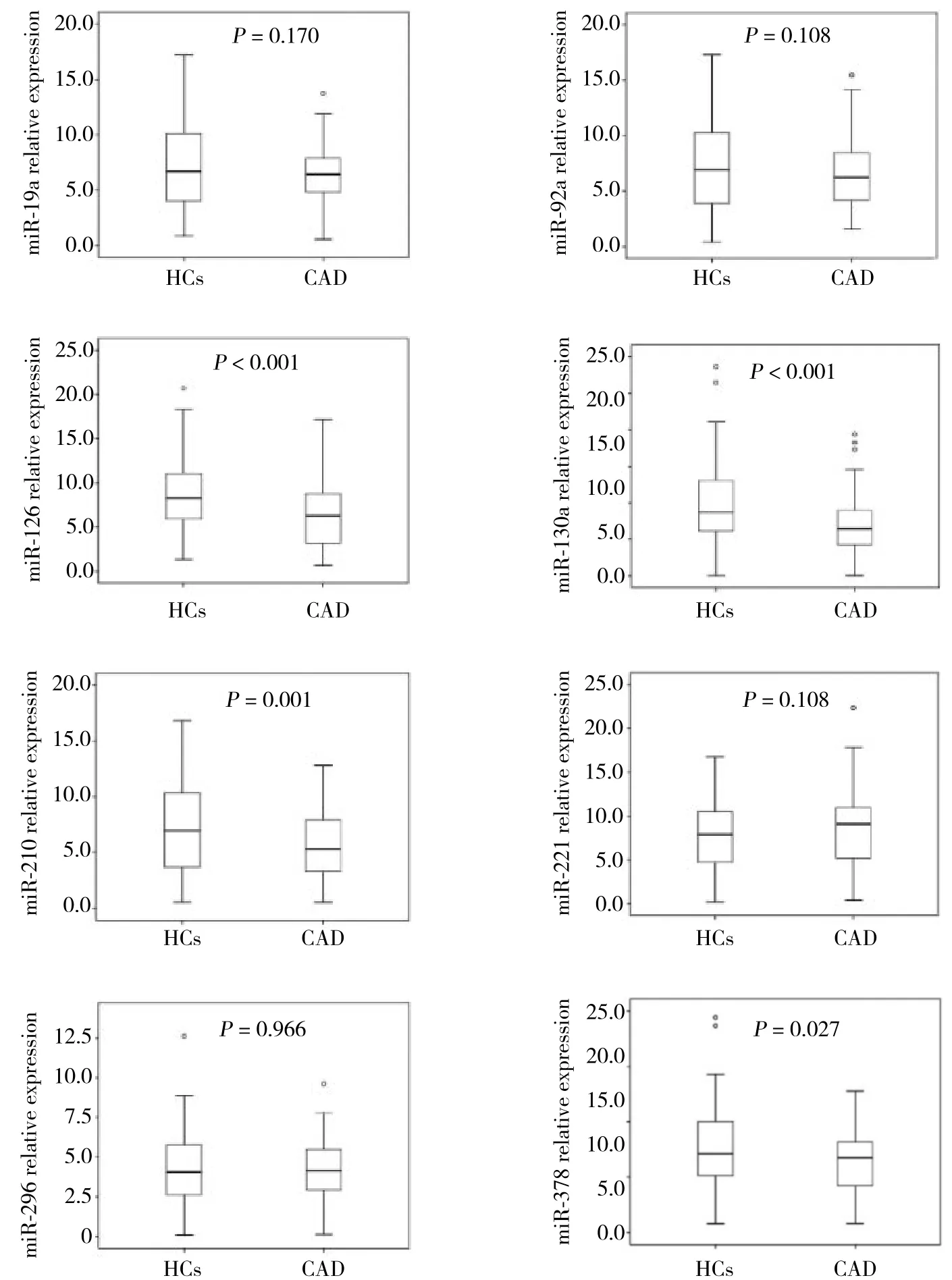
图2 验证阶段DEMs在CAD患者与HCs中的相对表达量Fig.2 Relative expression of differentrally expressed microRNAs in CAD patients and HCs in validation stage
如表4所示,进一步采用单元、多元逻辑回归模型评估DEMs对于CAD患病风险的预测价值,单元逻辑回归结果显示,高表达水平的miR-19a (P =0.012)、miR-126 (P < 0.001) 、miR-130a (P < 0.001) 、miR-210 (P < 0.001) 和miR-378 (P = 0.008) 是CAD的保护因素。将所有P < 0.1的元素纳入多元逻辑回归,结果表明,miR-19a (P = 0.009) 、miR-126 (P <0.001) 、miR-130a (P < 0.001) 、miR-210 (P < 0.001)和miR-378 (P = 0.014) 高表达是CAD患病的独立保护因素。
2.4 DEMs对于CAD的诊断价值
ROC曲 线 分 析 表 明,miR-19a、miR-126、miR-130a、miR-210和miR-378的表达水平可以区分CAD患者与健康人群,曲线下面积 (area under curve,AUC) 分别为0.574、0.654、0.656、0.611和0.576。而进一步将5个DEMs结合分析显示,结合miR-19a、miR-126、miR-130a、miR-210和miR-378检 测 对 于CAD具有较好的诊断价值,AUC为0.768,见图3。
2.5 DEMs与Gensini评分的关联
miR-126 (r = -0.299,P < 0.001) 和miR-210 (r =-0.169,P = 0.045) 的表达水平与Gensini评分呈负相关,而miR-19a (r = -0.038,P < 0.001) 、miR-92a (r =-0.068,P = 0.422) 、miR-130a( r = -0.034,P = 0.692) 、miR-221 ( r = -0.058,P = 0.495) 、miR-296 ( r = -0.054,P= 0.520) 和miR-378 ( r = -0.064,P = 0.447) 的表达水平与Gensini评分无关。

表4 验证阶段8种DEMs对于CAD风险预测单元多元逻辑回归分析Tab.4 Univariate and multivariate logistic regression of 8 DEMs for evaluating the risk of CAD in the validation stage
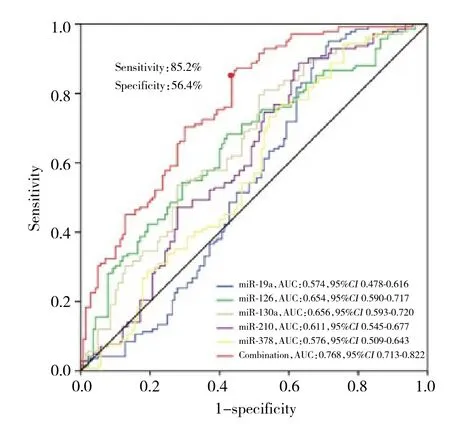
图3 DEMs预测CAD风险的ROC曲线Fig.3 ROC curves of differentially expressed microRNAs for predicting the risk of CAD
3 讨论
缺血性心脏病常表现为稳定期的CAD,因此CAD患者是心脏病急性发作的高危人群。另外,CAD患者发生中风的风险同样高于正常人[4-5]。尽管经皮冠状动脉干预治疗 (percutaneous coronary intervention,PCI) 和冠状动脉旁路移植 (coronary artery bypass grafting,CABG) 是临床上治疗CAD的有效的心脏动脉重建术,但一些研究[6-8]显示,CABG和PCI对于改善患者生存期的作用有限,费用相对昂贵,限制了其在临床中的使用。早期对CAD患者进行临床干预可以显著延长患者的生存期,因此,早期诊断在CAD患者的管理中发挥着重要作用。近期的研究[9]表明,miRNA在心血管疾病中同样发挥着重要作用,如miR-21可以通过激活纤维母细胞中MAP激酶的信号通路促进心肌病的进展。也有研究[10]表明,miR-148a通过直接调节低密度脂蛋白受体 (low density lipoprotein receptor,LDLR) 的表达,在肝脏LDL-C清除中起关键的调控作用,而LDL-C/HDL-C比率是心血管疾病的重要风险因素。
本研究中,在探索阶段,CAD患者miR-19a、miR-92a、miR-126、miR-130a、miR-210、miR-221、miR-296和miR-378的表达水平显著升高;而在验证阶段,只有miR-126、miR-130a、miR-210和miR-378在CAD患者中的表达水平显著高于HCs。本研究还发现,miR-19a、 miR-126、 miR-130a、 miR-210和miR-378的 表 达水平是CAD发病风险的独立预测因素;miR-19a、miR-126、miR-130a、miR-210和miR-378结 合 分 析 对于CAD的患病风险具有较高的预测价值;miR-126和miR-210的表达水平与CAD的疾病严重程度呈负相关。
近年来,研究[11]发现一些miRNA在心血管系统疾病中发挥促血管生成或抑制血管生成的作用,参与CVD的病理进展。miR-126是与血管生成有关的miRNA之一,位于染色体9q34.3,并在内皮细胞中高表达[12]。有研究[13]表明,miR-126-5p过表达增加了具有促血管生成作用的内皮细胞活动,下调miR-126-5p的表达水平能抑制内皮细胞功能,调节miR-125-5p的表达水平有助于调控内皮细胞中粗血管生成骨形成蛋白4效应。CHEN等[14]也发现,miR-126可以通过靶向调控PI3K/Akt信号抑制内皮细胞的凋亡。研究[15]表明,在血管受损和缺氧时,上调miR-126的表达水平可以激活内皮祖细胞和内皮细胞,并通过此机制促进血管修复和新血管的生成,显示了miR-126在心血管疾病中的血管保护和动脉粥样硬化保护作用。
GAX和HOXA5是具有抑制血管生成作用的同源盒基因,而另一个与血管生成相关的miRNA——miR-130a具有抑制二者的表达从而达到调控内皮细胞表型的作用[16]。一项关于胎肺气道与血管发展的动物实验[17]显示,进行miR-130a治疗可以促进血管管道的形成以及细胞的迁徙。miR-210是一个具有促血管生成功能的miRNA,可以通过靶向调控纤维母细胞生长因子受体1促进患者肿瘤血管生成[18]。miR-210还可以抑制细胞凋亡,促进血管生成,从而改善心肌梗死小鼠的心脏功能[19]。
miR-378同样在血管生成中具有重要作用,SKRZYPEK等[20]报道,miR-378过表达可以降低血红素氧合酶1和p53的表达水平,上调黏蛋白5AC、血管内皮细胞生长因子、白细胞介素8和血管紧张素1的表达水平,从而促进内皮细胞的增殖、迁徙,刺激内皮细胞。在其他心血管疾病中,miR-378同样被发现具有重要作用,有研究[21]报道,电刺激心脏干细胞可以调节miR-378的表达水平,并改善心脏缺血。
miR-19a位于染色体13q31.3,隶属于miR-17-92基因簇,其过表达可通过调控凋亡信号调节蛋白激酶1/p38,从而减少脂多糖引起的内皮细胞凋亡[22]。另外,miR-19a在cyclinD1的表达调控中起重要作用,并通过调控cyclinD1影响内皮细胞的基因表达[23]。在某些心血管疾病中,miR-19a可以保护心肌受损,如对PCI引起的心肌梗死,它还可以抑制Bcl-2调节因子,从而减少低氧引起的细胞死亡,对心肌细胞起到保护作用[24]。
本研究验证阶段结果显示,miR-19a、miR-126、miR-130a、miR-210和miR-378在CAD患者中的表达水平显著高于HCs,并且miR-126和miR-210的表达水平与CAD的疾病严重程度呈负相关,其机制可能与这些差异表达的促血管生成miRNA对血管生成的正向调控作用及对心肌的保护作用有关[12-27]。
以往关于miRNA对于CVD以及CAD的诊断作用的研究[25-27]揭示了miRNA作为诊断标志物的可能性,miR-126、miR-143、miR-145、miR-223等均被发现在CVD的发病机制中发挥着重要作用,并可以作为CVD诊断和预后的标志物。本研究发现结合分析miR-126、 miR-130a、 miR-210和miR-378对于 CAD的发病风险具有较好的诊断作用,这可能与miR-126、miR-130a、miR-210和miR-378对血管生成及心肌缺血的调控作用有关,该结果或许可以为改善CAD患者的临床诊断和预后提供新的选择[12-27]。
本研究尚有不足之处: (1) 本研究中的CAD患者及HCs的年龄均较大,为老年患者及年龄相近的健康对照,因此未能测定及评估中年CAD患者及健康人的血管生成miRNA的表达水平及其与发病风险及疾病严重程度的相关性; (2) 本研究未测定CAD患者组织中的备选miRNA表达水平,并与循环血中的表达水平进行对比,然而获取CAD患者的组织标本较为困难; (3) 本研究的样本量相对较小。
综上所述,miR-19a、 miR-126、 miR-130a、 miR-210和miR-378可以作为预测CAD发病风险和疾病严重程度的生物标志物。
[1] LOZANO R,NAGHAVI M,FOREMAN K,et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[ J]. Lancet,2012,380( 9859) :2095-2128. DOI:10.1016/S0140-6736( 12) 61728-0.
[2] INVESTIGATORS SH. CT coronary angiography in patients with suspected angina due to coronary heart disease ( SCOT-HEART) :an open-label,parallel-group,multicentre trial[ J]. Lancet,2015,385(9985) :2383-2391. DOI:10.1016/S0140-6736( 15) 60291-4.
[3] HOBERT O. Gene regulation by transcription factors and microRNAs[J]. Science,2008,319( 5871) :1785-1786. DOI:10.1126/science.1151651.
[4] WANG M,JI Y,CAI S,et al. MiR-206 suppresses the progression of coronary artery disease by modulating vascular endothelial growth factor ( VEGF) expression[ J]. Med Sci Monit,2016,22:5011-5020.
[5] VRANCKX P,KALESAN B,STEFANINI GG,et al. Clinical outcome of patients with stable ischaemic heart disease as compared to those with acute coronary syndromes after percutaneous coronary intervention[ J]. Euro Intervention,2015,11( 2) :171-179. DOI:10.4244/EIJV11I2A31.
[6] OTSUKA M,ZHENG M,HAYASHI M,et al. Impaired microRNA processing causes corpus luteum insufficiency and infertility in mice[J]. J Clin Invest,2008,118( 5) :1944-1954. DOI:10.1172/JCI33680.
[7] PFISTERER ME,ZELLWEGER MJ,GERSH BJ. Management of stable coronary artery disease[ J]. Lancet,2010,375( 9716) :763-772.DOI:10.1016/S0140-6736( 10) 60168-7.
[8] SIMOONS ML,WINDECKER S. Controversies in cardiovascular medicine:chronic stable coronary artery disease:drugs vs. revascularization[ J]. Eur Heart J,2010,31( 5) :530-541. DOI:10.1093/eurheartj/ehp605.
[9] OPIE LH,COMMERFORD PJ,GERSH BJ. Controversies in stable coronary artery disease[ J]. Lancet,2006,367( 9504) :69-78. DOI:10.1016/S0140-6736( 06) 67927-0.
[10] THUM T,GROSS C,FIEDLER J,et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[ J]. Nature,2008,456( 7224) :980-984. DOI:10.1038/nature07511.
[11] GOEDEKE L,ROTLLAN N,CANFRAN-DUQUE A,et al. MicroRNA-148a regulates LDL receptor and ABCA1 expression to control circulating lipoprotein levels[ J]. Nat Med,2015,21( 11) :1280-1289. DOI:10.1038/nm.3949.
[12] WU F,YANG Z,LI G. Role of specific microRNAs for endothelial function and angiogenesis[ J]. Biochem Biophys Res Commun,2009,386( 4) :549-553. DOI:10.1016/j.bbrc.2009.06.075.
[13] PARKER LH,SCHMIDT M,JIN SW,et al. The endothelial-cell-derived secreted factor Egfl7 regulates vascular tube formation[ J].Nature,2004,428( 6984) :754-758. DOI:10.1038/nature02416.
[14] ESSER JS,SARETZKI E,PANKRATZ F,et al. Bone morphogenetic protein 4 regulates microRNAs miR-494 and miR-126-5p in control of endothelial cell function in angiogenesis[ J]. Thromb Haemost,2017,117( 4) :734-749. DOI:10.1160/TH16-08-0643.
[15] CHEN L,WANG J,WANG B,et al. MiR-126 inhibits vascular endothelial cell apoptosis through targeting PI3K/Akt signaling[ J].Ann Hematol,2016,95( 3) :365-374. DOI:10.1007/s00277-015-2567-9.
[16] CHISTIAKOV DA,OREKHOV AN,BOBRYSHEV YV. The role of miR-126 in embryonic angiogenesis,adult vascular homeostasis,and vascular repair and its alterations in atherosclerotic disease[ J]. J Mol Cell Cardiol,2016,97:47-55. DOI:10.1016/j.yjmcc.2016.05.007.
[17] CHEN Y,GORSKI DH. Regulation of angiogenesis through a microRNA ( miR-130a) that down-regulates antiangiogenic homeobox genes GAX and HOXA5[ J]. Blood,2008,111( 3) :1217-1226.DOI:10.1182/blood-2007-07-104133.
[18] WANG N,CHEN C,YANG D,et al. Mesenchymal stem cells-derived extracellular vesicles,via miR-210,improve infarcted cardiac function by promotion of angiogenesis[ J]. Biochim Biophys Acta,2017,1863( 8) :2085-2092. DOI:10.1016/j.bbadis.2017.02.023.
[19] MUJAHID S,NIELSEN HC,VOLPE MV. MiR-221 and miR-130a regulate lung airway and vascular development[ J]. PLoS One,2013,8( 2) :e55911. DOI:10.1371/journal.pone.0055911.
[20] YANG Y,ZHANG J,XIA T,et al. MicroRNA-210 promotes cancer angiogenesis by targeting fibroblast growth factor receptor-like 1 in hepatocellular carcinoma[ J]. Oncol Rep,2016,36( 5) :2553-2562.DOI:10.3892/or.2016.5129.
[21] SKRZYPEK K,TERTIL M,GOLDA S,et al. Interplay between heme oxygenase-1 and miR-378 affects non-small cell lung carcinoma growth,vascularization,and metastasis[ J]. Antioxid Redox Signal,2013,19( 7) :644-660. DOI:10.1089/ars.2013.5184.
[22] CAVARRETTA E,FRATI G. MicroRNAs in coronary heart disease:ready to enter the clinical arena?[ J]. Biomed Res Int,2016,2016( 2) :1-10. DOI:10.1155/2016/2150763.
[23] JIANG WL,ZHANG YF,XIA QQ,et al. MicroRNA-19a regulates lipopolysaccharide-induced endothelial cell apoptosis through modulation of apoptosis signal-regulating kinase 1 expression[ J]. BMC Mol Biol,2015,16:11. DOI:10.1186/s12867-015-0034-8.
[24] QIN X,WANG X,WANG Y,et al. MicroRNA-19a mediates the suppressive effect of laminar flow on cyclin D1 expression in human umbilical vein endothelial cells[ J]. Proc Natl Acad Sci USA,2010,107( 7) :3240-3244. DOI:10.1073/pnas.0914882107.
[25] KIM SW,KIM HW,HUANG W,et al. Cardiac stem cells with electrical stimulation improve ischaemic heart function through regulation of connective tissue growth factor and miR-378[ J]. Cardiovasc Res,2013,100( 2) :241-251. DOI:10.1093/cvr/cvt192.
[26] RONG X,JIA L,HONG L,et al. Serum miR-92a-3p as a new potential biomarker for diagnosis of kawasaki disease with coronary artery lesions[ J]. J Cardiovasc Transl Res,2017,10( 1) :1-8. DOI:10.1007/s12265-016-9717-x.
[27] MASSY ZA,METZINGER-LE MEUTH V,METZINGER L. MicroRNAs are associated with uremic toxicity,cardiovascular calcification,and disease[ J]. Contrib Nephrol,2017,189:160-168. DOI:10.1159/000450774.
