过氧化钠与二氧化碳反应的实验探究
2018-03-19段霞霞
段霞霞
1实验探究目的
人教版高中化学《金属的化学性质》一节中讲到过氧化钠与二氧化碳反应,生成碳酸钠和氧气,对于过氧化钠与二氧化碳反应,教材中只给出了相应的化学方程式及其应用,但没有设计相关的探究实验,不利于学生对本知识点的理解和突破,学生也不易理解过氧化钠可用于呼吸面具或潜水艇中作为氧气来源的这一用途。为了激发学生的探究意识,打破传统的教学思维,笔者经过多次实验探究实验,对该化学反应进行了创新设计。
2实验仪器及试剂
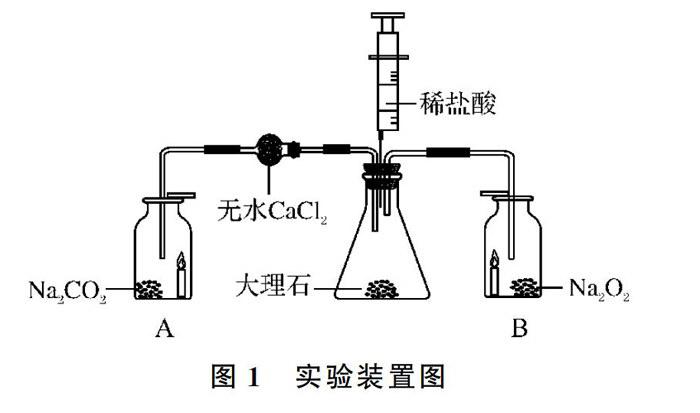
仪器:锥形瓶1个、集气瓶2个、10mL医用注射器1个、球形干燥管1个、双孔橡皮塞1个、药匙、小蜡烛等。
试剂:稀盐酸(体积比为1:2)、大理石、过氧化钠粉末、无水CaCl2等。
3实验装置
实验装置图如图1所示。
4实验操作及现象
(1)先往锥形瓶中加入8.0g左右的块状大理石,并塞紧带有注射器(注射器内先吸取10mL稀盐酸)和导气管的双孔橡胶塞。然后在集气瓶A和B中分别加入约0.2g的Na2O2粉末,并各放一段燃着的小蜡烛(取2支生日小蜡烛放置如图1所示的位置即可),最后在集气瓶口盖上玻璃片。
(2)缓慢推动注射器活塞使稀盐酸和锥形瓶底部的大理石发生反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),认真观察A、B集气瓶中的实验现象。
实验现象:反应进行一段时间后,在集气瓶A中观察到小蜡烛逐渐熄灭,说明没有助燃气体O2产生,同时在集气瓶B中观察到小蜡烛比之前燃烧得更旺,说明有助燃气体O2产生。
5实验探究结论
实验探究结果证明:过氧化钠与二氧化碳在干燥环境中不易发生化学反应,在潮湿环境中过氧化钠易与二氧化碳发生反应,而在整个实验过程中水只起到了催化剂的作用,若从氧化还原的角度来分析过氧化鈉与二氧化碳的反应可知,氧化产物为O2,还原产物为H2O,Na2O2在反应过程中既作氧化剂又作还原剂。
6实验探究意义
(1)通过该实验探究,证明了过氧化钠与二氧化碳在干燥环境中不易发生化学反应这一事实,同时也增强了该实验的创新性。
(2)用生日小蜡烛做探究实验,既有利于学生观察,也增强了实验的趣味性。
(3)该实验设计科学严谨,可操作性强,现象明显。