沐舒坦预处理对大鼠急性肺损伤的肺保护作用研究
2014-09-12徐忠能薛涛
徐忠能,薛涛
(东南大学附属中大医院 胸外科,江苏 南京 210009)
临床上误吸为最常见的直接肺损伤原因之一,而一旦胃内容物误吸并发展为急性肺损伤(ALI/ARDS)死亡率高达40%~60%[1- 2],因此,如何进行肺保护一直是临床研究的重要课题。沐舒坦(Ambroxol)是一种具有多种生物学活性的黏液溶解剂。Park[3]、Pfeifer[4]、Gillissen[5]等研究发现,大剂量沐舒坦可以通过抗炎、抗氧化及促进肺泡表面活性物质生成等方式起到肺保护作用。近些年国内相关临床研究[6]也证实,大剂量沐舒坦具有一定的肺保护作用。然而关于沐舒坦的剂量选择上仍未形成统一标准。本研究拟通过观察不同剂量的沐舒坦预处理对盐酸吸入致大鼠急性肺损伤模型的肺保护作用,为临床沐舒坦应用剂量选择提供一定的理论及实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 健康清洁级成年雄性SD大鼠(上海西普尔-必凯实验动物有限公司)40只,体重170~220 g。
1.1.2 试剂 沐舒坦由上海勃林格殷格翰药业有限公司提供,TNF- α、IL- 10试剂盒由南京凯基生物科技发展有限公司提供。
1.2 方法
1.2.1 动物模型制备 将40只健康清洁成年的SD大鼠随机分成5组,每组8只:生理盐水组(吸入生理盐水)、稀盐酸组(吸入稀盐酸)、稀盐酸吸入+沐舒坦低剂量处理组[吸入稀盐酸+沐舒坦(10 mg·kg-1·d-1)、稀盐酸吸入+沐舒坦中剂量处理组[吸入稀盐酸+沐舒坦(20 mg·kg-1·d-1)]、稀盐酸吸入+沐舒坦高剂量处理组[吸入稀盐酸+沐舒坦(40 mg·kg-1·d-1)]。稀盐酸吸入+沐舒坦低、中、高剂量组分别予相应剂量沐舒坦尾静脉注射,生理盐水及稀盐酸两组予等体积的生理盐水行尾静脉注射,每天1次,连续3 d,期间大鼠自由接触食物和水。第3天尾静脉注射沐舒坦或生理盐水30 min后各组大鼠再腹腔注射10%水合氯醛3 ml·kg-1麻醉,待肢痛反射消失后参照Nader等[7]的方法并略作改进制作盐酸吸入性肺损伤模型。将大鼠固定于操作台,呈头高位60°,颈部备皮消毒,沿颈部中线剪开皮肤,分离各层组织至暴露气管。用1 ml注射器针头经暴露的环甲膜处插入,生理盐水组大鼠气管内注射生理盐水(1.2 ml·kg-1),稀盐酸组,稀盐酸+沐舒坦低、中、高剂量处理组大鼠气管内滴注稀盐酸(1.2 ml·kg-1,pH=1.2)。注完药物后仍保持此体位3 min,拔出注射器,用1号丝线逐层缝合伤口,局部消毒后将大鼠固定带松开置于观察箱中观察。让大鼠自主呼吸空气,并允许大鼠自由接触水和食物。
1.2.2 指标测定 生理盐水或稀盐酸吸入后观察6 h,期间无大鼠死亡。6 h后存活大鼠予10%水合氯醛3 ml·kg-1腹腔注射麻醉,待肢痛反射消失后将大鼠仰卧位固定于实验台上,快速开胸,于心尖处抽取动脉血,分成两份血标本,一份迅速行动脉血气分析,另一份低温下离心(3 000 r·min-1)10 min,吸取上清,-80 ℃保存,留待后期统一应用放射免疫方法测量血清中TNF- α、IL- 10含量。抽血后立即取出完整肺脏,右肺称湿重后置于80 ℃烘箱中,48 h后称干重,计算W/D。左肺置4%甲醛中固定,石蜡包埋,病理切片HE染色后行普通光学显微镜检查。
1.3 统计学处理
2 结 果
2.1 肺组织病理变化
2.1.1 大体观察 生理盐水组呈均匀的粉白色,表面光滑,无出血灶,弹性好;稀盐酸组呈暗红色,可见明显充血水肿及散在出血点;稀盐酸吸入+沐舒坦低、中、高剂量组也可见局部充血水肿和渗液,但较稀盐酸组损伤范围及损伤程度明显减轻,且随着沐舒坦剂量递增,肺损伤表现越轻。
2.1.2 光镜观察 生理盐水组肺组织结构完整,肺泡壁结构清晰,肺泡壁及间质内无水肿、炎症细胞浸润等特殊改变。稀盐酸组肺泡壁破坏严重,大量肺泡萎陷,肺泡、肺间质水肿明显,肺泡间隔增宽,组织中可见点状出血及炎症细胞浸润等改变。稀盐酸吸入+沐舒坦低剂量组肺泡及间质水肿较稀盐酸组有所减轻,仍可见部分肺泡萎陷、炎症细胞浸润及点状出血改变。稀盐酸吸入+沐舒坦中、高剂量两组病理改变较轻,组织稍疏松,毛细血管轻度扩张充血,间质轻度水肿。见图1~5。
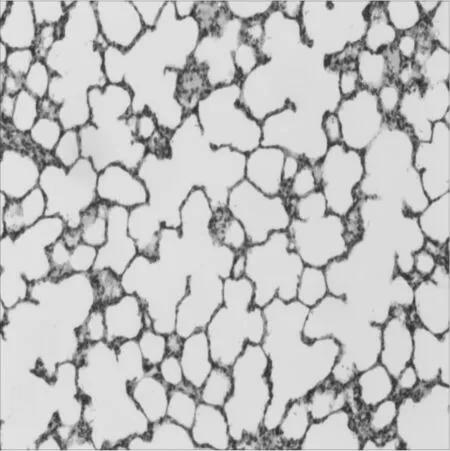
图1生理盐水组织病理变化HE×100

图2稀盐酸组肺组织病理变化HE×100
2.2 肺湿干重比(W/D)
W/D值生理盐水组最低,稀盐酸组最高,稀盐酸吸入+沐舒坦低、中、高剂量处理组介于生理盐水和稀盐酸组两组之间,且随着沐舒坦剂量递增,W/D值递减,稀盐酸吸入+沐舒坦中、高剂量处理组组间比较差异无统计学意义(P>0.05),余组间比较差异均有统计学意义(P<0.05)(表1)。

图3Hcl+沐舒坦低剂量处理组肺组织病理变化HE×100
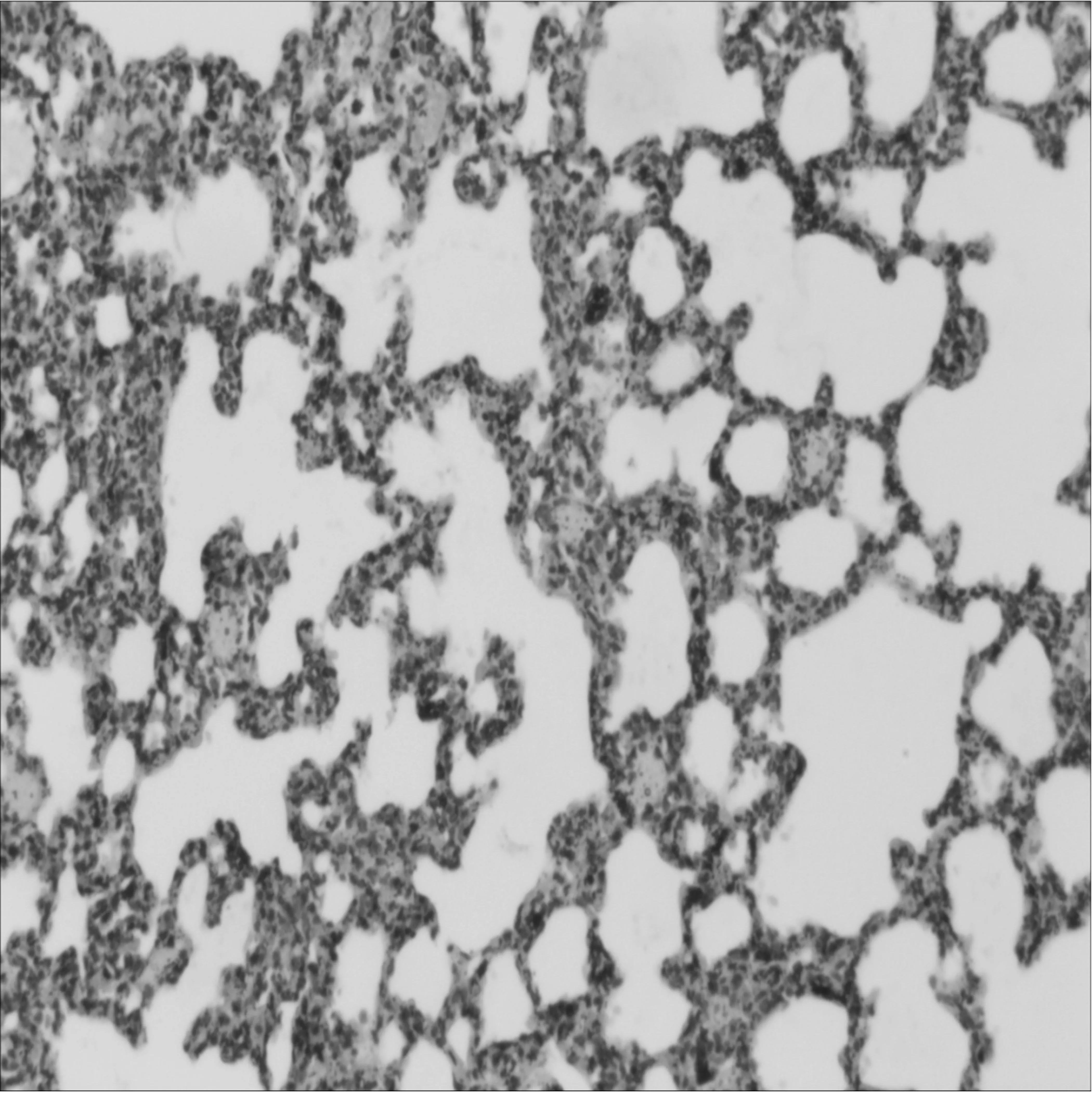
图4Hcl+沐舒坦中剂量处理组肺组织病理变化HE×100
图5Hcl+沐舒坦高剂量处理组肺组织病理变化HE×100
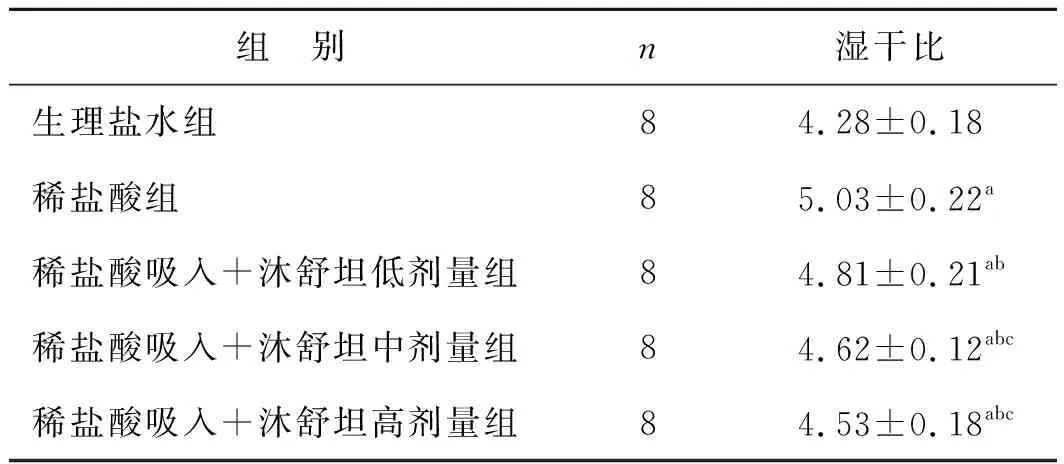
组 别n湿干比生理盐水组84.28±0.18稀盐酸组85.03±0.22a稀盐酸吸入+沐舒坦低剂量组84.81±0.21ab稀盐酸吸入+沐舒坦中剂量组84.62±0.12abc稀盐酸吸入+沐舒坦高剂量组84.53±0.18abc
与生理盐水组比较,aP<0.05;与稀盐酸组比较,bP<0.05;与稀盐酸吸入+沐舒坦低剂量组比较,cP<0.05
2.3 血气分析
生理盐水组pH值在正常范围,余4组pH皆低于7.35。稀盐酸组,稀盐酸吸入+沐舒坦低、中、高剂量与生理盐水组比较,差异有统计学意义(均P<0.05),稀盐酸组,稀盐酸吸入+沐舒坦低、中、高剂量4组之间比较,差异无统计学意义(均P>0.05)。PaO2值生理盐水组最高,稀盐酸组最低,稀盐酸吸入+沐舒坦低、中、高剂量组PaO2与沐舒坦剂量呈正相关,稀盐酸吸入+沐舒坦中、高剂量组之间比较无显著差异(P>0.05),余组间比较均有显著差异(均P<0.05)。稀盐酸组PaCO2最高,与生理盐水组,稀盐酸吸入+沐舒坦低、中、高剂量比较差异均有统计学意义(均P<0.05),生理盐水组,稀盐酸吸入+沐舒坦低、中、高剂量4组之间比较,差异无统计学意义(均P>0.05)。见表2。
2.4 血清TNF- α、IL- 10 测定结果
血清TNF- α水平稀盐酸组最高,生理盐水组最低,稀盐酸吸入+沐舒坦低、中、高剂量组血清中TNF- α含量与沐舒坦剂量呈负相关,稀盐酸吸入+沐舒坦中、高剂量组间比较差异无统计学意义(P>0.05),其余组间比较差异均有统计学意义(均P<0.05)。血清中IL- 10含量按生理盐水组、稀盐酸组、稀盐酸吸入+沐舒坦低、中、高剂量组顺序依次增高,稀盐酸吸入+沐舒坦中、高剂量组之间比较差异无统计学意义(P>0.05),其余组间比较差异均有统计学意义(P<0.05)。见表3。
3 讨 论
本实验采用盐酸吸入致大鼠急性肺损伤模型(按1.2 ml·kg-1吸入pH 1.2的稀盐酸)。与吸入生理盐水的对照组相比,吸入盐酸组的大鼠明显活力下降,呼吸急促,烦躁不安,紫绀;PaO2明显降低,PaCO2、肺W/D、促炎性因子TNF- α明显增高。光镜下病理切片示肺泡壁破坏严重,大量肺泡萎陷,肺泡、肺间质水肿明显,肺泡间隔增宽,组织中可见点状出血及炎症细胞浸润等改变。说明采用1.2 ml·kg-1,pH 1.2的稀盐酸吸入制作大鼠急性肺损伤模型成功。
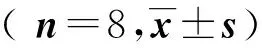

组 别 npHPaO2PaCO2生理盐水组87.36±0.0397.46±1.1634.35±1.73稀盐酸组87.17±0.04a59.04±5.32a42.75±5.81a稀盐酸吸入+沐舒坦低剂量组87.20±0.03a69.50±5.84ab38.38±3.12b稀盐酸吸入+沐舒坦中剂量组87.24±0.05a80.75±3.55abc36.81±2.25b稀盐酸吸入+沐舒坦高剂量组87.25±0.06a83.54±3.27abc35.35±3.51b
与生理盐水组比较,aP<0.05;与稀盐酸组比较,bP<0.05;与稀盐酸吸入+沐舒坦低剂量组比较,cP<0.05
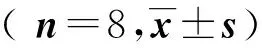

组 别 nTNF-α/pg·m-1IL-10/pg·m-1生理盐水组859.99±6.9212.38±0.93稀盐酸组8178.32±16.29a21.48±1.51a稀盐酸吸入+沐舒坦低剂量组8125.79±13.54ab29.15±1.14ab稀盐酸吸入+沐舒坦中剂量组887.50±8.34abc34.70±2.20abc稀盐酸吸入+沐舒坦高剂量组880.28±9.19abc35.63±2.31abc
与生理盐水组比较,aP<0.05,与稀盐酸组比较,bP<0.05;与稀盐酸吸入+沐舒坦低剂量组比较,cP<0.05
酸吸入性肺损伤的发生机制曾被认为主要是胃液内酸性物质和消化酶对肺组织的直接损伤。但近些年一些研究[8- 9]证实,局部损伤后的炎症反应在肺损伤的发生发展中扮有更重要的角色。主要表现为肺巨噬细胞、毛细血管内皮细胞等炎症细胞的激活,产生和释放大量炎症因子和生物介质,趋化大量中性粒细胞在肺脏聚集并被激活,产生活性氧自由基等,造成广泛的严重的炎性损伤。TNF- α是急性肺损伤过程中最早产生的炎性介质之一[10],其可激活损伤的中性粒细胞、内皮细胞进一步释放氧自由基、溶酶体酶等介质,诱导组织细胞损伤,引起急性肺损伤。本实验中,盐酸吸入后,大鼠血清中TNF- α含量明显升高(P<0.05),说明了炎症反应被启动。
沐舒坦是一种具有多种生物学效应的黏液溶解剂,但近年来许多实验证实,大剂量的沐舒坦具有一定的肺保护作用。主要表现在以下几个方面:(1) 抗炎、抗氧化作用。沐舒坦可降低血液中活性氧水平,通过活化的中性粒细胞,降低超氧负离子、HCLO的水平,以抑制A1AT的钝化,从而改善肺功能参数[11]。(2) 促进肺泡表面活性物质合成。(3) 松弛气道平滑肌。(4) 对气道壁离子转运和电位差的影响。IL- 10是一种重要的抑炎因子,在肺内主要由单核巨噬细胞等合成和分泌。本实验观察了10、20、40 mg·kg-13种剂量的沐舒坦对肺的保护作用,结果显示,沐舒坦治疗组血清IL- 10水平较稀盐酸组明显升高,TNF- α水平明显降低。而且血清IL- 10水平随沐舒坦剂量递增而增高,而TNF- α水平则降低。由此表明,3种不同剂量的沐舒坦都能明显减轻肺部炎性反应,促进抗炎反应,减轻肺泡及间质水肿和肺组织出血等病理改变。同时血气结果表明,沐舒坦还可明显改善低PaO2状况,降低PaCO2。但稀盐酸吸入+沐舒坦低、中、高剂量3组组间比较发现,稀盐酸吸入+沐舒坦低剂量与稀盐酸吸入+沐舒坦中、高剂量组之间TNF-α和IL- 10水平差异有统计学意义(P<0.05);稀盐酸吸入+沐舒坦中剂量组与稀盐酸吸入+沐舒坦高剂量组之间TNF- α和IL- 10水平差异无统计学意义(P>0.05)。表明在一定剂量范围之内,沐舒坦对急性肺损伤保护作用与剂量呈正相关,但超过一定范围时,这种正相关作用并不明显。
大剂量沐舒坦的肺保护作用在临床上已经引起广泛重视,但在应用剂量的选择上国内仍无统一标准[12]。目前国内研究主要集中于急性肺损伤、急性呼吸窘迫综合征和围手术期肺保护方面。本实验中仅采用酸吸入制作大鼠急性肺损伤模型来研究不同剂量沐舒坦的肺保护作用,由于实验中控制因素太多,所以实验结果并不能完全套用于临床实际工作中。关于沐舒坦肺保护作用与剂量的相关性仍需大量的动物实验及临床应用情况来继续探讨。
[1] MAYBAUER M O,MAYBAUER D M,HERNDON D N. Incidence and outcomes of acute lung injury[J].N Engl J Med,2006,354(4):416- 417.
[2] RAGHAVENDRAN K,NEMZEK J,NAPOLITANO L M,et al.Aspiration- induced lung injury[J].Crit Care Med,2011,39(4):818- 826.
[3] PARK N H,HAN E S,LEE C S.The inhibitory effect of ambroxol on respiratory burst,degranulation and cytosolic Ca2+change in degraded immunoglobulin G- activated neutrophils[J].Pharmacol Toxicol,1999,84(2):81- 87.
[4] PFEIFER S,ZISSEL G,KIENAST K,et al.Reduction of cytokine release of blood and bronchoalveolar mononuclear cells by ambroxol[J].Eur J Med Res,1997,2(3):129- 132.
[5] GILLISSEN A,NOWAK D.Characterization of N- acet-ylcysteine and ambroxol in anti- oxidant therapy[J].Respir Med,1998,92(4):609- 623.
[6] 夏文超,韩兴鹏,韩洪利,等.不同剂量沐舒坦对肺癌术后患者的肺保护效果探讨[J].重庆医学,2012,41(17):1759- 1760.
[7] NADER N D,KNIGHT P R,BOBEIA I,et al.High dose nitric oxide inhalation increases lung injury after gastric aspiration[J].Anesthesiology,1999,91(3):741- 749.
[8] KENNEDY T P,JOHNSON K J,KUNKEL R G,et al.Acute acid aspiration lung injury in the rat: biphasic pathogenesis[J].Anesth Analg,1989,69(1):87- 92.
[9] NADER-DJALAL N,KNIGHT P R 3rd,THUSU K,et al.Reactive oxygen species contribute to oxygen- related lung injury after acid aspiration[J].Anesth Analg,1998,87(1):127- 133.
[10] GOODMAN R B,PUGIN J,LEE J S,et al.Cytokine- mediated inflammation in acute lung injury[J].Cytokine Growth Factor Rev,2003,14(6):523- 535.
[11] FARKHUTDINOV U R, FARKHUTDINOV R R, PETRIAKOV V V, et al. Effect of mucolytic therapy on the production of reactive oxygen species in the blood of patients with an exacerbation of chronic obstructive pulmonary disease[J]. Ter Arkh,2010,82(3):29- 32.
[12] 董硕,张春芳.沐舒坦临床应用剂量规范化探讨[J].实用药物与临床,2012,15(5):301- 302.
