宫颈癌组织中组织因子途径抑制物-2表达变化及其与VEGF表达、微血管密度的相关性
2018-03-19李娜熊娇史明媚王露露付立仙
李娜,熊娇,史明媚,王露露,付立仙
(遵义医学院附属医院,贵州遵义 563000)
血管形成是恶性肿瘤生长、侵袭和转移的关键步骤,也是改善肿瘤预后的重要突破口[1]。组织因子途径抑制物2(TFPI-2),又名胎盘蛋白-5,是一种Kunitz型丝氨酸蛋白酶抑制物,广泛存在于人体组织和器官。TFPI-2能够抑制多种蛋白酶活性,如基质金属蛋白酶、纤溶酶等[2],在多种生理病理过程中发挥重要作用,如血管生成、肿瘤细胞的侵袭转移等。有研究证实,TFPI-2能够阻碍新生血管的形成,从而抑制人纤维肉瘤细胞的增殖、侵袭及远处转移[3]。但是TFPI-2在宫颈癌组织中的表达变化及其对宫颈癌血管新生的影响尚不清楚。微血管密度(MVD)是组织血管新生状况的直接反映。血管内皮生长因子(VEGF)是经典的促血管生长因子,能够促进细胞血管内皮增生,促进血管生成,并增加血管通透性[4]。本研究观察了宫颈癌组织TFPI-2表达变化,并分析宫颈癌组织TFPI-2表达与VEGF表达及MVD的相关性,探讨TFPI-2对宫颈癌组织血管新生的影响。现报告如下。
1 材料与方法
1.1 临床资料 选择2012年1月~2014年12月收治的80例宫颈癌患者的肿瘤组织标本为宫颈癌组。纳入标准:病理诊断为宫颈癌、具有完整的病例资料。排除标准:患者合并其他恶性肿瘤、全身感染性疾病、肝肾疾病等。患者年龄33~62岁,其中≤50岁37例、>50岁43例。有HPV感染者45例、无HPV感染者35例;病理分级G1者32例,G2者31例,G3者17例;有淋巴结转移59例、无淋巴结转移21例;按照2009年NCCN指南临床分期标准Ⅰ+Ⅱ期65例、ⅢⅢ+Ⅳ期15例。另收集50例宫颈上皮内瘤变(CIN)患者的病灶组织标本为CIN组,患者年龄30~65岁;20例接受宫颈活检者病理结果为正常宫颈的受检者的宫颈组织标本为对照组,年龄32~63岁。三组入组者年龄相比P>0.05。本研究已获得医院伦理委员会审核同意,入组者已签署知情同意书。
1.2 各组标本TFPI-2、VEGF检测 采用免疫组化SP法。各组标本经10%甲醛固定,石蜡包埋,5 μm切片。二甲苯脱蜡,100%、95%、85%乙醇浸泡水化,98 ℃的枸橼酸钠溶液(0.01 mol/L,pH=6.0)中浸泡15 min进行抗原修复,滴加正常山羊血清室温封闭15 min,弃血清,滴加TFPI-2、VEGF一抗工作液,37 ℃孵育2 h,PBS洗涤5 min ,洗涤3次,,滴加生物素二抗,室温孵育30 min,PBS洗涤5 min ,洗涤3次, DAB显色,充分冲洗后苏木素复染,常规脱水,透明,干燥,封片。以已知阳性切片为阳性对照,PBS替代一抗为阴性对照。阳性染色结果为细胞质内棕黄色颗粒。每份标本均选择10个含有阳性细胞的高倍视野(×200)分别计数100个肿瘤细胞,取其平均值计算阳性细胞百分率。按阳性细胞百分率计分:无阳性细胞计0分,阳性细胞百分率≤25%计1分,阳性细胞百分率26%~50%计2分,阳性细胞百分率>50%计算3分。按染色程度计分:无阳性着色计0分,浅黄色计1分,深黄色计2分,棕黄色计3分。两项得分之和>3分判定为阳性,≤3分定为阴性。
1.3 各组标本MVD检测 采用免疫组化SP法行CD34染色,具体方法同1.2。结果判定采用Weidner量化分析法[5]:低光镜下寻找微血管分布均匀区域(排除肿瘤出血区和边缘反应区)。随机选取5个视野,高倍镜(×200)下计数染成棕黄色的血管数,计算平均值,即为MVD。与邻近肿瘤细胞、血管、结缔组织界限清晰,且呈棕黄色的内皮细胞或内皮细胞簇,即为1个微血管数;排除肿瘤硬化区以及、>8个红细胞的血管。采用Decaussin法[6],以MVD平均值为分界线,≥平均值者判定为高MVD,否则判定为低MVD。
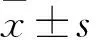
2 结果
2.1 三组标本TFPI-2、VEGF蛋白表达及MVD比较 宫颈癌组、CIN组、对照组TFPI-2阳性表达率分别为21.25%(17/80)、52.00%(26/50)和85.00%(17/20),宫颈癌组TFPI-2阳性表达率与CIN组、对照组相比,P均<0.05;CIN组TFPI-2阳性表达率与对照组相比,P均<0.05。宫颈癌组、CIN组、对照组VEGF阳性表达率分别为72.50%(58/80)、42.00%(21/50)和10.00%(2/50),宫颈癌组VEGF阳性表达率与CIN组、对照组相比,P均<0.05;CIN组VEGF阳性表达率与对照组相比,P均<0.05。
宫颈癌组、CIN组、对照组MVD分别为(22±8)、(10±2)、(6±2)条/HP,宫颈癌组MVD与CIN组、对照组相比,P均<0.05;CIN组MVD与对照组相比,P均<0.05。
2.2 宫颈癌组标本TFPI-2表达与VEGF表达、MVD的相关性 宫颈癌组标本中TFPI-2、VEGF均为阳性8例,TFPI-2阳性VEGF阴性5例,TFPI-2阴性VEGF阳性5例,TFPI-2、VEGF均为阴性1例,Spearman等级相关性分析结果显示,宫颈癌组标本TFPI-2和VEGF蛋白表达呈负相关(r=-0.632,P<0.05)。以MVD平均值为分界线判定MVD高低,宫颈癌组标本高MVD者53例、低MVD者37例。宫颈癌组标本高MVD且TFPI-2阳性6例,高MVD且TFPI-2阴性47例,低MVD且TFPI-2阳性13例,低MVD且TFPI-2阴性24例。Spearman等级相关性分析结果显示,宫颈癌组标本TFPI-2蛋白表达与MVD呈负相关(r=-0.685,P<0.05)。
3 讨论
在我国,宫颈癌的发病率位居女性恶性肿瘤的首位。全世界每年大约有53万宫颈癌新发病例和27万死亡病例,且大约85%死亡病例发生在不发达国家或者发展中国家[7]。目前宫颈癌发病机制尚不完全清楚。因此,探讨宫颈癌发生发展机制,将为临床治疗宫颈癌提供新的治疗思路和理论依据,并为宫颈癌防治药物的研发提供新机制、新靶点、新方向。
细胞外基质(ECM)被降解是肿瘤生长和侵袭的关键步骤,TFPI-2能够下调与ECM相关的蛋白酶的酶活性,维持ECM的稳定性,从而减慢或者阻碍肿瘤细胞的侵袭转移过程[8]。大量研究结果表明,TFPI-2在多种恶性肿瘤中呈低表达状态,如胰腺癌[9]等。本研究结果显示,宫颈癌组织TFPI-2蛋白阳性表达率显著低于宫颈上皮内瘤样变组织和正常宫颈组织,提示TFPI-2抑制了宫颈癌的发生,具有抑癌基因的功能,与Libra等[10]的研究结论一致。TFPI-2表达降低是宫颈癌相关的分子标志之一。恶性肿瘤的发生、增殖、侵袭转移等均依赖于肿瘤血管生成[11],同时血管生成也是影响肿瘤患者预后的重要因素。目前,评估肿瘤血管生成状态的金标准是MVD[12],MVD可直观地反映肿瘤的血管生成能力。同时MVD能够反映肿瘤的侵袭性及恶性程度,可以作为多种肿瘤预后预测的独立指标[13]。
VEGF能够增加血管通透性,促进血管内皮细胞的增殖,是促进血管生成的最主要的因子[14]。VEGF的表达水平,也可以作为评价血管活性强度的良好指标之一。VEGF不仅与肿瘤血管生成有关,而且与肿瘤的侵袭转移密切有关[15,16]。本研究结果显示宫颈癌组织TFPI-2蛋白表达和VEGF表达、MVD均呈负相关。表明TFPI-2能够抑制宫颈癌组织血管形成。而VEGF可能是其中重要的效应蛋白。TFPI-2可能是通过抑制宫颈癌组织VEGF表达进而抑制宫颈癌组织血管生成。
TFPI-2通过下调VEGF蛋白表达抑制了宫颈癌新生血管的生成,阻断其营养供应,抑制肿瘤增殖,进而发挥其抑制肿瘤侵袭转移的作用。这为宫颈癌的临床治疗提供了新的研究方向。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Keizer MP, Pouw RB, Kamp AM, et al. TFPI inhibits lectin pathway of complement activation by direct interaction with MASP-2[J]. Eur J Immunol, 2015,45(2):544-550.
[3] Xu C, Deng F, Mao Z, et al. The interaction of the second Kunitz-type domain (KD2) of TFPI-2 with a novel interaction partner, prosaposin, mediates the inhibition of the invasion and migration of human fibrosarcoma cells[J]. Biochem J, 2012,441(2):665-674.
[4] Saponaro C, Malfettone A, Ranieri G, et al. VEGF, HIF-1α expression and MVD as an angiogenic network in familial breast cancer[J].PLoS One,2013,8(1):e53070.
[5] Weidner N. Intratumor microvessel density as a prognostic factor in cancer[J]. Am J Pathol, 1995,147(1):9-19.
[6] Decaussin M, Sartelet H, Robert C, et al. Expression of vascular endothelial growth factor (VEGF) and its two receptors (VEGF-R1-Flt1 and VEGF-R2-Flk1/KDR) in non-small cell lung carcinomas (NSCLCs): correlation with angiogenesis and survival[J]. J Pathol, 1999,188(4):369-377.
[7] Wardak S. Human Papillomavirus (HPV) and cervical cancer[J]. Med Dosw Mikrobiol, 2016,68(1):73-84.
[8]Libra M, Scalisi A, Vella N, et al. Uterine cervical carcinoma: role of matrix metalloproteinases (review)[J]. Int J Oncol, 2009,34(4):897-903.
[9] Folkman J. Role of angiogenesis in tumor growth and metastasis[J]. Semin Oncol, 2002,29(6 Suppl 16):15-18.
[10] Triratanachat S, Niruthisard S, Trivijitsilp P, et al. Angiogenesis in cervical intraepithelial neoplasia and early-staged uterine cervical squamous cell carcinoma: clinical significance[J]. Int J Gynecol Cancer, 2006,16(2):575-580.
[11] Randall LM, Monk BJ, Darcy KM, et al. Markers of angiogenesis in high-risk, early-stage cervical cancer: A Gynecologic Oncology Group study[J]. Gynecol Oncol, 2009,112(3):583-589.
[12] Cimpean AM, Mazuru V, Saptefrati L, et al. Prox 1, VEGF-C and VEGFR3 expression during cervical neoplasia progression as evidence of an early lymphangiogenic switch[J]. Histol Histopathol, 2012,27(12):1543-1550.
[13] Ferrara N. Vascular endothelial growth factor and age-related macular degeneration: from basic science to therapy[J]. Nat Med, 2010,16(10):1107-1111.
[14] Takahashi S. Vascular endothelial growth factor (VEGF), VEGF receptors and their inhibitors for antiangiogenic tumor therapy[J]. Biol Pharm Bull, 2011,34(12):1785-1788.
[15] Gessler F, Voss V, Seifert V, et al. Knockdown of TFPI-2 promotes migration and invasion of glioma cells[J]. Neurosci Lett, 2011,497(1):49-54.
[16] Tang Z, Geng G, Huang Q, et al. Expression of tissue factor pathway inhibitor 2 in human pancreatic carcinoma and its effect on tumor growth, invasion, and migration in vitro and in vivo[J]. J Surg Res, 2011,167(1):62-69.
