不同剂量大豆苷元对宫颈癌细胞株HelaVEGF-C基因表达的影响
2018-03-19胡焕焕姬国杰陈阳常朋兰刘艳青张宁王冰薛钊刘瑞周红伟石晓卫
胡焕焕,姬国杰,陈阳,常朋兰,刘艳青,张宁,王冰,薛钊,刘瑞,周红伟,石晓卫
(新乡医学院三全学院生命科学技术学院,河南新乡453003)
大豆苷元(4,7-二羟基异黄酮),又称大豆黄酮、大豆素,主要存在于豆科、鸢尾科植物中,为植物雌激素的一种,类似雌激素样化合物的非甾体植物化学物质。大豆苷元属于黄酮类化合物,具有抗氧化、防止血管增生、抗炎症、抑制癌细胞增殖、保护神经细胞等多种生物学功能,广泛用于治疗妇女更年期综合征、前列腺癌、乳腺癌、心脏病、心血管病、骨质疏松等疾病[1,2]。大豆苷元化学结构中的糖苷以游离的形式存在[3],与17-β-雌二醇的结构和功能相似性,并且可以结合雌激素受体α(ERα)和β(ERβ)[4~6],进而剂量依赖性的抑制宫颈癌细胞增殖[7]。但是其中的中间环节仍不明确。VEGF是血管生成因子中最主要的一种,下调VEGF可以抑制宫颈癌细胞增殖。VEGF-C是VEGF中功能最强的一种。本研究观察了大豆苷元对宫颈癌细胞株Hela中VEGF-C mRNA表达的影响。现报告如下。
1 材料与方法
1.1 细胞株及主要试剂仪器 宫颈癌Hela细胞株由本实验室保存。DMEM培养基,胎牛血清(Gibco,美国);二甲基亚砜(DMSO),大豆苷元(Sigma,美国);Trizol细胞裂解液(Invitrogen,美国)。电子分析天平(ME204,梅特勒)、落地冷冻高速离心机(Thermo/Multifuge X1R,美国)、梯度PCR仪(Sensoquestlabcycler standard,德国senso)、凝胶成像系统(Bio-Rad)、电泳仪(Power Pac Universal,Bio-Rad)
1.2 细胞培养及大豆苷元应用方法 宫颈癌Hela细胞用含有10%胎牛血清的DMEM培养基在37℃、5%CO2条件下培养,每天换液一次,2~3 d传代,取对数生长期细胞用于本实验。称取大豆苷元用DMSO溶液溶解,0.22 μm孔径的除菌过滤膜过滤,4 ℃低温避光保存,两周内使用。设观察1、2、3组和对照组。观察1、2、3组分别加入大豆苷元至终浓度为10、40、80 μmol/l。对照组不加药。继续培养24 h。
1.3 各组细胞VEGF-C mRNA检测 采用半定量RT-PCR法。Trizol提取各组细胞总RNA,逆转录成cDNA。以GAPDH为内参照行半定量RT-PCR:VEGF-C上游引物 5′-CAGTTACGGTCTGTGTCCAGT-3′,下游引物5′-GGACACACATGGAGGTTTAAAGAAG-3′,产物长度300 bp;GAPDH上游引物5′-TCCCATCACCATCTTCCAG-3′,下游引物5′-AGGAGTGGGTGTCGCTG-3′,产物长度662 bp。反应体系20 μL。PCR反应条件:95 ℃ 5 min, 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 40 s, 72 ℃ 10 min。电泳,凝胶成像系统拍照并测算各条带灰度。VEGF-C相对表达量以VEGF-C条带灰度值与GAPDH条带灰度值之比表示。
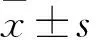
2 结果
观察1、2、3组及对照组细胞VEGF-C mRNA相对表达量分别为0.533±0.011、0.184±0.006、0.164±0.007、0.613±0.011。观察1、2、3组细胞VEGF-C mRNA相对表达量均低于对照组(P均<0.05),且观察3组低于观察1、2组(P均<0.05),观察2组低于观察1组(P<0.05)。
3 讨论
肿瘤在生长和转移的过程中受到多种因素的影响,其中血管生成占有重要的地位,对肿瘤细胞的增殖和转移具有重要意义。VEGF-C即血管内皮生长因子,与VEGFC-A、胎盘生长因子(PLGF)、VEGF-B、VEGF-C、VEGF-D、VEGF-E合称VEGF家族六大成员。有研究表明,该基因与其受体在乳腺癌、宫颈癌、结肠癌、咽喉癌等恶性癌症中表达的含量明显高于正常细胞[8]。因此,该基因可以被用来研究宫颈癌的遗传与表达情况。经研究发现在某些未知因素下,瘤细胞代偿性产生VEGF-C,通过旁分泌上调淋巴内表皮细胞内的VEGF-C受体mRNA,刺激受体表达,与其特异结合相互作用,启动酪氨酸激酶信号系统,引起淋巴内皮细胞增生[9]。综上所述,VEGF-C的表达与恶性肿瘤间的机制可能是:①VEGF-C可能激活其受体VEGF受体-3,导致原发肿瘤的增生从而有利于癌细胞向淋巴管扩散;②VEGF-C与其受体VEGF受体-2结合后,可介导淋巴管通透性增加;③VEGF-C的过表达可提高肿瘤细胞侵袭性。因此,可以通过阻断以上途径降低肿瘤的淋巴转移率[10]。体外研究表明,大豆苷元可以通过抑制酪氨酸蛋白激酶、丝裂原活化激酶或DNA异构酶Ⅱ等来抑制细胞增殖并引发凋亡。VEGF-C是多种血管生成因子中最主要的,它可以特异性的作用于淋巴管生长因子,在肿瘤转移中发挥重要的作用。VEGF-C在良、恶性宫颈病变的阳性表达率有显著差别[11]。我们认为,VEGF下调的表达可以抑制宫颈癌的生长,Braicu等[12]的研究结果证实了这一点。本研究结果显示,大豆苷元可以抑制宫颈癌细胞VEGF-C的表达,并且表现出一定的剂量依赖趋势。综合前人研究成果[13,14],笔者推测大豆苷元下调VEGF-C表达可能是大豆苷元抑制宫颈癌细胞增殖的机制之一。
细胞的癌变,肿瘤的发生至少是由几百种基因异变而引起的,大豆苷元可以通过一系列的表达调控影响癌细胞,使其功能结构改变而达到抑制效果。大豆苷元可以通过多种途径抑制肿瘤细胞增殖。如:大豆苷元能抑制宫颈癌 Hela 细胞的生长并将其阻滞于G0/G1或G2/M期,从而抑制Hela细胞的增殖[15]。大豆苷元可以通过线粒体依赖途径促进凋亡,Caspase-3的表达是细胞凋亡中的一个关键因素,大豆苷元可以激活Caspase-4,其结合白细胞介素6诱导细胞炎症反应,也可以通过诱导Caspase-9和Caspase-7的活化以及诱导细胞色素C释放到细胞质中促进细胞凋亡[16]。大豆苷元还可以通过上调Bax/Bcl-2发挥促凋亡作用[17~19]。还有研究还表明,大豆苷元处理 Hela 细胞后,人端粒酶催化亚单位mRNA的表达下降。大豆苷元还可以通过降低线粒体膜电位,调节下游c-Myc及相关Myc蛋白激活氧化应激介导的线粒体凋亡[20~23]。上述研究表明大豆苷元通过调节细胞增殖、细胞周期和体内端粒酶活性等多个途径影响宫颈癌的发展。本研究结果揭示了一条大豆苷元抑制宫颈癌细胞增殖的新的信号传导通路,为今后宫颈癌的防治提供了新的方向。
[1] lchinsam, Mclver I, Johnston CS, et al. Soy isoflavone andascorbic acid Supplementation alone or in combination minimally affect plasma lipid peroxides in healthy postmenopausal women [J]. J Am Diet Assoc, 2005,10(5):1134-1137.
[2] 徐方野,高苗苗. 天然黄酮类化合物的抗肿瘤作用机制研究进展[J]. 新疆医科大学学报,2013, 36(2): 171-176.
[3] Lee ER, Kang GH, Cho SG. Effect of flavonoids on human health: old subjects butnew challenges [4]. Recent Pat Biotechnol, 2007, 1(2): 139-150.
[5] Uifalean A, Schneider S, Ionescu C, etal. Soy Isoflavones and Breast Cancer Cell Lines[J]. Molecules, 2016,21(13):1-17
[6] 杨楠,贾晓斌,张振海,等.黄酮类化合物抗肿瘤活性及机制研究进展[J]. 中国中药杂志,2015, 40(3): 373-381.
[7] 韩静.葛根异黄酮抑制血管平滑肌细胞增殖作用机制的实验研究[D].北京:北京中医药大学,2004.
[8] Li Z, Qu L, Zhong H, et al. Thymosin beta 10 prompted the VEGF-C expression in lung cancer cell[J]. Chin J Lung Cancer, 2014, 17(5):378-383.
[9] Akagi K, Ikeda Y, Miyazaki M, et al. Vascular endothelial growth factor-C (VEGF-C) expression in human colorectal cancer tissues[J]. Br J Cancer, 2000,83(7):887.
[10] 王蕾, 吕鑫霞, 吴志奎. 补肾生血药对金黄地鼠子宫组织bFGF、VEGF表达水平的影响[J]. 中国中医基础医学杂志, 2000, 6(12):25-28.
[11] 陈艳君,黎勇夫.老年宫颈癌患者组织及血清VEGF-C的表达水平及其相关性研究[J].实用癌症杂志,2015,6(4):812-814
[12] Braicu C,Gherman CD, Irimie A.,et al. Epigallocatechin-3-Gallate (EGCG) inhibits cell proliferation and migratory behaviour of triple negative breast cells[J]. J Nanosci Nanotechnol, 2013, 13(1): 632-637.
[13] Zhang ZY,Wang CZ,Du GJ, et al. Genistein induces G2/MATM/p53-dependent pathwayin human colon cancer cells[J]. Int J Oncol, 2013,43(1):289-296.
[14] Robb EL,Stuart JA. Multiple phytoestrogens inhibit cell growth and confer cytoprotection by inducing manganese superoxide dismutase expression[J]. Phytother Res, 2014,28(1):120-131.
[15] Cheng Bao,Hyeju Namgung,Jaehoo Lee,et al.Daidzein suppresses tumor necrosis factor- factor-thwayration and invasion by inhibiting hedgehog/gli1 signaling in human breast cancer cells[J]. J Agri Food Chem, 2014,62(17):3759-3767
[16] 韩冰洁.大豆苷元及钌.多吡啶金属配合物的抗肿瘤活性研究[D]. 广州:广东药科大学,2016.
[17] 蒋葭蒹,冉昇,吴婷婷,等.大豆异黄酮及其衍生物对宫颈癌细胞增殖的影响[J]. 大豆科学,2012,31(6):1017-1020.
[18] 李超,刘艾林,冠华.天然异黄酮类化合物的药理学研究进展[J]. 中国新药杂志,2013,22(12):1415-1420.
[19] 彭文兴. 大豆苷元(4, 7 '-二羟基异黄酮)代谢机制及对细胞色素P450的影响[D]. 武汉:中南大学,2003.
[20]康欣梅,王慧,王丽,等.大豆苷元对乳腺癌生长和血管生成的影响[J].癌变.畸变.突变,2015,27(1):16-20
[21] Mei-lin CUI , Huan-yi YANG , Guo-qing HE. Apoptosis induction of colorectal cancer cells HTL-9 in vitro by the transformed products of soybean isoflavones by Ganoderma lucidum[J]. Biomed Biotech, 2017,18(12):1101-1112
[22]Guo JM,Kang GZ,Xiao BX,et al.Effect of daidzein on cell growth,cell cycle,and telomerase activity of human cervical cancer in vitro[ J] . Int J Gynecol Cancer, 2004,14(5):882 -888.
[23]刘崇梅,李岳,林明晖,等.VEGF在乳腺癌中的表达及其与ER、PR的相关性研究[J].现代肿瘤医学,2012,20(3):527-529
