不同灌溉和栽培方式对红壤性水稻土微生物群落结构及多样性的影响
2018-03-19张文锋胡秋萍
张文锋,时 红,才 硕,武 琳,胡秋萍,徐 涛,张 昆*
(1.江西省红壤研究所,江西 南昌 331717;2.江西省灌溉试验中心站,江西 南昌 330201)
水稻是我国重要的粮食作物,南方红壤稻田是我国水稻主产区之一,在全国水稻生产中占有重要地位。水稻产量受稻田水分管理、气候、栽培等诸多因素影响,其中合理灌溉和栽培是确保水稻高产稳产的行之有效的措施之一[1]。水稻具有广泛水适应性,是农业用水的第一大户,占中国农业用水总量的70%左右,每年在中国各稻区因干旱缺水造成的水稻减产均有发生[2]。在水资源短缺背景下,从传统淹水灌溉发展到短期或长期无水层等节水灌溉方式可以在不影响作物产量的前提下,实现水的高效利用[3]。因此,发展节水农业,提高水稻的水分利用效率,缓解水资源的供需矛盾,成为保障中国粮食安全的重大课题。另外,目前我国水稻种植方式包括人工栽插、机械插秧、机械直播、钵苗行栽等主要方式,随着农村大量优质劳动力转移,稻农对轻简栽培方式的需求愈发迫切,近年来,水稻生产机械化呈现出快速发展趋势,种植机械化水平已达到 7.1%[4-5]。
土壤微生物是土壤的重要组成部分,是影响土壤肥力的重要因素,是衡量土壤质量、维持土壤肥力和作物生产的一个重要指标,对其所生存的微环境十分敏感,能对土壤环境胁迫迅速做出反应,进而导致群落结构发生改变[6]。土壤水分状况不仅会直接影响微生物细胞的渗透状态,还会通过改变土壤理化性质以及土壤中养分的可利用性等间接对微生物产生影响。有研究表明,在土壤持续湿润条件下的土壤微生物丰度与活性高于干旱条件下的,良好的水分条件有利于微生物群落的发展[7];土壤水分含量会严重影响微生物的数量与多样性,在水分充足情况下,微生物活性与丰度高于缺水处理下的,同时细菌丰度在通气性好的土壤中较高[8]。目前关于土壤微生物群落结构的研究较多地集中在土地利用方式、施肥方式和耕作方式等措施方面,而有关不同灌溉和栽培方式对稻田微生物群落结构和多样性影响的研究报道甚少。本研究基于不同灌溉和栽培方式的田间实验,运用高通量测序技术分析了淹水灌溉和节水灌溉以及不同栽培方式下稻田土壤微生物的群落结构和多样性,以期为切实优化稻田灌溉,提高微生物活性与水分利用率提供科学依据。
1 材料与方法
1.1 试验地概况
本试验研究于2016年在江西省灌溉试验中心站试验场进行。试验场位于鄱阳湖流域赣抚平原灌区二干渠中游右岸,坐落在江西省南昌市南昌县向塘镇高田村,东经116°00′,北纬28°26′,为平原地区,属亚热带季风气候,多年平均气温为17.7 ℃,年降雨量为1685.20 mm,蒸发量(E601型)943 mm,日照时数1575.50 h。试验区土壤为红壤性水稻土,土质粘重。土壤呈酸性反应,基础土壤(0~20 cm)的pH值为4.5~6.5,全氮(N)含量为1.03 g/kg,有机质含量为17.30 g/kg,全磷(P2O5)含量为0.41 g/kg,有效磷(P2O5)含量为6.14 mg/kg,速效钾(K2O)含量为12.40 mg/kg。
1.2 试验设计
以水稻节水灌溉为研究基础,本试验设定淹水灌溉和节水灌溉两种灌溉模式,每种灌溉模式下设定移栽、抛秧、直播、机插秧四种栽培方式,共计8个小区,每个小区面积120 m2(7.5 m×16.0 m)。供试早稻品种为中嘉早17,属于籼型常规水稻,全生育期平均为109 d;供试晚稻品种为H优518,属于三系杂交中熟晚籼,全生育期108 d。
施肥水平设计为:直播稻施肥掌控“前促、中控、后补”的原则,采用“一基三追”的方法,氮肥用量为180 kg/hm2,基肥∶断奶肥∶分蘖肥∶穗肥=4∶2∶2∶2,在1叶1心期施断奶肥,在4叶1心期施分蘖肥,在移栽后35~40 d时施用穗肥;磷肥全部作基肥,施肥水平为90 kg/hm2;钾肥用氯化钾,施肥水平为180 kg/hm2,基肥∶断奶肥∶分蘖肥∶穗肥=4∶2∶2∶2,其施肥时期与氮肥相同。其余3种稻作模式均采取基肥、分蘖肥和穗肥的施肥方式,其中氮肥、钾肥的施肥比例均为基肥∶分蘖肥∶穗肥=4∶3∶3;磷肥全部做基肥,施肥水平和直播稻保持一致。各试验处理小区(120 m2)的具体施肥量如表1。

表1 试验各处理小区的具体施肥量
1.3 土样采集
2016年分别在早稻灌浆期(6月25日)和成熟期(7月14日)采集土样,采样时灌浆期土壤处于淹水阶段,成熟期土壤均处于排水落干阶段。晚稻在水稻分蘖盛期(8月17日)采集土样,分淹水处理和节水处理。每个小区采用5点法在根部周围用土钻采耕层土(直径5 cm,深15 cm)。将土样掰碎,剔除大中型土壤动物及根茬等,混合均匀后经冷冻干燥,于-70 ℃保存,用于微生物群落结构(高通量测序)的分析。实验设计及土壤样品信息如表2。
1.4 测定方法
本研究采用16S rRNA的V3~V4区域作为目标DNA序列进行PCR扩增。以通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和506R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rDNA的V3~V4进行扩增。PCR反应条件为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,25个循环;72 ℃延伸20 min。扩增结束后,对PCR扩增产物使用2%琼脂糖进行凝胶电泳,检查扩增效果。将样品的PCR产物在Illumina-MiSeq平台上进行高通量测序。
1.5 数据分析
首先使用软件QIIME[9]对有效序列进行去杂和修剪,得到优化数据。再通过归类操作,将序列按照彼此的相似性分归为许多小组,1个小组就是1个OTU(operational taxonomic units)。可根据不同的相似度水平,对所有序列进行OTU划分,通常对97%相似水平下的OTU进行生物信息统计分析。采用RDP classifier贝叶斯算法对97%相似水平下的OTU代表序列进行分类学分析,并在各个分类水平下统计各土壤样本的微生物群落组成。基于OTU计算微生物群落的丰度和多样性指数。
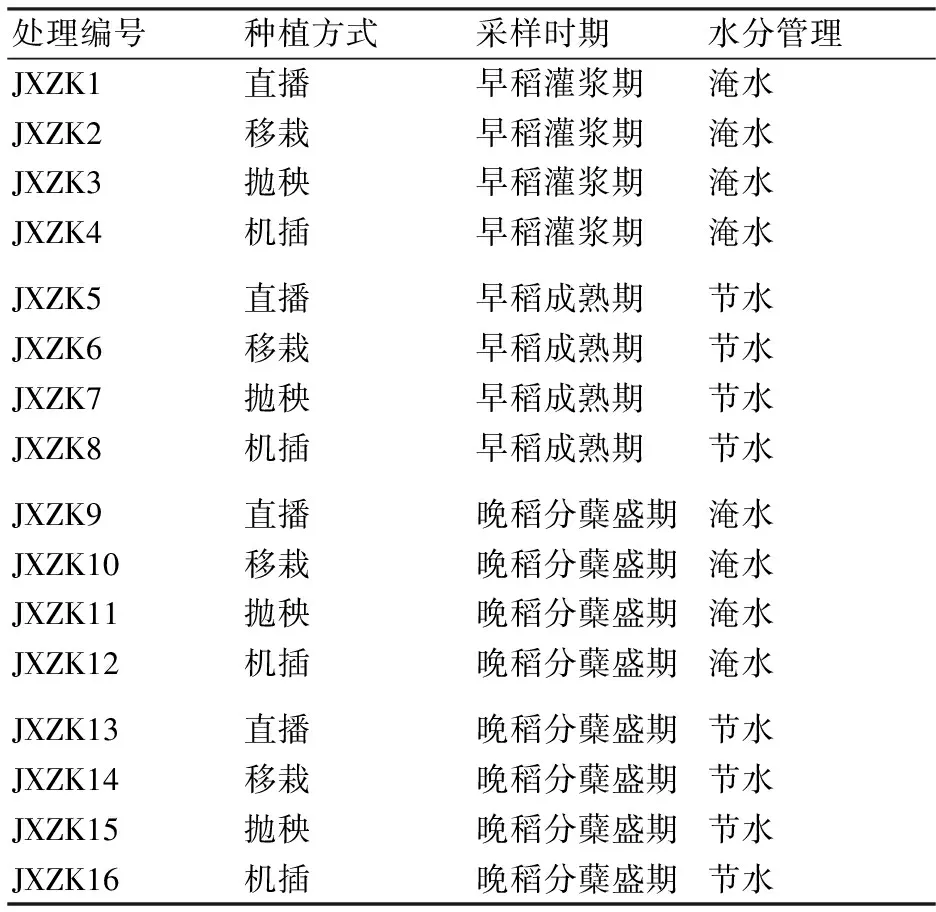
表2 采集的土壤样品信息
利用QIIME软件根据公式(1)计算各土壤样品的Chao1指数[10]。根据公式(2)和公式(3)分别计算每个样品的香农(Shannon)指数和辛普森(Simpson)指数。
(1)
(2)
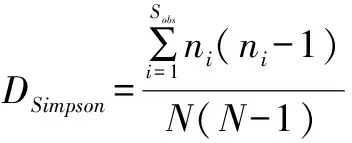
(3)
上式中:SChao1是Chao1指数,代表群落丰富度指数;HShannon代表香农多样性指数;DSimpson代表辛普森多样性指数;Sobs是得到的OTU的数量;n1是只有1条序列的OTU数目;n2是只有2条序列的OTU数目;ni为第i个分类单元中包含的序列数;N为所有序列之和[11]。
2 结果与分析
2.1 Alpha多样性分析
从表3中可知:所有样品的覆盖度指数均在90%以上;在97%分类水平下,不同水分管理和栽培方式下Chao1指数、Ace指数、Simpson指数、Shannon指数、OTU数量有所差异;除JXZK3、JXZK13外,其它样品的覆盖率较高,均在0.97以上,表明样品中序列大多数被测出,序列未被测出的概率较低。
在早稻灌浆期,在淹水灌溉条件下,抛秧方式的土壤微生物群落丰富度指数(Ace、Chao1)和Richness最高,样本中物种种类相对较多。在早稻成熟期,在节水灌溉条件下,机插方式的土壤微生物群落丰富度指数(Ace、Chao1)和Richness最高,样本物种种类相对较多。在晚稻分蘖盛期,与淹水灌溉相比,节水灌溉在4种栽插方式下土壤微生物群落丰富度指数(Ace、Chao1)和Richness均更高,表明节水灌溉下土壤微生物种类相对较丰富。多样性指数Simpson值越大,说明群落多样性越高。在早稻灌浆期,在淹水灌溉条件下,抛秧方式的Shannon指数最高,表明此方式下的土壤微生物群落多样性高于其他栽插方式下的。在早稻成熟期,在节水灌溉条件下,直播和机插方式的Shannon指数较高。在直播和机插方式下,早稻成熟期节水处理的土壤微生物多样性指数(Shannon)高于早稻灌浆期淹水处理的。在晚稻分蘖盛期,在直播和抛秧方式下,节水灌溉的Shannon指数高于淹水灌溉的;在移栽和机插方式下,节水和淹水灌溉的Shannon指数均相等;在淹水灌溉条件下,Shannon指数的大小顺序为直播>移栽>抛秧>机插;在节水灌溉条件下,Shannon指数的大小顺序为直播>抛秧>移栽>机插。
2.2 微生物的群落结构
对16个土壤样品进行高通量测序后,共获得33个门和未分类细菌,图1列出了微生物群落在门分类水平上的分布情况,33个门为Proteobacteria、Acidobacteria、Verrucomicrobia、Chloroflexi、Bacteroidetes、Actinobacteria、Cyanobacteria/Chloroplast、Ignavibacteriae、Firmicutes、Planctomycetes、Chlamydiae、Spirochaetes、Nitrospirae、Gemmatimonadetes、Elusimicrobia、Candidatus_Saccharibacteria、Parcubacteria、Aminicenantes、Omnitrophica、Armatimonadetes、Latescibacteria、Lentisphaerae、candidate_division_WPS-2、candidate_division_WPS-1、Microgenomates、Cloacimonetes、BRC1、Fibrobacteres、SR1、Fusobacteria、Hydrogenedentes、candidate_division_ZB3、Deinococcus-Thermus。16个样品中微生物群落组成类似,但不同样品各种微生物所占的比例有所差异,其中Proteobacteria(变形菌门)占主要优势,在所有样品中所占的比例均在30%~40%。其它较占优势的菌门为:Acidobacteria(酸杆菌门),所占比例在10.00%~16.10%;Chloroflexi(绿弯菌门),所占比例在5.40%~14.90%。还有一些占有较低比例的菌门,例如:Verrucomicrobia(疣微菌门,占3.50%~8.30%)、Bacteroidetes(拟杆菌门,占2.90%~7.90%)、Actinobacteria(放线菌门,占0.90%~3.50%)。变形菌门所占比例在早稻成熟期高于早稻灌浆期,厚壁菌门所占比例在早稻灌浆期高于早稻成熟期。
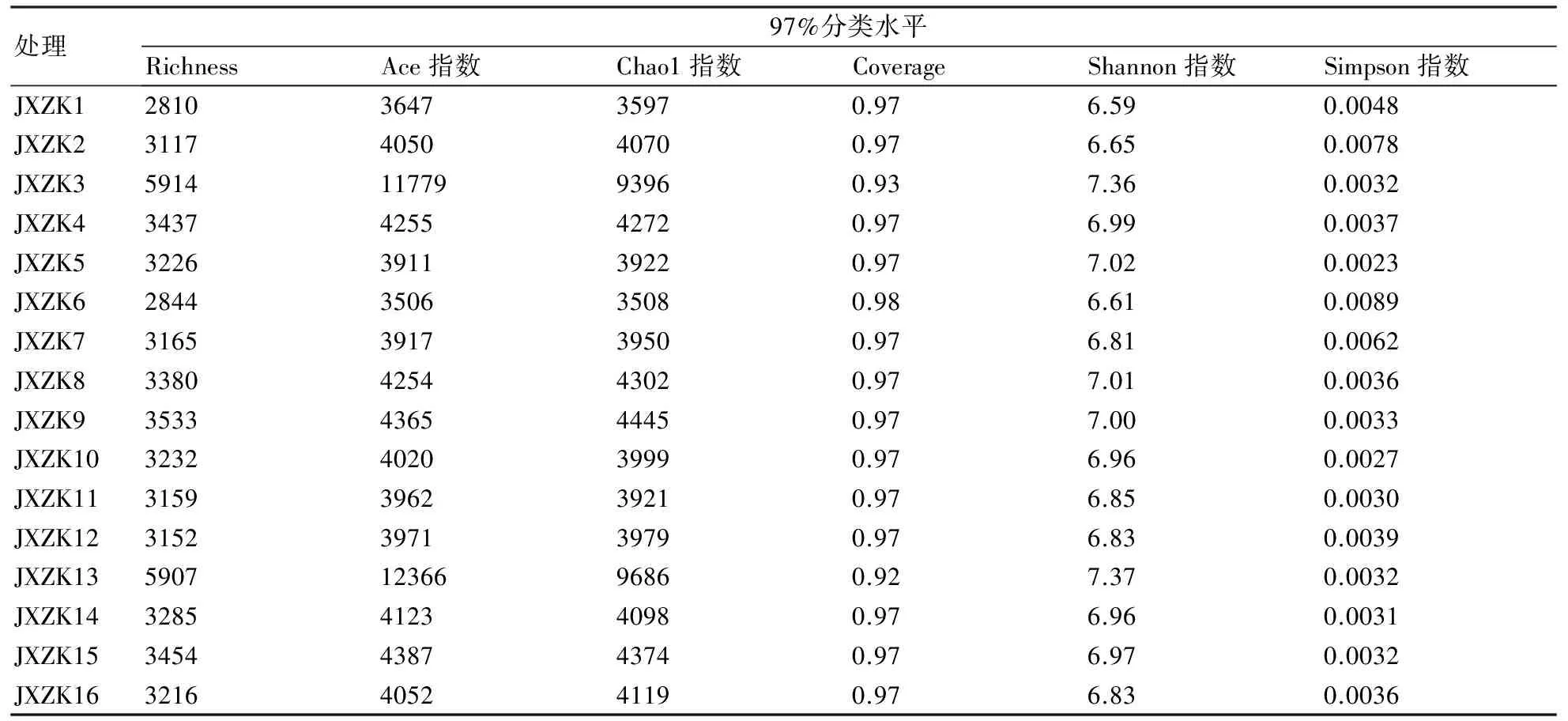
表3 不同水分管理和栽插方式下稻田土壤微生物的多样性

图1 不同土壤样品中微生物门水平菌群分布
微生物群落在属分类水平上的分布情况如图2所示,其中占优势的菌属分别为Unclassified_Bacteria(11.00%~17.80%)、Unclassified_Deltaproteobacteria(4.70%~6.30%)、Subdivision3_genera_incertae_sedis(1.50%~6.10%)、Unclassified_Chloroflexi(2.00%~6.90%)、Unclassified_Betaproteobacteria(1.90%~5.50%)、Unclassified_Anaerolineaceae(1.60%~5.40%)、Unclassified_Bacteroidetes(1.50%~4.70%)、Gp1(1.70%~3.60%)、Geobacter(1.00%~3.40%)、Gp18(1.20%~3.00%)、Gp3(1.10%~2.60%)。
2.3 Beta多样性分析
图3中每个点表示1个样品,点与点之间的距离越大,表示两个样品的物种组成差异越大,反之则表示物种组成越相似。由图3可知,JXZK7、JXZK8、JXZK9、JXZK10的物种组成与JXZK1、JXZK2、JXZK3、JXZK4差异较大。在早稻灌浆期处于淹水下,采用抛秧方式的土壤微生物组成与采用直播、移栽、机插种植方式的差异均较大;在早稻成熟期处于淹水下,直播、移栽、抛秧、机插方式之间土壤微生物组成差异均较小。在晚稻分蘖盛期,处于淹水处理下,直播、移栽、抛秧、机插之间土壤微生物组成差异均较小;而处于节水处理下,直播与移栽、抛秧、机插之间土壤微生物组成差异均较大。

图2 不同土壤样品中微生物属水平菌群分布

图3 不同土壤样品微生物群落主成分分析
3 讨论
土壤微生物是土壤重要的活体成分,土壤微生物量是土壤肥力水平高低的重要生物学指标,可反映出N、P等土壤养分转化能力的强弱,在养分运转、有机质形成和分解、土壤结构维持、温室气体产生等方面发挥着重要的调节作用[12-14]。但土壤微生物数量、活性与种群结构又受到土壤质地、种植方式、土壤水肥管理措施等多种因素的影响[15]。相关研究表明,土壤微生物的多样性和丰度受土壤结构、水热状况及通气性的直接影响[16]。
本研究结果显示,在晚稻分蘖盛期,与淹水灌溉相比,节水灌溉土壤微生物群落的丰富度指数(Ace、Chaol)和Richness均更高,土壤微生物种类相对较丰富,这可能是由于节水灌溉改变了土壤的理化性质,创造了土壤的好氧环境,而通气透水性能好的土壤有利于改善微生物的繁育条件,增加土壤微生物数量,从而有利于土壤微生物群落的发展[3,17]。
另外,本研究结果表明,在早稻和晚稻的土壤中变形菌门(Proteobacteria)占主要优势,所占的比例均在30%~40%;其次为绿弯菌门、酸杆菌门。这与前人的研究结果基本一致,例如:沈冰洁等[14]研究发现,稻田土壤优势细菌类群为变形菌,其次为绿弯菌,两者相对丰度高达60%以上;Jangid等[18]分析了不同类型耕作土壤的细菌种群结构,发现变形细菌占统治地位,其所占比例为30.60%~43.20%;Ge等[19]研究了长期施肥的农耕土壤的细菌多样性,也发现包括α-、β-、γ-变形细菌占细菌类群的30.50%,为优势群落。
4 结论
在直播和机插方式下,早稻成熟期节水处理土壤微生物多样性指数(Shannon指数)高于早稻灌浆期淹水处理的。在晚稻分蘖盛期,直播、移栽、抛秧、机插四种栽培方式下节水灌溉处理土壤微生物群落的丰富度指数均高于淹水灌溉处理的。在双季稻田试验,早稻和晚稻土壤变形菌门占主要优势,所占的比例均在30.00%~40.00%;其次为绿弯菌门和酸杆菌门,所占比例分别为5.40%~14.90%、10.00%~16.10%。
[1] 董春华,曾闹华,高菊生,等.长期不同施肥模式下红壤性稻田水稻产量及有机碳含量变化特征[J].中国水稻科学,2014,28(2):193-198.
[2] 张耗,剧成欣,陈婷婷,等.节水灌溉对节水抗旱水稻品种产量的影响及生理基础[J].中国农业科学,2012,45(23):4782-4793.
[3] 桂娟,陈小云,刘满强,等.节水与减氮措施对稻田土壤微生物和微动物群落的影响[J].应用生态学报,2016,27(1):107-116.
[4] 张军,张洪程,霍中洋,等.不同栽培方式对双季晚粳稻产量及温光利用的影响[J].中国农业科学,2013,46(10):2130-2141.
[5] 何瑞银,罗汉亚,李玉同,等.水稻不同种植方式的比较试验与评价[J].农业工程学报,2008,24(1):167-171.
[6] 夏昕,石坤,黄欠如,等.长期不同施肥条件下红壤性水稻土微生物群落结构的变化[J].土壤学报,2015,52(3):697-705.
[7] Williams M A, Rice C W. Seven years of enhanced water availability influences the physiological, structural, and functional attributes of a soil microbial community [J]. Applied Soil Ecology, 2007, 35(3): 535-545.
[8] 冯帅,刘小利,吴小丽,等.不同水分条件对玉米根际微生物群落的影响[J].作物杂志,2017(1):127-134.
[9] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community supported software for describing and comparing microbial communities [J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541.
[10] Chao A. Non-parametric estimation of the number of classes in a population [J]. Scandinavian Journal of Statistics, 1984, 11(4): 265-270.
[11] 夏围围,贾仲君.高通量测序和DGGE分析土壤微生物群落的技术评价[J].微生物学报,2014,54(12):1489-1499.
[12] 秦红灵,袁红朝,张慧,等.红壤坡地利用方式对土壤细菌群落结构的影响[J].土壤学报,2011,48(3):594-602.
[13] Brussaard L, de Ruiter P C, Brown G G. Soil biodiversity for agricultural sustainability [J]. Agriculture, Ecosystems & Environment, 2007, 121(3): 233-244.
[14] 沈冰洁,祝贞科,袁红朝,等.不同种植方式对亚热带红壤微生物多样性的影响[J].环境科学,2015,36(10):3839-3844.
[15] 肖新,朱伟,肖靓,等.适宜的水氮处理提高稻基农田土壤酶活性和土壤微生物量碳氮[J].农业工程学报,2013,29(21):91-98.
[16] Asadu C L A, Nwafor I A, Chibuike G U. Contributions of microorganisms to soil fertility in adjacent forest, fallow and cultivated land use types, in Nsukka, Nigeria [J]. International Journal of Agriculture and Forestry, 2015, 5(3): 199-204.
[17] 侯海军,张文钊,沈建林,等.水分管理对稻田细菌丰度与群落结构的影响[J].生态环境学报,2016,25(9):1431-1438.
[18] Jangid K, Williams M A, Franzluebbers A J, et al. Relative impacts of land-use, management intensity and fertilization upon soil microbial community structure in agricultural systems [J]. Soil Biology and Biochemistry, 2008, 40(11): 2843-2853.
[19] Ge Y, Zhang J B, Zhang L M, et al. Long-term fertilization regimes affect bacterial community structure and diversity of an agricultural soil in northern China [J]. Journal of Soils and Sediments, 2008, 8(1): 43-50.
