一个受青枯病菌诱导的烟草功能基因NtCNGC1的克隆与表达分析
2018-03-18林世锋王仁刚余婧任学良张洁余世洲
林世锋,王仁刚,余婧,任学良,张洁,余世洲
贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵州贵阳龙滩坝路29号 550081
青枯劳尔氏菌(Ralstonia solanacearum)引起的烟草青枯病是世界范围的毁灭性土传病害,给烟草生产带来巨大损失[1]。目前国内外对烟草抗青枯病的分子机理研究甚少,对控制青枯病的抗性基因数目、作用机制、烟草与青枯菌互作机理还不清楚。从转录组水平上分析和挖掘烟草品系中可能存在的抗青枯病基因,不仅能从分子水平上加深对烟草与青枯菌互作的认识,还将有助于青枯病抗源合理利用和抗病育种工作。
环核苷酸(cAMP/cGMP)是生命体重要的信号分子,环核苷酸门控离子通道(Cyclic nucleotidegated channel,CNGC)是环核苷酸主要受体之一,参与调控植物的生长、发育以及抗病等反应[2]。目前已在植物中克隆并鉴定了多个环核苷酸门控离子通道基因,Clough等[3]在筛选植物抗病突变体时发现AtCNGC2参与了植物响应病原微生物诱导的信号转导,病原菌(Pseudomonas syringae)在cngc2突变体上生长速度变慢,不能产生相应的过敏性反应(Hypersensitive response,HR),原因是cngc2突变体中水杨酸(Salicylic acid,SA)含量持续上升,导致病程相关(pathogenesis-related,PR)基因的持续表达,从而造成病原菌不能正常生长。电生理学分析显示,cngc2突变体胞内cAMP激活的钙离子流缺失,从而破坏胞内NO(nitric oxide)的产生,造成植物免疫反应的改变[4-5]。AtCNGC4也参与植物对病原微生物的抗性反应,AtCNGC4与AtCNGC2的同源性最高,其突变体与cngc2的表型一致,表现出PR基因的持续表达,水杨酸含量处于高水平等现象[6-7]。敲除AtCNGC11和AtCNGC12可降低植物对病原菌(Hyaloperonospora arabidopsidis)的抵抗能力,表明二者在植物抗病信号途径中是正调控因子[8]。此外,大麦NEC1基因的序列与AtCNGC4基因相似,其突变体表型与cngc4的相同,表现出PR基因的上调表达[9]。因此可以认为,CNGC既参与双子叶植物的抗病反应,又参与单子叶植物的抗病反应。
基于前期发现的CNGC基因家族成员在抗病烟草材料中上调表达的转录组结果,本研究克隆了该CNGC基因家族成员NtCNGC1,荧光定量PCR发现NtCNGC1在烟草DB101根中高水平表达,对比抗、感烟草材料接种青枯病菌后NtCNGC1表达量,进一步证明了该基因与烟草抗青枯病相关。
1 材料与方法
1.1 试验材料
强致病力烟草青枯病菌由贵州省烟草科学研究院烟草行业分子遗传重点实验室分离鉴定并继代保存于TTC培养基。烟草青枯病抗病品种DB101和易感品种红花大金元由贵州省烟草科学研究院良种繁育中心提供,采用漂浮育苗,待烟苗长至2~3片真叶时,移栽至花盆中(泥炭土:蛭石:珍珠岩=1:1:1)培养。
1.2 NtCNGC1基因的克隆
根据GenBank数据库中的烟草CNGC1基因序列(登录号:XM_016655150)设计克隆引物CNGC1-F和CNGC1-R(表1)。提取DB101烟草叶片总RNA,并反转录为cDNA,作为模版对烟草CNGC1基因进行PCR扩增、克隆和测序。同时,从DB101烟草叶片中提取基因组DNA,作为模版进行PCR扩增、克隆和测序。
1.3 NtCNGC1基因的生物信息学分析
采用SMART在线工具http∶//smart.embl-heidelberg.de/检索保守模体;采用PlantCARE在线工具http∶//bioinformatics.psb.ugent.be/webtools/plantcare/html/预测启动子的顺时作用元件;采用ClustalX 2.0软件对齐所有CNGC序列;采用MEGA4.0软件构建进化树,方法为邻接法,自举检测次数为1000。
1.4 NtCNGC1基因的荧光定量PCR表达分析
当烟苗长至5~6片真叶时,选取DB101和红花大金元生长状况一致的烟苗,参照Marco等[10]的方法接种青枯病菌,以蒸馏水处理烟苗作为对照。分别在接种后3、6、12、24和48 h取接种叶片作为检测样品;并在DB101苗期和旺长期,取中部叶、茎和根作为检测样品,所有样品液氮速冻保存。采用Trizol试剂盒(Invitrogen公司)提取各样品的总RNA,DNaseⅠ除去基因组DNA后,采用反转录试剂盒(TaKaRa公司)将其反转录成cDNA,荧光定量PCR进行烟草CNGC1基因的表达分析。基因扩增上游引物为CNGC1-rF、下游引物为CNGC1-rR,以烟草β-actin基因作为内参,内参基因扩增中所用上下游引物为Actin-rF和Actin-rR(表1)。各处理样品进行3次重复。采用2-ΔΔCT法进行基因相对定量分析[11]。
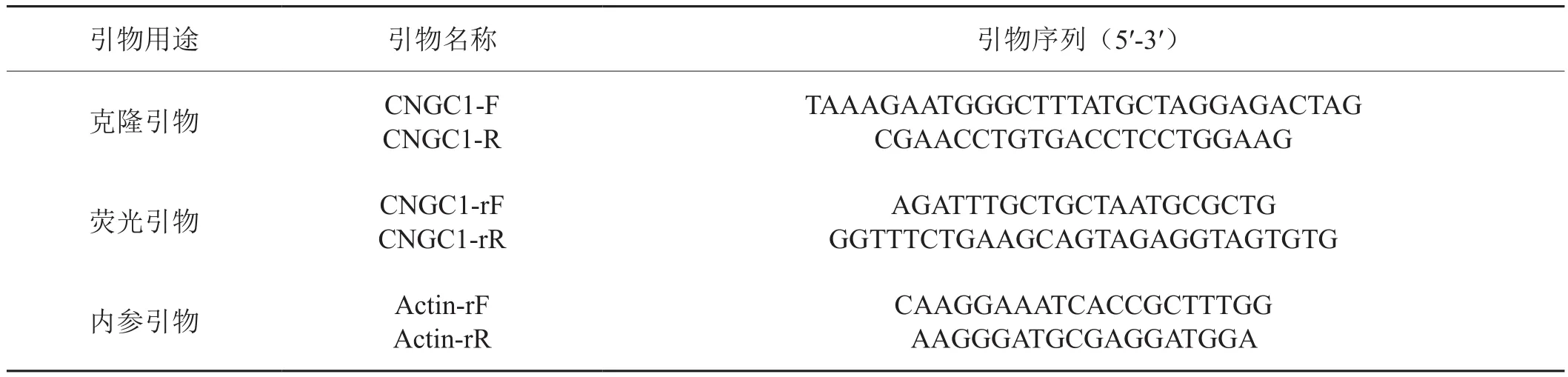
表1 NtCNGC1基因的克隆和表达分析引物Tab. 1 Primers used for cloning and expression analysis of NtCNGC1 gene
2 结果与分析
2.1 NtCNGC1基因的序列特征
分别以烟草基因组DNA和cDNA为模板,用引物对CNGC1-F/CNGC1-R扩增出目的条带(图1)。测序结果表明,NtCNGC1基因组DNA扩增产物长度为6519 bp,cDNA扩增产物长度为2445 bp,其中编码区全长为2154 bp。该基因具有7个内含子,第7内含子最长,为952 bp,第6内含子次之,为659 bp,第2内含子最短,仅86 bp;8个外显子中,第2外显子最长,为565 bp,其次为第7外显子,长度为476 bp,第5外显子最短,仅112 bp(图2)。

图1 烟草NtCNGC1基因的PCR扩增结果Fig.1 PCR amplification results of NtCNGC1 from Nicotiana tabacum
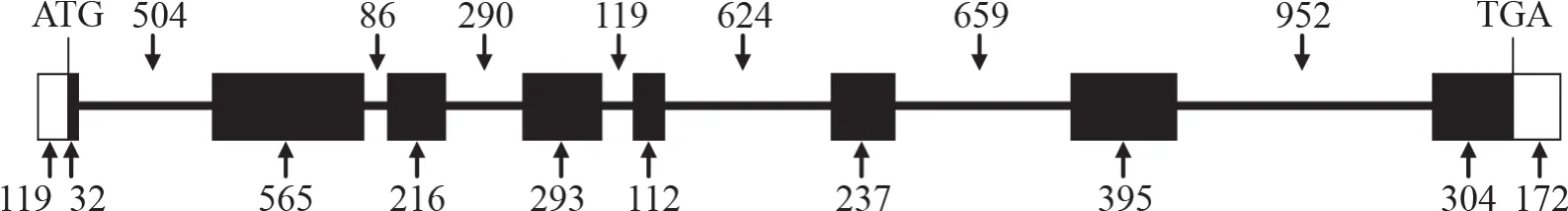
图2 NtCNGC1的基因结构示意图Fig.2 Gene schematic structure of NtCNGC1
2.2 NtCNGC1编码蛋白的特征
NtCNGC1编码717个氨基酸(图3),等电点为9.35,分子量为83 kDa。SMART在线工具检索发现,NtCNGC1编码蛋白有6个保守结构域(图4),分 别 位 于 97~118,133~152,185~207,257~279,380~402和488~619氨基酸残基位置,N端为5个连续的跨膜结构域(Transmembrane region),C端为环化核苷酸结合域(Cyclic nucleotide-monophosphate binding domain,cNMP)。

图3 NtCNGC1的编码区及推导的蛋白质序列Fig.3 Coding sequence and its deduced protein sequence of NtCNGC1
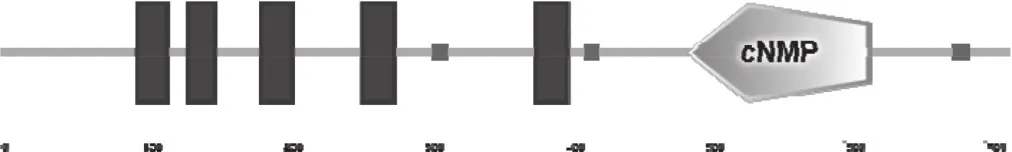
图4 NtCNGC1的保守模体Fig.4 Conserved motifs of NtCNGC1
2.3 NtCNGC1基因的上游启动子分析
启动子预测结果表明,位于NtCNGC1基因起始密码子ATG的5′区上游 1500 bp的启动子核苷酸序列具有多种顺式作用元件(表2),包括与光响应、真菌激发子响应、热响应、干旱响应、伤口响应、水杨酸响应、厌氧诱导、防御与应激反应、病原菌应答、木质部诱导性表达和韧皮部阻遏性表达、代谢调节及器官发育等相关元件。
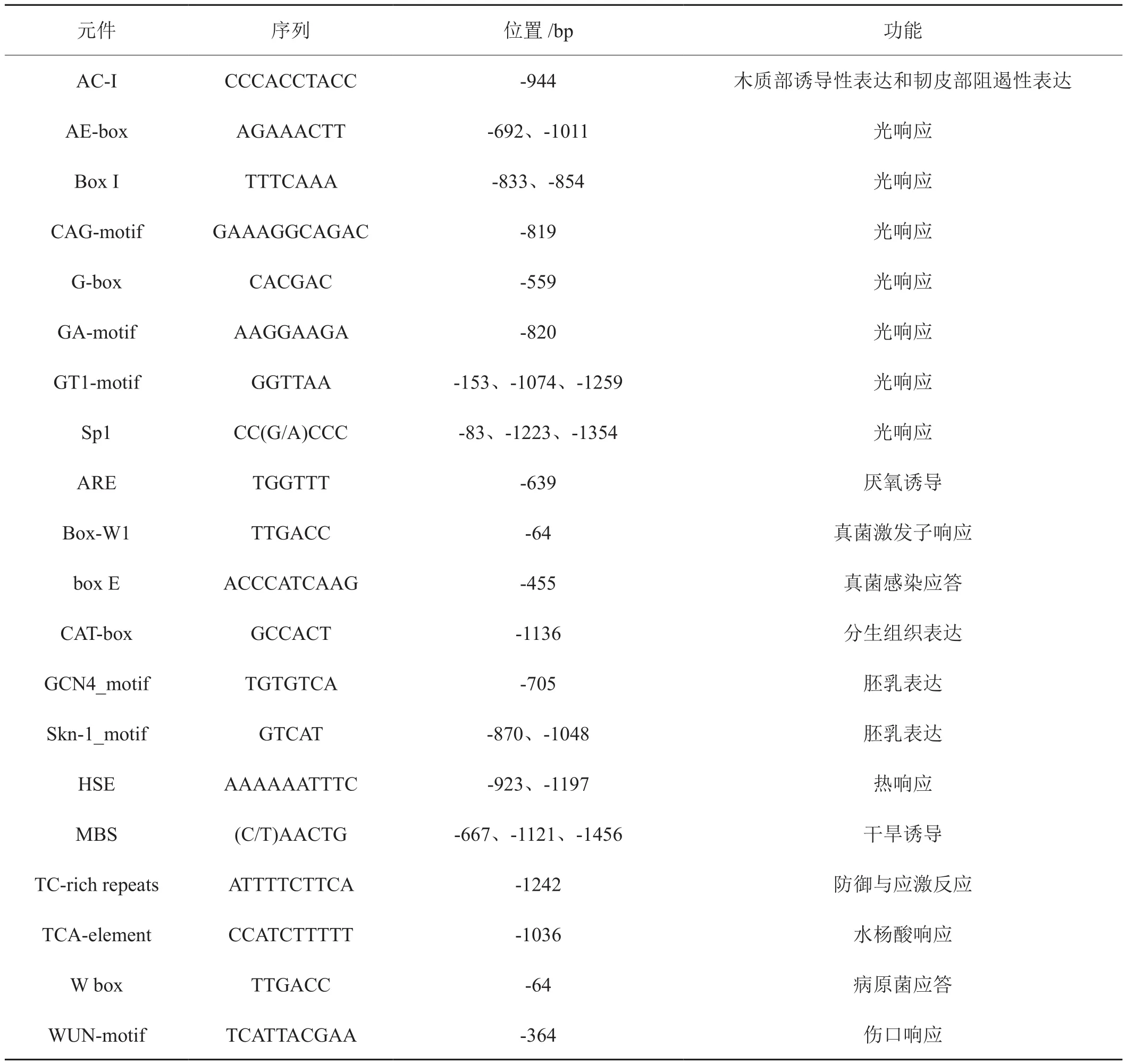
表2 NtCNGC1基因上游调控区顺式作用元件Tab. 2 Cis-elements in the upstream regulation region of NtCNGC1 gene
2.4 NtCNGC1的系统进化分析
根据CNGC序列中的2个功能结构域,比较NtCNGC1与全部拟南芥CNGC蛋白家族成员和部分烟草、大麦、蒺藜苜蓿、水稻中假定的CNGC之间的亲缘关系,结果表明(图5),CNGC 主要分成5个亚组(Ⅰ、Ⅱ、Ⅲ、Ⅳa、Ⅳb),其中,Ⅰ、Ⅱ、Ⅲ亲缘关系很近,它们与另外两个亚组Ⅳa和Ⅳb的关系较远。NtCNGC1与拟南芥抗病正调控因子AtCNGC11、AtCNGC12和AtCNGC11/12嵌合体同属于CNGC家族的第Ⅰ亚组,而拟南芥抗病负调控因子AtCNGC2和AtCNGC4属于CNGC家族的第Ⅳb亚组。
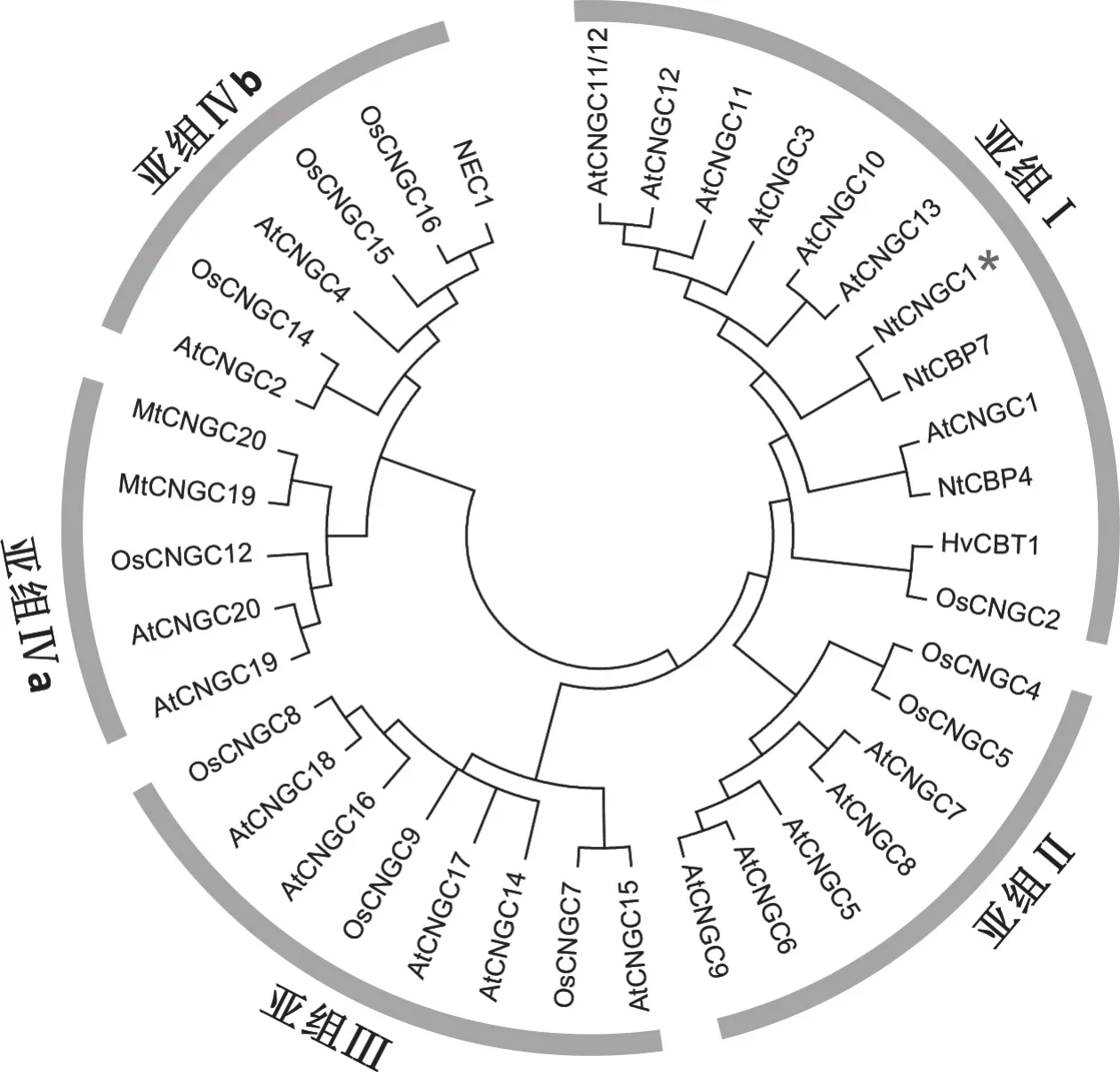
图5 植物CNGCs的系统进化树Fig.5 Phylogenetic tree of plant cyclic nucleotide-gated channels
2.5 NtCNGC1基因的表达分析
为了验证NtCNGC1基因的转录组表达结果,利用荧光定量PCR检测NtCNGC1响应青枯病菌侵染的表达情况。在烟草青枯病菌侵染后,抗病品种DB101中NtCNGC1基因的表达量从3 h 开始就有上调表达趋势,而感病品种红花大金元在12 h才表现出上调表达,且表达量前者明显高出后者(图6),这一表达变化趋势与转录组结果基本一致。荧光定量PCR进一步检测NtCNGC1基因在抗病烟草DB101中的组织表达情况,发现在苗期和旺长期NtCNGC1在根中表达量最高,茎中其次,叶中最低(图7)。
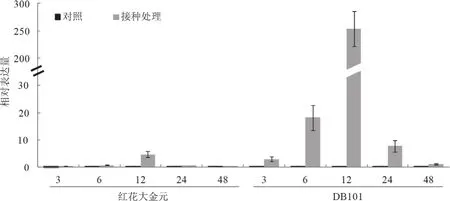
图6 烟草接种青枯病菌病后NtCNGC1基因的表达分析Fig.6 Expression level of NtCNGC1 gene in response to Ralstonia solanacearum
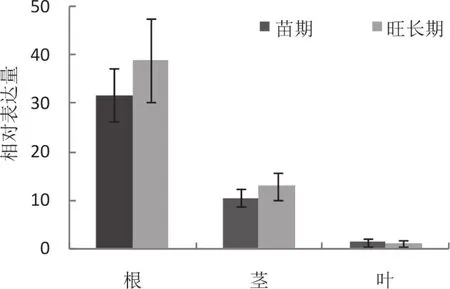
图7 NtCNGC1基因在不同组织中的表达分析Fig.7 Expression level of NtCNGC1 gene in different organs
3 讨论与结论
本课题组在前期烟草响应青枯病菌侵染的转录组研究中发现NtCNGC1基因(XM_016655150)可能参与抵抗烟草青枯菌侵染的防卫反应。为进一步验证NtCNGC1基因的这一功能,本试验克隆了NtCNGC1基因。荧光定量PCR证实NtCNGC1基因在抗病烟草品种DB101中上调表达,而在感病烟草品种红花大金元中无明显表达变化,初步说明NtCNGC1基因在抗病烟草中可以响应青枯菌的侵染。而且NtCNGC1基因的表达具有组织特异性,主要在根中表达,这与青枯菌在烟草根部侵染的特点相吻合。基于上述研究结果推测NtCNGC1是烟草抗青枯病相关基因。
大量研究表明,激素信号在植物抗病反应中具有重要的作用,一些抗病基因通过一个或几个激素信号通路的调控发挥其重要功能[12-13]。本研究结果显示,NtCNGC1基因的启动子区域含有多个与植物抗病或激素应答相关的顺式作用元件,如病原菌应答元件W-Box、真菌诱导元件Box-W1、防御及胁迫响应元件TC-rich repeats、以及水杨酸响应元件TCA-element,暗示NtCNGC1基因可能通过响应水杨酸信号参与烟草对青枯菌的抵御过程。有关CNGC在响应水杨酸信号调控植物防御反应中的作用研究已有报道,Moeder等[14]的研究结果表明,拟南芥AtCNGC2和AtCNGC4的表达受非致病性病原菌Pst DC3000(AvrRps4)和水杨酸的负调控,而拟南芥AtCNGC11和AtCNGC12的表达受非致病性病原菌Pst DC3000(avrRpt2)和水杨酸的正调控,推测前两者在水杨酸和R基因介导的防御信号途径中为负调控因子,而后两者为正调控因子。考虑到烟草NtCNGC1与拟南芥AtCNGC11和AtCNGC12同属于CNGC家族的第Ⅰ亚组,且有报道显示水杨酸诱导烟草对烟草青枯菌的抗性[15-16],推测烟草NtCNGC1基因作为正调控因子参与水杨酸和R基因介导的烟草青枯病抗性。
综上,本研究从烟草中克隆到NtCNGC1,生物信息学和表达分析表明该基因的表达具有组织特异性,并受青枯菌诱导,未来将通过转基因和基因敲除方法对该基因的功能进行验证。
