复合盐处理对烤烟幼苗生理特性的影响
2018-03-18张晓帆李雪利姚鹏伟刘晓涵徐亮焦敬华孙康叶协锋
张晓帆,李雪利,姚鹏伟,刘晓涵,徐亮,焦敬华,孙康,叶协锋
1 河南农业大学烟草学院,国家烟草栽培生理生化研究基地,烟草行业烟草栽培重点实验室,郑州市金水区文化路95号 450002;
2 中国烟草总公司职工进修学院,郑州市鑫苑路7号 450002;
3 中国烟草总公司辽宁省公司,沈阳市沈河区奉天街348号 110062;
4 云南省烟草公司保山市公司,云南省保山市龙阳路4号 678000
土壤盐渍化一直以来都是困扰干旱半干旱地区作物生长和未来农业可持续发展的重要问题。根据全国第二次土壤普查数据显示,我国盐渍土总面积已达到3600万公顷,占全国可利用土地面积的4.88%,其中可耕地面积更是达到920万公顷,占全国耕地面积的6.62%[1],北自辽东半岛,南至广西、广东、海南省和台湾西海岸及南海诸群岛的滨海地带均有盐渍土分布[2],且由于人为不合理灌溉、过度使用化肥以及温室效应等因素影响,盐渍土呈现日趋增加的趋势[3]。植烟地区中也出现不同程度的盐渍化,2004年河南省12个植烟地市有10.23%的土壤样品达到盐渍化水平,部分地区为中度盐渍化,全盐含量高达0.325%[4]。湖南的盐分表聚现象更为严重且日益恶化,2006年湖南4大植烟区的土壤调查显示表层盐分含量平均达到0.491%,最高值为0.750%,达到重度盐渍化水平,2007年的全盐含量更是较2006年上升17.8%[5]。一般情况下,土壤中的致害盐类以中性盐NaCl为主[6],植烟土壤表层盐分离子则主要由构成,施肥及灌溉可以对前3种离子进行调控,但对SO42-效果不明显,且由于K2SO4的连年施用导致其大量堆积[5]。目前盐胁迫对烟草的研究主要集中在NaCl单盐处理[7-8],对复合盐处理的研究较为薄弱。
根系是吸收养分和水分、控制多种物质转化合成的重要器官[9],也是最早感受土壤逆境胁迫信号、最直接的受害部位,其生理形态的变化及活力强弱不仅是植物耐盐性的最直接体现[10],更与地上部的生长状态密切相关[11-12]。但对于盐分胁迫,众多学者的研究通常以地上部为主,鲜有将根系和叶片代谢及衰老联系起来。因此,本研究将复合盐处理下烟苗根系的生长特性与叶片功能衰退的相关指标结合起来进行分析,以期探讨地上、地下部之间的相互调控及作物的整体功能衰退机制,也为进一步探究烟株的耐盐机理提供理论依据。
1 材料与方法
1.1 供试材料
试验于2017年5—7月在河南农业大学国家烟草栽培生理生化研究基地进行。供试品种为烤烟品种中烟100(青岛中烟种子有限责任公司提供)。
1.2 试验设计
采用烟草专用育苗基质进行漂浮育苗,待苗高达到7 cm时进行间苗,再用蒸馏水预培养3d后将装有烟苗的苗盘放到不同质量浓度的n(NaCl)∶n(Na2SO4)=1∶1的复合盐溶液中进行处理,施加人工光源进行培养,温度25~28℃,光强为1500~1800 Lux,光照时长为13 h/d,相对湿度70%~75%。共设CK(蒸馏水)、T1(0.3%)、T2(0.6%)、T3(0.9%)、T4(1.2%)5个处理,每个处理150株烟苗,每天上午9∶00测定盐溶液电导率并补充蒸馏水以保证盐浓度稳定,4 d更换一次处理液。分别在盐处理后0 d、4 d、8 d、12 d、16 d,选取每个处理大小一致的烟苗20株,测定相关指标。
1.3 测定项目及方法
轻轻冲洗根系以去除根系粘附的基质及其他表面杂物,尽可能保持根系的完整性,通过扫描仪(V700 Epson,国家)得到烟株根系形态,采用Win RHIZO PRO 2007根系分析系统软件(Regent Instruments Inc8,Canada)分析根长、表面积、体积及根尖数等形态学参数,称取根尖部分采用TTC染色法测定根系活力[13]。细胞膜透性的测定按Lutts等[14]的方法,叶绿素测定采用酒精提取研磨法[15],丙二醛(MDA)测定采用硫代巴比妥酸法[15],酶活参照文献进行测定[15],脱落酸(ABA)和玉米素核苷ZR的测定选取烟株心叶及根尖参照酶联免疫吸附法(ELISA)[16]。每个处理重复测定3次。
1.4 统计分析
数据采用SPSS 20.0软件进行统计分析,使用Excel 2010作图。
2 结果与分析
2.1 复合盐处理对幼苗叶片细胞膜透性的影响
相对电导率是衡量细胞膜透性大小的指标[17]。从图1看出,各处理相对电导率整体上随时间增加而增大,处理后第4 d各盐处理相对电导率急剧增加,处理T4自37.04%增加至67.27%,增加了30.23%,处理T1较处理前上升了36.69%,即轻度的盐分处理在短时间内对细胞膜也有一定损伤。处理后4~12 d,各处理变化相对平缓,处理后12~16 d,盐处理又呈上升趋势,处理T4的相对电导率高达78.19%。

图1 复合盐处理对幼苗叶片相对电导率的影响Fig.1 Effect of saline stress on the relative conductivity in tobacco leaves
由图2可知,各处理MDA含量均随处理时间延长呈上升趋势,但盐处理与对照之间的差异没有相对电导率明显。处理后第4 d,CK和T1变化不明显,其他处理均有明显升高,其中T1略低于CK,但未达到显著差异;处理后8~12 d,处理间差距逐渐拉大,第12 d处理T4的MDA含量达到46.14 nmol/g,是CK的1.65倍;处理后16 d,各处理均有一定上升,以 T3 的增加幅度最大,T4>T3>T2>T1>CK。

图2 复合盐处理对幼苗叶片MDA含量的影响Fig.2 Effect of saline stress on the MDA content in tobacco leaves
2.2 复合盐处理对幼苗叶绿素含量的影响
由表1可知,各处理的叶绿素a及总叶绿素含量均随时间先升高后下降,叶绿素b含量的变化相对平缓,特别是处理T3、T4的叶绿素b含量仅在0.19~0.29 mg/g浮动。处理后第4 d,CK的叶绿素a、总叶绿素含量均较对照有一定升高,而盐处理T3、T4出现较明显的下降;处理后第8 d,CK、T1、T2的叶绿素a及总叶绿素含量达到最大值,且T2的叶绿素a含量显著高于对照;处理后12~16 d,各处理的叶绿素含量整体上均呈下降趋势。
随着盐浓度的增大,叶绿素a、b及总含量大体上逐步减小,但第4 d处理T1的叶绿素b及第8 d处理T1的叶绿素a、总叶绿素含量均较对照有一定升高,且处理第8 d时处理T1的叶绿素a显著高于对照,即盐处理对叶绿素有一定破坏作用,但低浓度的复合盐处理在一定程度上可以促进叶绿素的合成。此外,处理后12 d,处理T1的叶绿素b含量较CK下降了9.84%,而处理T4较CK下降了54.10%,说明盐胁迫随浓度增大造成的危害远远超过线性增长。叶绿素a/b是展现植物叶片光能活性高低的直接指标[18],分析不同处理时间叶绿素a/b的值发现,盐处理前期T1~T4均低于CK,而处理8 d后,处理T2、T3的叶绿素a/b则明显高于CK,武德等[19]研究得到了相似的结果,认为盐胁迫下植株会降低对光能的吸收并通过提高光能转换效率来保证碳同化,是植株抗盐的表现。
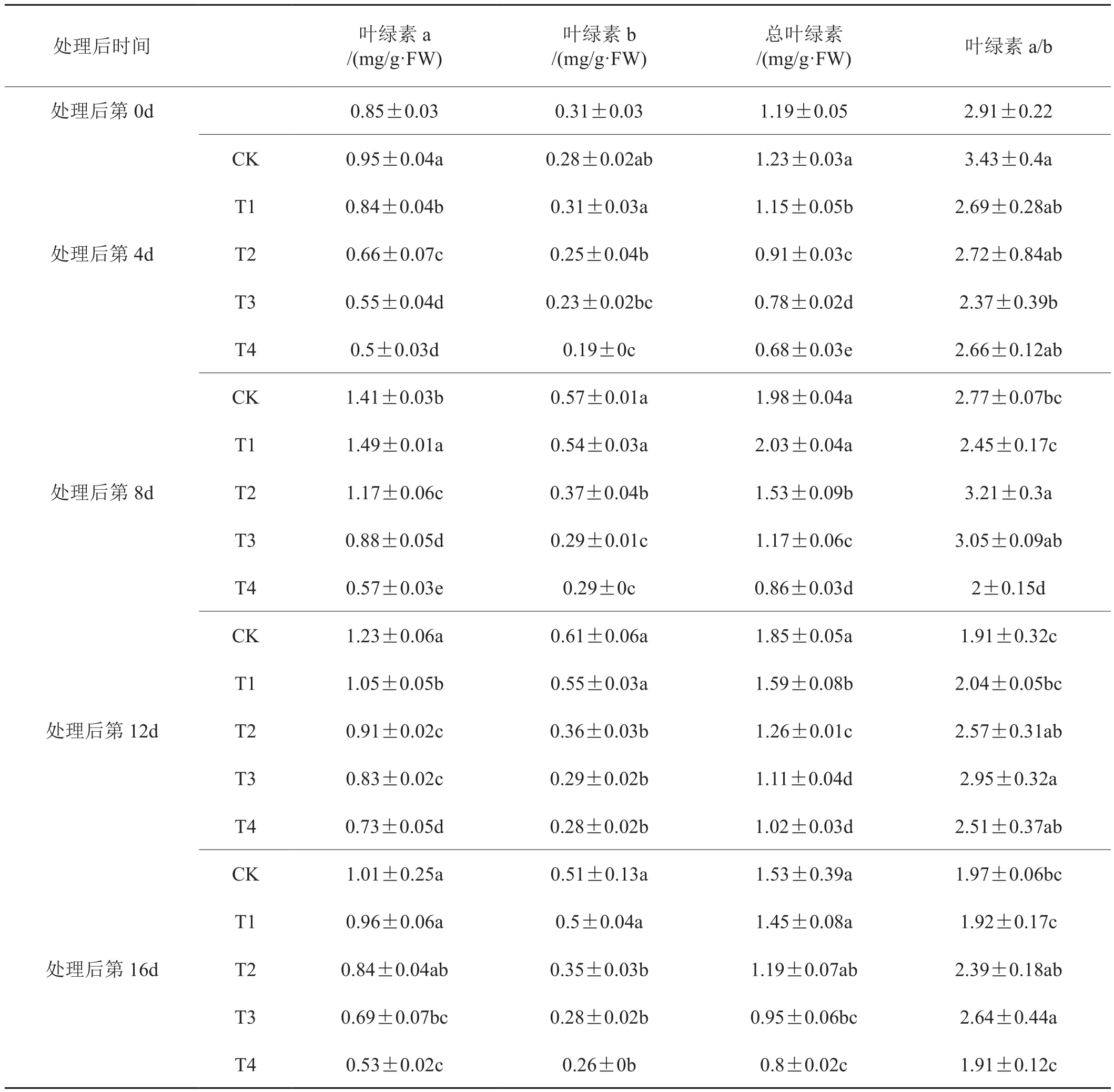
表1 复合盐处理对烟株幼苗叶绿素含量的影响Tab.1 Effect of saline stress on the chlorophyll content of tobacco
2.3 复合盐处理对幼苗根系形态的影响
复合盐处理下幼苗根系生长逐渐被抑制,根长、根表面积等形态学参数均有所变化,处理第12 d时表观形态的差异开始显现(图3)。根系长度能够反映根系在土壤中的伸展空间及接触面积。由图4a可知,各处理总根长随处理时间延长呈现出先增后减趋势,处理后前4 d各处理根长差别不大;4~8 d则快速增长,T1>T2>CK>T3>T4,处理T1增幅最为明显,达到95.21%,总根长为281.53 cm,而处理T4的增长最为平缓且明显低于对照,即高盐处理(1.2%)的胁迫效果在此时已较为明显;12~16 d各处理根长在下降中趋于平缓。
观察图4b,其变化与根长相似,整体呈“马鞍型”变化,但后期下降趋势较为明显。处理8~12 d,处理T1的根表面积明显高于CK,而处理T4在第8 d时仅为16.96 cm2,是CK的60.77%,即复合盐处理对于根表面积表现出明显的“低促高抑”现象;处理后12~16 d,各处理的根表面积急剧下降,处理T1更是从31.38 cm2降至19.48 cm2,下降幅度达37.92%,这表明长时间的盐分处理,即使是轻度盐分处理,也会抑制烟苗的养分吸收能力。

图4 复合盐处理对幼苗根系形态参数的影响Fig.4 Effect of saline stress on the root morphology parameters of tobacco
根系体积的变化如图4c所示,前12 d各处理呈持续增长的趋势,期间处理T1始终高于CK,第8 d时根体积达到0.28 cm3,较CK高12.00%,而其他盐处理的增长随浓度的升高依次减缓,T4的根体积最低,仅为0.13 cm3;12~16 d所有处理的根体积均不断下降。
由图4d可知,复合盐处理T1、T2、T3的根尖数在整个试验期间均高于CK,而T4的抑制效果在处理后8 d就较为明显。处理后第4 d,各处理缓慢增长,处理间差异不明显;处理后4~8 d,除CK和T4增长较为平缓外,其他处理均进入快速增长阶段,第8 d处理T1、T2、T3的根尖数较CK分别增加68.92%、95.56%、92.31%,T4则较CK下降了16.76%;处理后12 d,各处理的根尖数均下降,T4仅为315个。
2.4 复合盐处理对幼苗根系活力的影响
根系活力泛指根系的吸收、合成、氧化和还原能力等[13]。由图5可知,处理后第4 d,CK、T1、T2均有一定升高,处理T3和T4略微下降,各处理根系活力均低于CK;处理后第8 d,T1、T2快速增长,此时T1较CK增加23.49%,根系活力为368.11 μg/(g·h),T2与CK相当,T3、T4的根系活力则明显低于CK;处理后12~16 d,各处理在平缓中下降,处理T1依然较CK保持优势,T3、T4分别降至161.44 μg/(g·h)、116.65 μg/(g·h),仅为CK的53.59%和38.72%。
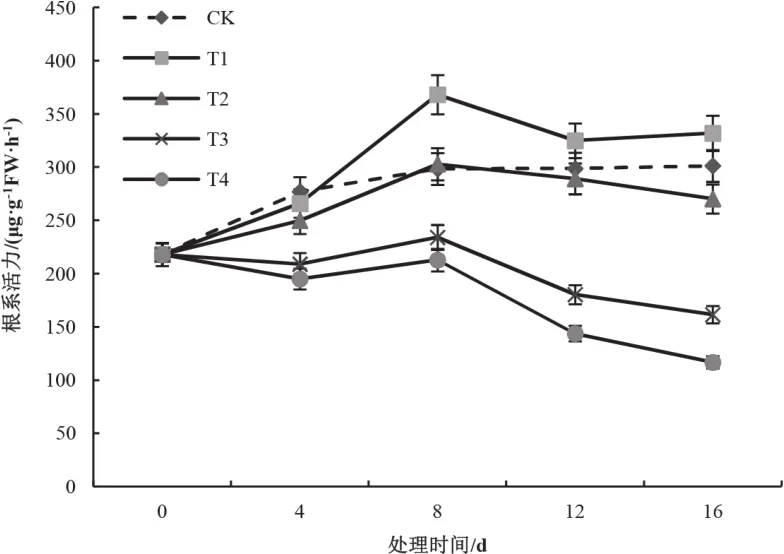
图5 复合盐处理对幼苗根系活力的影响Fig.5 Effect of saline stress on the root activity of tobacco
2.5 复合盐处理对烟株幼苗ABA和ZR含量的影响
ABA可以调控气孔的关闭和基因表达,其信号途径的激活对盐处理下的植物生长有重要意义。图6中复合盐处理下CK的叶片ABA含量在平稳中波动,处于63.80~88.83 ng/g,而盐处理的ABA含量则随处理时间延长逐渐升高。处理后第8 d,CK的ABA含量为68.98 ng/g,其他处理远远高于CK,其中T1、T2、T3相近,T4最大,达到133.09 ng/g;处理后12 d,处理 T3持续升高,T3>T2>T1>T4>CK,此时T3的ABA含量是CK的1.87倍;处理后16 d,除处理T4呈上升趋势外,其他处理均下降。根尖的ABA含量与叶片中略有不同,除T4外其他处理均变化平缓,其中T4在取样期间始终呈上升趋势,处理后期更是显著高于其他处理,处理12 d时 T4>T3>T2>T1>CK,T4的根尖ABA含量达到56.27 ng/g,是CK的2.17倍,而处理后16 d这种差距持续拉大,T4升至77.22 ng/g,为CK的2.64倍。

图6 复合盐处理对幼苗ABA含量的影响Fig.6 Efect of saline stress on the ABA content of tobacco
ZR是一种细胞分裂素,主要通过促进细胞分裂增殖实现细胞数目增多、体积增大,一定程度上也可以促进叶片气孔开放和子叶伸展。处理后第4 d,各处理的叶片ZR含量均有不同程度增加,以处理T3最为明显,较CK增加18.10%,其他处理则低于对照;处理后第12 d,处理T4急剧上升,达到13.87 ng/g,而CK仅为6.38 ng/g,处理T1与CK相近,T2、T3均高于对照;处理后 16 d,T2>T3>T4>CK>T1。相较于叶片,根尖的ZR含量增长更快,相对含量也更高。处理后4~8 d,除处理T1变化较慢外其他处理均明显呈上升趋势,特别是处理T3、T4,第8 d时分别达到8.54 ng/g、11.22 ng/g,较对照升高7.29%、40.95%;处理后8~12 d,CK的ZR增长速度加快,而处理 T4 呈下降趋势,此时 CK>T3>T2>T4>T1;处理后16 d,处理T3的ZR含量也逐步下降,而T1、T2依旧保持增长状态,分别为9.96 ng/g、13.87 ng/g。
2.6 复合盐处理对幼苗抗氧化酶活性的影响
盐处理下叶片超氧化物歧化酶(SOD)活性变化如图8所示,各处理SOD含量均随处理时间增加先升高后降低,且处理浓度越大,SOD活性越高。处理后第4 d,各处理均有一定升高,以处理T4的上升幅度较为明显;处理后第8 d,CK、T1和T2变化相对平缓,T3进入快速上升期,较第4 d上升了25.60%;处理后12 d各处理基本进入下降期,T4>T3>T2>T1>CK。

图7 复合盐处理对幼苗ZR含量的影响Fig.7 Effect of saline stress on the ZR content of tobacco

图8 复合盐处理对幼苗叶片SOD活性的影响Fig.8 Effect of saline stress on the SOD activity in tobacco leaves
盐处理对叶片过氧化物酶POD活性的影响如图9所示,各处理随处理时间延长整体上逐渐上升。处理后第4 d,处理T4快速增加,T3、T2次之,处理T1则较CK没有太大变化,基本保持稳定,此时T4较CK增加137.71%;处理后第8 d,T1进入快速增长阶段,T2和T3也持续升高,CK和T4相对平缓;处理后第12 d,CK有所升高,但仍低于盐处理,处理T4则达到峰值11.82 μg/(g·min);处理后16 d,除T4外其他处理均处于增长阶段,特别是T1、T2快速升高,较处理第12 d分别升高了104.17%和118.80%。

图9 复合盐处理对幼苗叶片POD活性的影响Fig.9 Effect of saline stress on the POD activity in tobacco leaves
复合盐处理下叶片过氧化氢酶CAT活性变化如图10所示,可以看到整个过程中CK变化相对平缓,其他处理变化幅度较大,基本呈先升高后降低趋势。处理后第4~8 d,CK、T1变化较为接近,缓慢上升,T2、T3、T4则快速增高,特别是处理T4更是在处理后第8 d达到117.79 U/(g·min);处理后第12 d,T1、T2较低8d快速增加,分别为93.39 U/(g·min)、112.72 U/(g·min),T4则急剧下降,明显低于处理T2;处理后第16 d,除T1较为平稳外,其他处理的CAT活性均明显下降。

图10 复合盐处理对幼苗叶片CAT活性的影响Fig.10 Effect of saline stress on the CAT activity in tobacco leaves
3 讨论
盐胁迫下幼苗的叶片与根系呈近乎同步的衰老状态,高盐处理下第4 d地上部和地下部较对照均已出现相对明显的差异,在叶绿素含量、叶片的相对电导率及根活等指标上均有体现。随着盐浓度的增加和处理时间的延长烟苗叶片的相对电导率和膜脂过氧化程度均逐渐上升。佘小平等[20]认为这主要是由于盐胁迫造成细胞内无机离子大量累积,活性氧的动态平衡被破坏,进而引发膜脂过氧化,而膜脂过氧化产物又会对防御体系造成破坏,使得膜脂过氧化加剧[21],形成恶性循环。正常条件下活性氧的产生与清除处于动态平衡,而盐处理下该平衡被打破,体内自由基增多,尤其是膜脂中不饱和脂肪酸的双键,易受到自由基攻击[22],使膜的完整性受破坏,导致细胞损伤、代谢紊乱直至死亡。通常认为,SOD是清除活性氧自由基的最重要的关键抗氧化酶,其可以把O2-转变为H2O2,而生成的H2O2则被POD和CAT等酶分解为H2O和O2[23]。本试验中,盐处理下烟苗的抗氧化酶系统POD活性随着处理时间延长逐渐上升,而SOD和CAT则先升高后降低,且降低时间点随盐浓度升高而提前,POD较SOD和CAT表现出更持久的作用。
在膜脂过氧化作用下,叶绿体膜受到氧化胁迫,整体上叶绿素含量呈现出低促高抑的变化趋势。低浓度的盐处理显著提高叶绿素a的含量,可能是由于盐处理下烟株幼苗的叶片伸展受到抑制,使得叶片小而厚从而造成单位质量叶片叶绿素含量增加[24],部分学者认为活性氧也有可能通过阻断光系统Ⅱ(PSⅡ)中的电子传递导致大量的激活态叶绿素累积[25]。针对处理后期叶绿素含量下降的现象,可能是由于盐胁迫下合成叶绿素的必需元素Fe、Mg吸收受阻,从而一定程度上抑制叶绿素的合成[26],而降解酶活性却不断增强[27],使得叶绿素处于分解大于合成的负增长状态,刺槐、绒毛白蜡等[20]非盐生植物都得到了类似的试验结果。
盐处理下烟株根系的变化与叶绿素含量的变化相似,低浓度复合盐处理(0.3%)对烟株的根长、根表面积、根体积及根活等指标在短时间内有一定促进作用,而高浓度盐处理始终抑制烟株根系的生长,且浓度越大处理时间越长,抑制效果就越明显。针对取样前期的促进作用,相关学者认为这是一种缓解盐分胁迫的行为。盐胁迫下植物逐渐失水,为吸收更多的水分,根系就会主动向下延伸,并通过增加根系长度、减小根系直径来减少根系水分吸收阻力[28],Abdolzade等[29]研究表明盐胁迫下直径小于2 mm的细根增加最多,这意味着消耗较少的能量就可以快速扩大根系吸收的范围,从而相对减少盐离子的过度吸收造成的细胞毒害,也从另一个角度解释了低盐处理在8~12 d对根表面积的促进作用。但即使是轻度盐处理,长时间作用也会使得胁迫效果日渐体现,根系生长受到严重抑制,根系吸收能力也显著降低,这是因为烟株缓解盐分的行为也是通过提高代谢作用来进行调节的,即便是有效地利用能量,长时间的呼吸代谢也会消耗过多能量,使得烟株进入“负增长”。
随着盐处理浓度的增加和处理时间的延长,抑制型激素ABA和生长型激素ZR均大量累积,但ZR的含量相对较低。相关学者认为地上部和地下部可以通过内源激素传递调控信息来感知彼此生理状况,并协同抵抗逆境带来的整体衰老。本试验中根尖的ZR含量较叶片相对较高且盐处理在取样后期整体上呈上升趋势,这种浓度差会导致根系的细胞分裂素向叶片传递,而细胞分裂素信号传导途径中的关键调控因子AHKs、CRFs等均可以将信号传导至细胞核,进而激活核内的信号响应因子[30],目前在拟南芥[31]、苹果[32]上均已验证了其对于调节植物衰老及逆境胁迫的重要作用。ABA也是盐胁迫下起重要作用的内源激素,实验发现叶片及重度盐胁迫下的根尖均有大量的ABA累积,它可以参与碳和氮调控,并通过与细胞分裂素和生长素的动态平衡来影响侧根的发育,调控细胞分裂和花芽分化[33],还可以促进脯氨酸前体的转化,通过脯氨酸的积累来减缓渗透胁迫[34]。
4 结论
低浓度的复合盐处理在一定程度上会促进叶绿素的合成,适当的持续盐胁迫可以增加植物对光能的利用效率,对根长、根表面积、根体积及根活等指标等也有促进作用,但随着处理时间延长,这种促进作用逐渐消失,高浓度的盐处理则始终呈现抑制效果。
在高浓度、长时间的复合盐处理下,烟苗呈现出整体功能性衰退,根系及叶片的生长受到强烈抑制,并发生严重的膜脂过氧化。对此,根系产生较高的细胞分裂素并通过浓度差向叶片传递调控信息,在短期内促使叶片中的抗氧化酶系统做出响应,进而减缓盐胁迫对植株的危害,但高盐处理后期响应微弱,应着力探索烟苗在高度盐胁迫下的缓解机制。
