氟离子慢性暴露对中国林蛙蝌蚪生长发育的毒性效应研究
2018-03-16李艳斌柴丽红
李艳斌,柴丽红,*
1. 长安大学 环境科学与工程学院,西安 710054 2. 旱区地下水文与生态效应教育部重点实验室(长安大学),西安 710054
氟是卤族元素之一。由于氟的化学性质活泼,在自然界几乎不以氟单体的形式存在,而是与其他元素结合形成无机和有机氟化物[1]。氟作为一种动物及人体发育必需的微量元素,适量氟摄取有益于龋齿预防和骨骼发育,然而过量氟摄取会对动物及人体健康造成危害[2-3]。自然界地表水中氟离子的浓度通常为“0.0~0.3 mg·L-1”[4],然而金属冶炼、有机肥料的加工、含氟“三废”的排放等人类活动导致水环境中氟含量持续升高[5-8]。有关报道表明,我国部分地下水中氟离子(F-)浓度甚至高达45 mg·L-1[9]。因此,开展水域环境氟污染对水生生物潜在负效应的研究具有重要的意义。
目前,国内外学者针对水域氟污染对水生动物的毒性效应进行了大量研究。Alonso和Camargo[10]的研究表明,水生蜗牛(Potamopyrgusantipodarum)经20 mg·L-1F-暴露后,其游动速度与对照组相比显著降低。Chen等[11]研究了F-对鲤鱼(Cyprinuscarpio)的毒性效应,结果表明,高浓度的F-慢性暴露可抑制鲤鱼的生长发育。此外有研究表明,F-胁迫可导致非洲爪蟾(Xenopus)胚胎发育畸形[12],可抑制中华大蟾蜍(Bufogargarizans)蝌蚪的变态进程[13]。
两栖动物幼体是研究污染物对水环境生物毒性影响的重要生物材料之一。两栖动物的胚胎发育和幼体发育均在水域中进行,其幼体鳃和皮肤的渗透性强,对水域化学污染物极为敏感[14-16]。中国林蛙(Ranachensinensis)广泛分布于我国华北、西北等地,是我国两栖类最具代表性的物种之一[17]。依据Gosner[18]的分期标准,G1~G25为中国林蛙的胚胎发育期,G26~G46为中国林蛙的幼体发育期。已有的研究表明,其幼体对水域多种化学污染物如Pb2+、Cr6+等均比较敏感[19]。我们前期的研究表明中国林蛙胚胎阶段的生长发育或幼体的生长发育、变态等均受到水体氟胁迫的影响[20]。然而,有关中国林蛙自胚胎阶段起持续受到氟污染胁迫对其幼体生长发育、变态及骨骼发育的影响尚未见报道。
本研究以中国林蛙(Ranachensinensis)胚胎为试验对象,按照《化学农药环境安全评价试验准则》和化学品测试方法[21-23]的要求,经不同浓度的F-水体慢性暴露,研究了F-对蝌蚪幼体全长、体长、体重、发育分期的影响以及F-对蝌蚪变态高峰期全长、体长、体重、后肢长、变态率、骨骼发育的影响,旨在为水域氟污染对两栖动物的生态毒理效应研究提供丰富的客观基础资料,为水生生态系统保护和两栖动物水质标准的制定提供科学依据。
1 材料与方法(Materials and methods)
1.1 试验材料
中国林蛙卵于2016年3月采自陕西省西安市秦岭山脉大峪水库附近无污染的小池塘,将卵带回实验室,依据Gosner[18]的分期标准对胚胎进行分期,选取卵黄栓期(G12期)的中国林蛙胚胎作为试验材料。
氟化钠(NaF),分析纯,购自Sigma-Aldrich公司。试验前用蒸馏水配制成1 g·L-1NaF的母液,备用;试验开始时以室温下曝气3 d的自来水稀释为试验所需质量浓度的NaF暴露溶液。
1.2 慢性毒性试验
采用室温下曝气3 d的自来水作为试验用水,水温(20±2) ℃,pH 6.8~7.0,明暗光周期为12 h:12 h。随机将G12的中国林蛙胚胎放入50 cm×20 cm×20 cm(长×宽×高)的玻璃缸中进行暴露处理,每缸盛试验液4 L。依据地表水环境质量标准[24]及环境中F-的赋存浓度,NaF暴露浓度设置为0、1、10、50、100 mg·L-1,各处理组均设置4个平行缸,每缸放入50尾林蛙胚胎。胚胎期间不投食,发育至蝌蚪阶段开始定时投食煮熟的菜叶和蛋黄。为了保证试验浓度的准确性,每48小时更换全部试验液。暴露试验持续至任一处理组中有半数以上的蝌蚪发育至变态高峰期(G42期,前肢伸出期)时终止。
分别于暴露后25 d和40 d时,从各处理组捞取20尾蝌蚪(每缸随机捞取5尾蝌蚪)用多聚甲醛固定,分别测量各只蝌蚪的全长(从吻端至尾端)、体长(从吻端到泄殖腔)、体重、并依据Gosner分期标准对蝌蚪进行发育分期的判断。当蝌蚪发育至G42期时,记录各处理组的变态进程,并对G42期蝌蚪的全长、体长、体重和后肢长进行测量。
1.3 氟离子浓度的测定
慢性暴露试验设置的NaF浓度为0、1、10、50、100 mg·L-1,对应的F-浓度分别为0、0.45、4.52、22.62、45.24 mg·L-1。采用氟复合电极(STISE22, Ohaus Instrument Co. Ltd)测定暴露液中的实际F-的浓度[19],测得0、1、10、50、100 mg·L-1NaF暴露液中的F-浓度分别为:0.4±0.05、0.7±0.14、4.2±0.24、19.4±1.17、42.8±1.36 mg·L-1(n=5)。
1.4 形态指标的测定
采用电子游标卡尺(桂林广陆电子数显游标卡尺,测量范围150 mm,精确度0.01 mm)测定全长、体长和后肢长;用SsrtoriusBS124S型电子天平(精确度0.0001 g)测量蝌蚪体重;于Zeiss Discovery V12型体式显微镜下观察蝌蚪的发育分期。
1.5 骨骼染色
取各处理组中国林蛙G42期蝌蚪各3尾进行骨骼染色。蝌蚪骨骼染色采用改良后的Taylor和Vandyke[25]的方法进行骨骼双染色,经茜素红(alizarin red)和阿利新兰(alcian blue)染色后,再经甘油透明,双染色骨骼标本硬骨呈紫红色,软骨呈蓝色。用Zeiss Discovery V12型体式显微镜观察,佳能7 D数码相机进行图像采集。本实验中骨骼名称均采用Pugener和Maglia[26]等的骨骼术语进行描述。
1.6 数据处理
实验数据采用SPSS 22.0软件处理。运用单因素方差分析(One-way ANOVA)比较各处理组蝌蚪的全长、体长、体重及后肢长的差异;通过Mann-Whitney U-test比较各处理组蝌蚪的发育分期;通过Kaplan-Meier曲线描述了各处理组蝌蚪的累积变态率。数据以平均值±标准差(X±SD)表示,P<0.05、P<0.01表示有显著性差异。
2 结果(Results)
2.1 F-慢性暴露对中国林蛙蝌蚪生长发育的影响
中国林蛙G12期胚胎经不同浓度F-慢性暴露25 d和40 d后,各处理组蝌蚪的生长发育指标分别见图1、图2。慢性暴露25 d后,与对照组相比,4.2 mg·L-1F-处理组蝌蚪的全长、体长和体重均显著增加(P<0.01),而发育分期并未受到显著影响(P>0.05)。然而,42.8 mg·L-1F-处理组蝌蚪的全长、体长、体重和发育分期均显著低于对照组(P<0.01、P<0.05)(图1)。
慢性暴露40 d后,与对照组相比,0.7 mg·L-1F-和4.2 mg·L-1F-处理组蝌蚪的全长、体长、体重和发育分期各指标均无显著差异;而19.4 mg·L-1F-和42.8 mg·L-1F-处理组蝌蚪的全长、体长、体重和发育分期均受到显著抑制(P<0.05、P<0.01)(图2)。
2.2 F-慢性暴露对中国林蛙蝌蚪变态率的影响
Kaplan-Meier曲线描述了不同F-浓度处理组林蛙蝌蚪的累积变态率(图3)。当慢性暴露试验进行到60 d时,对照组、0.7 mg·L-1F-和4.2 mg·L-1F-处理组中开始有蝌蚪发育至G42期,而19.4 mg·L-1F-和42.8 mg·L-1F-处理组G42期蝌蚪的出现较对照组分别延迟了1 d和2 d(图3A)。当试验结束时(F-慢性暴露78 d),对照组、0.7、4.2、19.4和42.8 mg·L-1F-处理组的变态率分别是43.75%、45%、50%、31.25%、18.75%(图3B);即与对照组相比,0.7 mg·L-1F-处理组蝌蚪的变态率未受到显著影响(P>0.05),4.2 mg·L-1F-处理组蝌蚪的变态率显著升高(P<0.05),而19.4 mg·L-1F-和42.8 mg·L-1F-慢性暴露显著抑制了林蛙蝌蚪的变态率(P<0.05)(图3B)。

图1 不同浓度F-暴露25 d时对中国林蛙蝌蚪生长和发育的影响注:星号表示与对照组相比存在显著差异(* P<0.05,** P<0.01);数据表示X±SD,n=20,下同。Fig. 1 Effects of fluoride exposure on growth and development of R. chensinensis tadpoles on day 25 after fluoride treatment at various concentrationsNote: Asterisk indicate significant difference between the treatments and the control (* P<0.05, ** P<0.01). Bars represent the mean values±SD (n=20). The same below.

图2 不同浓度F-暴露40 d时对中国林蛙蝌蚪生长和发育的影响Fig. 2 Effects of fluoride exposure on growth and development of R. chensinensis tadpoles on day 40 after fluoride treatment at various concentrations
2.3 F-慢性暴露对中国林蛙G42期蝌蚪形态指标的影响
各处理组G42期蝌蚪形态指标的测量结果见图4。如图4所示,经F-慢性暴露后,仅42.8 mg·L-1F-处理组蝌蚪的全长较对照组显著降低(P<0.01),而其他各处理组蝌蚪的全长与对照组相比均无显著变化(P>0.05);各处理组蝌蚪的体长和后肢长均受到显著抑制(P<0.05);此外,4.2 mg·L-1F-和19.4 mg·L-1F-处理组蝌蚪的体重较对照组显著降低(P<0.05)。
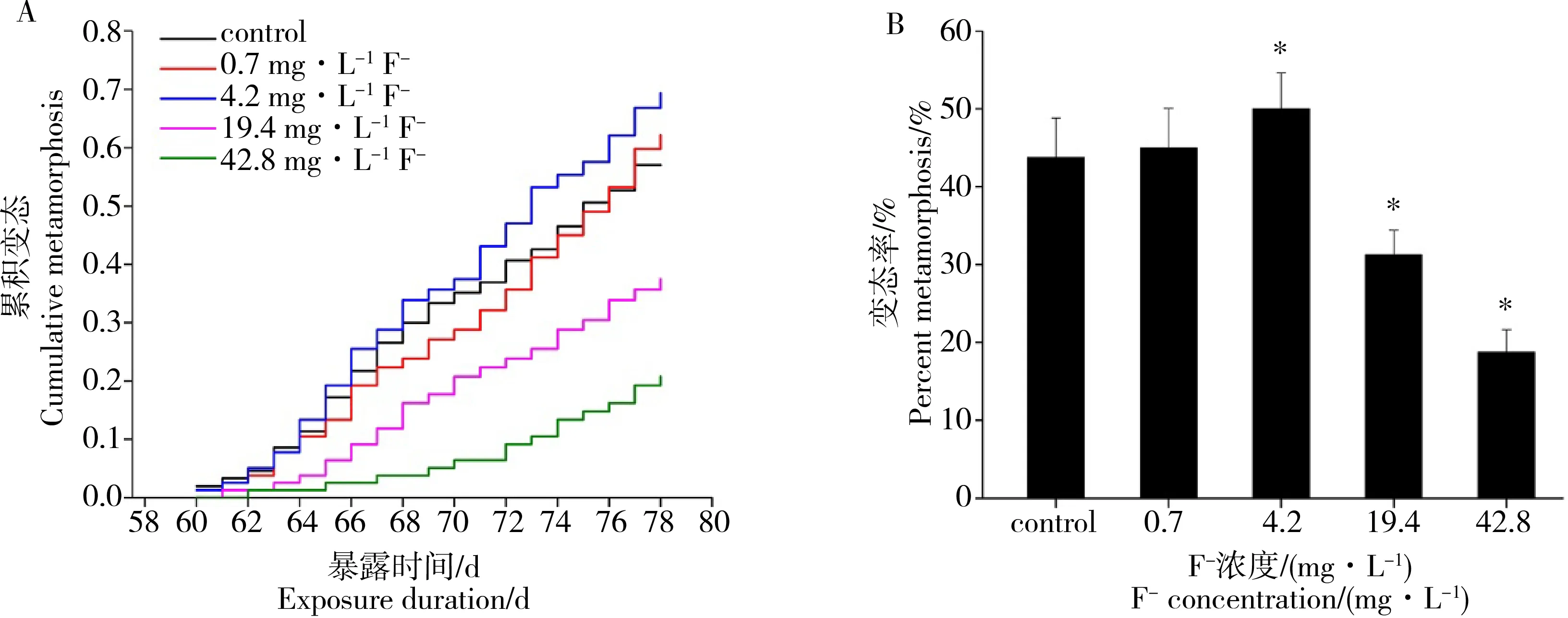
图3 不同浓度F-慢性暴露对中国林蛙蝌蚪变态率的影响Fig. 3 (A) Time course of cumulative metamorphosis percent (-ln scale) by the Kaplan-Meier analysis in R. chensinensis tadpoles exposed to control and different concentrations of F-(B) Percent metamorphosis of R. chensinensis tadpoles exposed to control and different concentrations of F- at the end of the experiment (on the 78 day)

图4 不同浓度F-暴露对中国林蛙G42期蝌蚪生长和发育的影响Fig. 4 Effects of fluoride exposure on size of R. chensinensis tadpoles at stage G42 after fluoride treatment at various concentrations
图5所示为各处理组G42期蝌蚪形态指标比。结果表明,经F-慢性暴露后,与对照相比,0.7 mg·L-1F-和4.2 mg·L-1F-处理组全长/体长显著增加(P<0.05),体重/体长则显著降低(P<0.01);此外,4.2、19.4、42.8 mg·L-1F-各处理组后肢长/体长均显著降低(P<0.01),42.8 mg·L-1F-处理组的体重/后肢长较对照组显著升高(P<0.05)。
中国林蛙蝌蚪幼体经过78 d的氟离子慢性暴露以后,依据G42期中国林蛙蝌蚪的体长、体重和后肢长等生长指标和变态率为观察指标。经过统计分析,与对照组相比,0.7 mg·L-1F-处理组的体长和后肢长均受到显著抑制(P<0.05)。因此,中国林蛙蝌蚪幼体的78 d生长毒性最低可观察效应浓度(LOEC)为0.7 mg·L-1。
2.4 F-慢性暴露对中国林蛙G42期蝌蚪骨骼发育的影响。
采用改良后的骨骼双染色方法对中国林蛙G42期蝌蚪进行骨骼染色,经双染色后的骨骼标本硬骨呈紫红色,软骨呈蓝色,结果见图6。如图6所示:与对照组相比,19.4 mg·L-1F-处理组蝌蚪的副碟骨、喙上骨和额顶骨的骨化程度更好(图6-4b),而0.7、4.2和42.8 mg·L-1F-处理组蝌蚪的喙上骨和额顶骨的骨化程度均受到不同程度的抑制(图6-2b,图6-3b,图6-5b)。此外,42.8 mg·L-1F-处理组蝌蚪的脊柱骨化程度受到明显抑制(图6-5c),而其他处理组蝌蚪的脊柱骨化并未发生明显变化(图6-2c,图6-3c,图6-4c)。
中国林蛙蝌蚪肩带和前肢主要由肩胛骨、肱骨和桡骨组成。与对照组相比,42.8 mg·L-1F-处理组蝌蚪的肩胛骨、肱骨和桡骨骨化程度受到明显抑制(图6-5d),其他处理组蝌蚪的肩胛骨、肱骨和桡骨骨化程度并未发生明显变化(图6-2d,图6-3d,图6-4d)。中国林蛙蝌蚪腰带和后肢主要由髂骨、股骨和胫腓骨组成。0.7、4.2和19.4 mg·L-1F-处理组蝌蚪的髂骨、股骨和胫腓骨的骨化程度并未发生明显变化(图6-2e,图6-3e,图6-4e),而42.8 mg·L-1F-处理组蝌蚪的髂骨、股骨和胫腓骨的骨化程度受到一定抑制(图6-5e)。
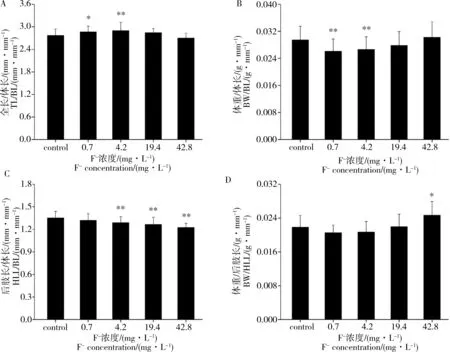
图5 不同浓度F-慢性暴露对中国林蛙蝌蚪G42期形态指标比的影响Fig. 5 Effects of fluoride exposure on body index ratios of R. chensinensis tadpoles at stage G42 after fluoride treatment at various concentrationsNote: (A) The ratio of total length to body length (TL/BL), (B) the ratio of body weight to body length (BW/BL), (C) the ratio of hind-limb length to body length (HLL/BL) and (D) the ratio of body weight to hind-limb length (BW/HLL).
3 讨论(Discussion)
动物生长发育的变化是表征污染物毒性效应的重要指标之一。本试验中,当中国林蛙G12期胚胎经F-慢性暴露25 d时,4.2 mg·L-1F-处理组蝌蚪的全长、体长和体重均较对照组显著升高,但当暴露时间延长到40 d时,这种促进效应并未延续。我们之前的研究表明,中国林蛙G26期蝌蚪经4.1 mg·L-1F-慢性暴露15 d和30 d时,蝌蚪的生长发育均未受到显著影响[20]。分析认为,这种差异可能是由于蝌蚪所处发育阶段不同,不同生理特性导致了其对化学污染物敏感性的差异[27-28]。此外,本研究中,F-慢性暴露25 d时,仅42.8 mg·L-1F-处理组蝌蚪的全长、体长、体重和发育分期受到显著抑制,而暴露至40 d时,19.4 mg·L-1F-和42.8 mg·L-1F-处理组蝌蚪的全长、体长、体重和发育分期均受到显著抑制。我国制定的地表水氟离子环境质量标准为1.5 mg·L-1。由实验结果可见,在标准范围内F-暴露浓度对林蛙蝌蚪的生长发育并未造成不利的影响,然而,高于该标准的F-暴露对林蛙蝌蚪的生长发育具有一定的抑制作用。以往的大量研究都表明,氟化物暴露可抑制水生动物的生长发育[29-30],氟暴露导致的生长抑制可能与机体的代谢功能受到抑制有关[31-32]。
变态是无尾两栖动物生活史的一个重要环节,变态率的高低直接影响着陆生成体蛙的数量[33]。本研究结果表明,经4.2 mg·L-1F-慢性暴露后,中国林蛙蝌蚪的变态率显著升高,而19.4 mg·L-1F-和42.8 mg·L-1F-慢性暴露导致中国林蛙蝌蚪变态率的显著降低。该结果表明,适量的F-暴露能促进两栖类动物的变态,而过量的F-则抑制两栖类动物的变态,这与我们之前的报道相一致[19]。但不同两栖类物种或不同发育阶段幼体经F-暴露后,其变态率对F-的响应浓度不同[34]。目前,关于氟离子对两栖动物变态率的影响机制尚不明确。推测可能由于适量F-有益于动物的生长发育,进而促进了蝌蚪的变态[35]。另外,两栖动物变态过程是由甲状腺激素所严密调控的[36],高浓度F-暴露导致蝌蚪变态率的下降可能是由于机体甲状腺激素的动态平衡受到了干扰[13]。
此外,本研究结果显示,42.8 mg·L-1F-慢性暴露导致了中国林蛙变态高峰期蝌蚪的全长、体长和后肢长的显著降低。大量的研究表明,变态个体小的幼体死亡率较高[37-39],而且个体小的幼体脂肪存量不足,可导致过冬存活率降低及其发育成熟和初次繁殖时间的推迟[40]。另外,42.8 mg·L-1F-处理组变态高峰期蝌蚪的体重与后肢长比值较对照组相比显著升高,显然,这将不利于中国林蛙蝌蚪登陆后的跳跃,可能会导致其在自然环境中被捕食风险的增加[41]。这些不利因素都将最终导致两栖动物种群数量的下降[42]。因而,高浓度F-慢性暴露对中国林蛙蝌蚪变态登陆后的健康具有潜在的不利影响。
两栖类变态过程中骨骼的骨化是两栖动物骨骼重构的重要一环,目的是通过增加骨密度来增强支撑能力,从而适应从水生到陆生生活方式的转变[43]。本研究中,42.8 mg·L-1F-处理组中国林蛙变态高峰期蝌蚪的后肢髂骨、股骨和胫腓骨的骨化程度受到一定的抑制,加之其后肢长也显著降低,这可能会对中国林蛙蝌蚪的游动能力和登陆之后的跳跃能力造成不利影响[44]。一般认为,骨骼骨化受甲状腺激素调控[45-46]。Zhao等[13]的研究表明,50 mg·L-1NaF慢性暴露可导致中华大蟾蜍蝌蚪的骨化受到明显抑制,并指出氟离子可以通过影响脱碘酶基因的表达和甲状腺滤泡上皮细胞高度等干扰甲状腺激素的动态平衡,最终导致蝌蚪骨化不完全。
总之,水域氟污染长期胁迫可对中国林蛙蝌蚪的生长发育指标、变态和骨骼骨化造成不利影响,主要表现为高浓度F-水体暴露会显著抑制蝌蚪的生长发育,并导致变态率下降、变态高峰期个体小、以及蝌蚪骨骼骨化程度的下降。氟离子暴露对这些指标的不利影响可能会造成中国林蛙蝌蚪变态后登陆个体死亡率的增加,最终导致中国林蛙种群数量的下降。
