不同价态无机砷对罗非鱼肝脏砷积累及GSH/GST解毒代谢的影响
2018-03-16裴佳范文宏董兆敏
裴佳,范文宏,2,*,董兆敏,2
1. 北京航空航天大学,空间与环境学院,北京 102206 2. 北京航空航天大学,医工交叉北京市高精尖创新中心,北京 100191
水体中无机砷具有低浓度、高毒性、价态多变、难降解等特征,其会通过影响代谢酶、脂质过氧化、基因损伤、基因表达等方面对水生生态系统产生危害。水生生物可以通过水相吸收和食物相暴露2种途径对砷进行富集[1]。现有研究已经表明一些主要的水生动物类群,比如捕食者(鱼类、腹足类)和食底泥动物,摄食已经成为其富集砷的重要方式[2]。Cockell等[3-4]发现食物中较低浓度的砷(如100μg·g-1)就会对虹鳟鱼幼鱼(juvenile rainbow trout)的生长和营养盐的吸收造成影响。Zhang等[5]发现无机砷食物相暴露黑鲷和花身鯻(seabreamAcanthopagrusschlegelii和gruntTeraponjarbua)28 d后肝脏中砷积累量增加,明显高于肌肉和肠道中的积累量。并且食物相砷暴露能引起肝脏中谷胱甘肽巯基转移酶(GST)活性和谷胱甘肽(GSH)含量发生改变,从而影响生物体内的氧化应激反应。因此研究水体中砷通过摄食途径进入生物体的积累和毒性效应对砷生态风险评估非常重要。
含砷食物进入生物体后,可以经消化系统吸收,随血液分布到全身各组织和器官[6]。一系列研究表明无机砷暴露后肝脏是砷的主要负载器官,累积显著高于其他组织[7-9],同时肝脏是无机砷甲基化生成一甲基砷、二甲基砷,且进一步生成砷甜菜碱的主要场所[10],因此在无机砷暴露情况下肝脏是重要的研究对象。砷的毒性机制研究主要集中在甲基化代谢、氧化应激、细胞毒性等方面[11-13],然而这些机制都与生物体的氧化与抗氧化平衡有关。生物体内存在清除活性氧和自由基的抗氧化体系,包括酶系(如GST)和非酶系(如GSH)两大类。有研究表明,金鱼肝脏主要通过GSH和抗氧化酶的适应性变化来应对砷诱导的氧化应激[14]。GSH可直接与亲电子剂反应或作为辅助因子参与反应,在砷解毒过程中发挥重要作用[15]。长期慢性砷暴露可引起机体GSH水平下降,而急性砷暴露则能够引起GSH水平升高,表明生物体中GSH含量水平是决定其对砷敏感性的重要因素之一,但这种应激性反应的机制尚未完全阐明[16]。GST可通过催化降低砷的活性、加速其排泄,以达到解毒的效果,并且GST还能代谢小分子量的过氧化物,保护细胞不受活性氧自由基的损害[17-19]。另一方面污染物的胁迫可以影响生物体内GST基因的表达,从而改变其活性[20]。Zhang等[6]研究发现,牡蛎(oyster)暴露于无机砷一个月后,GST活性比空白组高。Ku等[21]的研究也表明当黄鲶鱼暴露于污染物时,GST等酶活性发生变化。目前大量的研究都主要集中在砷暴露过程中GSH含量和GST活性的研究,但对生物体内砷的积累量与它们两者之间的关系,以及GSH和GST在抗氧化反应过程中的具体作用关注较少。
罗非鱼作为一种重要的淡水产品,是我国的主要食用鱼种之一。罗非鱼通过食物相摄取砷在砷污染区是十分常见的[22]。因此本研究以罗非鱼为模式生物,通过食物相暴露,测定分析食物相暴露过程中罗非鱼肝脏中砷的累积量、GSH含量和GST活性,以探讨砷在体内的累积和GSH含量、GST活性的关系,从而为探究砷胁迫下体内抗氧化应激反应的过程和机理提供数据和理论参考。
1 材料与方法(Materials and methods)
1.1 罗非鱼暴露实验
从北京市小汤山鱼场购买体长(8.7~9.1 cm)、体重(20~22 g)的罗非鱼(Oreochromisspp)鱼苗,在实验室内用罗非鱼专用饲料(友谊恒远科技有限公司)喂养,使其适应实验室的环境,健康生长。饲养30 d饥饿48 h后,对它们进行为期32 d的食物相暴露。用NaAsO2和Na2HAsO4·7H2O固体(优级纯,美国Sigma-Aldrich公司)配制As(III)和As(V)溶液,充分浸泡人工饲料,浸泡后放入真空干燥箱(DZF-6050,上海精宏实验设备有限公司,上海)内60 ℃条件下烘干至恒重,使As(III)和As(V)标记人工饲料中砷含量分别为(752.0±12.8)μg·g-1、(800.5±15.3)μg·g-1。将制得的人工饲料储存在4 ℃的冰箱中备用。罗非鱼暴露在3个体积为120 L的鱼缸中,每缸50条,用加热棒加热使水体温度保持在25 ℃,光照和黑暗的时间为12 h∶12 h,每天按照罗非鱼体重的3%投喂人工饲料,2 h后进行换水从而除去没有被完全吃掉的食物,在第2天的早上清除罗非鱼的排泄物。在暴露后的0、2、4、6、8、10、13、16、20、24、28和32 d,从各处理组中随机取6只罗非鱼,于低温下解剖取出肝脏,用于后续的砷积累量、GSH含量以及GST活性测定。
1.2 罗非鱼肝脏内砷积累量的测定
取适量(0.5~1.0 g)上述罗非鱼肝脏,利用冷冻干燥机(Christ ALPHA 1-2 LD plus,上海亘先实业有限公司,德国)干燥10 h至恒重后,称量干重0.05~0.1 g并转移至15 mL的离心管中,依次加入2 mL浓硝酸和0.5 mL双氧水,在120 ℃的条件下消解至澄清透明,冷却至室温后,使用超纯水定容至5 mL。用电感耦合等离子体质谱仪(ICP-MS,Thermo iCAP Q,美国)测定消解液中砷的浓度。测定过程中采用BCR-627金枪鱼标准物作为质量控制样品,其中含砷总量为(4.9±0.3)μg·g-1,回收率为94%~103%。
1.3 罗非鱼肝脏中GSH含量和GST活性的测定
称量湿重为0.01 g的罗非鱼肝脏沥干水分放入离心管中,向离心管中加入1.0 mL预冷的匀浆液(0.25 mo1·L-1蔗糖、0.l mo1·L-1Tris-HCl、pH=8.6缓冲液),在冰浴中用超声波匀浆破碎仪(新芝生物科技公司,SCIENTZ-II D)进行破碎,高速冷冻离心机(CF16RX,HITACHI公司,日本)0 ℃、16 000 g离心20 min后,取上清液0.2 mL。采用南京建成生物工程研究所市售的GSH测试盒,根据GSH巯基可以与二硫代二硝基苯甲酸发生反应,生成一种黄色的化合物,从而通过测定该物质在420 nm处的吸光度,并与标准物质比对,得到样品溶液中GSH的含量,GSH的含量以单位质量蛋白(mg prot)的GSH质量(mg)表示。用GST测试盒,根据GSH与1-氯-2,4-二硝基苯的结合反应,在一定的反应时间内,酶的活性与反应前后底物的浓度变化显著相关,从而通过测定412 nm波长下GSH的浓度来表示GST酶的活性,GST的活力以单位质量蛋白(mg prot)的活力单位(U)表示。
1.4 数据处理
实验数据均以平均值±标准差(Mean ± SD)表示,实验数据利用SPSS 13.0软件进行统计分析,利用单因素方差分析(One-way AVONA)和Duncan检验法在P=0.05的置信水平对组间数据进行差异显著性分析,并用回归分析方法作相关性分析。
2 结果(Results)
2.1 罗非鱼肝脏中砷的含量
As(III)和As(V)食物相暴露32 d过程中罗非鱼肝脏中砷的积累量如图1所示。经As(III)和As(V)食物相暴露后,肝脏中的总砷含量均显著增加,与空白组有显著性差异。As(III)食物相暴露情况下,砷含量在2 d内显著增加达到(11.15±0.51)μg·g-1,而在随后的30 d暴露期内,其积累量无显著性差异,趋于稳定。As(V)食物相暴露的条件下,随着时间的增长,罗非鱼肝脏中砷含量逐渐增加,在20 d时达到最大值(26.2±0.48)μg·g-1,显著高于As(III)的最高累积量。24 d时显著下降为(14.39±3.18)μg·g-1,而后砷积累量无显著性差异。在为期32 d的As(III)和As(V)食物相暴露过程中,肝脏中的积累量表现出了不同的趋势,As(III)暴露情况下积累量快速达到平衡。在暴露初期,As(III)食物相暴露积累量高于As(V),后期As(V)高于As(III)。
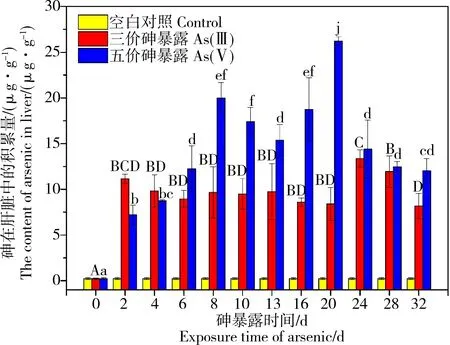
图1 As(III)和As(V)食物相暴露32 d中罗非鱼肝脏中砷的积累量注:图中不同字母代表组间具有显著差异。Fig. 1 Bioaccumulation of total arsenic in liver in different exposure time of tilapia during 32 d exposure to As(III) and As(V)Note: different letters represent significant differences between groups.
2.2 肝脏中GSH含量及GST活性
32 d无机砷食物相暴露过程中罗非鱼肝脏中GSH含量及GST活性如表1所示。GSH背景含量约为(25.44±3.46) mg·g-1prot。经As(III)和As(V)暴露0~2 d后GSH含量分别增加为(33.77±3.35) mg·g-1prot和(38.77±3.11) mg·g-1prot,表明急性砷暴露能引起肝脏GSH含量的显著升高。As(III)食物相暴露2~6 d后GSH含量降低到(21.22±2.03) mg·g-1prot,下降了37.1%;6 d后含量又逐渐升高,在13 d含量达到最大值(37.41±3.25) mg·g-1prot,13 d后GSH含量均低于空白组。As(V)食物相暴露2~4 d后GSH含量降低,4~16 d后GSH含量增加且16 d达到最大值(41.02±4.67) mg·g-1prot,16 d后GSH含量均低于空白组。总体而言,As(III)和As(V)食物相暴露过程中,GSH含量呈现了先增加后降低最后趋近稳定的变化趋势,表明在短期暴露内GSH含量增加用来拮抗砷的毒性,随着时间的增加,GSH被大量消耗,含量降低。
空白组GST活性为(114.94±14.54) U·mg-1prot。As(III)食物相暴露0~6 d后GST被诱导合成,其活性均大于空白组,6~8 d时GST活性降低,8 d后活性增加,32 d达到最大值(190.77±20.49) U·mg-1prot。As(V)食物相暴露0~8 d后GST被大量诱导合成,8~20 d后GST合成被抑制,20 d后活性增加,在32 d达到最大值(195.6±25.15) U·mg-1prot。无机砷食物相暴露过程中,GST活性呈现先增加后降低又增加的趋势,表明在急性暴露过程中,GST被诱导合成来催化GSH与砷的结合,随着暴露时间的增加,酶的活性受到了抑制,在暴露的后期生物体通过自身调节等的作用,GST活性增大。
2.3 砷累积量和肝脏中GSH含量及GST活性的关系
32 d的As(III)食物相暴露过程中,随着罗非鱼肝脏中砷积累量的增加,As(III)暴露组GSH含量升高,各时间点肝脏中砷的积累量与GSH含量之间呈正相关(y=1.492x+9.177),如图2(A)所示。而32 d的As(V)食物相暴露过程中,各时间点肝脏中砷的积累量与GSH含量之间没有相关关系,如图2(B)所示,原因可能是As(V)暴露时砷的累积量在暴露初期一直在缓慢上升,而对应的GSH含量却很快达到了高点,随后缓慢下降。

表1 暴露过程中罗非鱼肝脏中GSH含量和GST活性Table 1 The GSH content and GST activity in tilapia liver during exposure
注:GSH表示谷胱甘肽;GST表示谷胱甘肽巯基转移酶;*与空白组比较有显著性差异。
Note: GSH represents glutathione; GST represents glutathione S-transferase; * represents significant differences compared with blank group.

图2 三价砷(A)和五价砷(B)食物相暴露各时间点肝脏中砷的积累量与GSH含量的相关性Fig. 2 The relationship between arsenic accumulation and GSH content during 32 d As(III) exposure (A) and As(V) exposure (B)
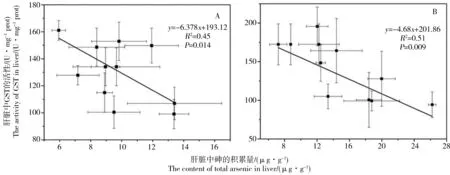
图3 三价砷食物相暴露各时间点肝脏中砷的积累量与GST活性的相关性(A);五价砷食物相暴露各时间点砷的积累量与GST滞后一个时间点的活性相关性(B)Fig. 3 The relationship between arsenic accumulation and GST activity in same time point during 32 d As(III) exposure (A); the correlation between the arsenic accumulation and GST activity in next time point during 32 d As(V) exposure (B)
As(III)食物相暴露32 d内各时间点肝脏中砷的积累量与GST活性呈显著负相关,如图3(A)所示。而对于As(V)食物相暴露,32 d内各时间点肝脏中GST活性与积累量具有滞后一个时间点的负相关性,如图3(B)所示。这两者均表明GST对砷在生物体内的积累转化和解毒有着重要的作用。
3 讨论(Discussion)
3.1 无机砷在肝脏中积累机制
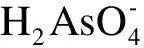
3.2 肝脏中无机砷对GSH含量/GST活性的影响机制探究
从表1可以看出,无机砷暴露可以改变肝脏中GSH含量,从而拮抗无机砷对生物体的毒性作用,且随着积累量的增加,暴露于As(III)的罗非鱼肝脏中GSH含量增加。有研究发现1 000μg·L-1As(III)暴露48 h后,鲤鱼肝脏中GSH的含量显著增加[27]。另有研究显示无机砷急性暴露后,随着染毒时间的延长,小鼠肝组织内GSH的含量整体呈先上升后下降的趋势,并在染毒12 h达到最高值[28]。这些研究结果表明,砷暴露引起的机体GSH含量变化是一个复杂的过程。当生物体受到砷的胁迫时,GSH中的巯基直接与亲电子类物质反应,清除砷暴露诱导产生的氧化应激,同时与生物体内积累的砷直接反应,保护含有巯基的酶或者蛋白类物质,以拮抗无机砷暴露对机体的损伤[29]。Wang等[30]以人肝细胞为研究对象,发现NaAsO2(0~30 μmol·L-1)处理24 h后,胞内GSH含量随染毒剂量增加而逐渐升高,并呈现明显的剂量-反应关系。李富君等[31]的研究表明高浓度砷暴露后血液中GSH含量显著增加,且不同剂量、不同染毒时间引起血液及组织中GSH含量变化不同。这表明As(III)在机体代谢过程中消耗了大量的GSH,同时为抵抗As(III)产生的毒性,机体又不断产生GSH,故随着肝脏中砷积累量的增加GSH含量也增加。对于As(V),其进入生物体后首先被还原为As(III),然后再进一步甲基化[6,32-33]。在As(V)还原成As(III)过程中GSH能作为重要的还原剂被大量消耗,这可能是造成砷积累量与GSH之间没有明显关系的原因,具体的原因还需要进一步探究。
GST主要催化各种亲电物质与GSH的巯基结合,变成亲水物质,进而排出体外。由图3可以发现GST活性与肝脏中砷的积累量呈显著的负相关关系。Sinha等[27]发现亚砷酸钠的暴露显著降低了小鼠肝脏中GST的活力。姚琴[34]研究发现中、低浓度As(III)暴露可提高GST活性,但随着As(III)浓度的增加,GST活性降低。这表明随着As(III)染毒剂量和积累量的增加,一方面生物体内脂质过氧化损伤加重,超过其限度,对GST活性表现出抑制作用;另一方面,GST作为一种球状二聚体蛋白,As(III)可与酶蛋白分子上的巯基或羟基结合形成稳定的络合物或环状化合物,当生物体内砷的积累量超过一定量时,导致GST活性降低甚至失活,故As(III)暴露随着肝脏中积累量的增加,GST活性降低。一系列研究表明As(V)在生物体内的代谢过程为:首先转化成As(III),然后再进行甲基化,生成一甲基砷、二甲基砷,再与基团结合形成砷甜菜碱、砷胆碱等物质,肝脏是As(V)代谢的重要场所[33,35]。Zhang等[36]的研究表明当褐篮子鱼暴露于含1 500μg·g-1As(V)的人工饲料时,肝脏中As(III)的比例与As(V)相当。这表明在肝脏中As(V)可大量转化为As(III),As(III)可以直接作用于酶活系统,更易与生物体内GSH、酶类如GST以及组织蛋白中的巯基及羟基结合,故酶GST活性下降。As(V)不能与酶系统直接作用且As(V)代谢中形态的转化可能是导致As(V)食物相暴露中GST活性与积累量的关系滞后一个时间点呈负相关的原因。
罗非鱼受到无机砷暴露情景下,肝脏中GST活性和GSH含量发生改变,从而抵抗无机砷对鱼体的毒性,且As(III)和As(V)对罗非鱼GSH/GST的不同影响与其在罗非鱼体内的积累量有关。此研究为水生生物在砷暴露环境中机体的解毒机制提供了一定的数据基础,不同形态无机砷对水生生物的致毒及代谢机制需进一步深入研究。
