增塑剂邻苯二甲酸二异癸酯致小鼠肺组织氧化损伤作用
2018-03-16张也李崇尧刘蕾杨湘梅向先兰宋鹏武阳晏彪马萍
张也,李崇尧,刘蕾,杨湘梅,向先兰,宋鹏,武阳,晏彪,马萍
湖北科技学院基础医学院 环境-免疫与神经系统疾病实验室,咸宁 437100
邻苯二甲酸酯(phthalic acid esters, PAEs),又称为酚酞酯,是一大类脂溶性化合物,一般为无色透明的油状粘稠液体,难溶于水,不易挥发,凝固点低,易溶于甲醇、乙醇、乙醚等有机溶剂,并且有毒性,其用途主要是增塑剂[1-2]。邻苯二甲酸二异癸酯(diisodecyl phthalate, DIDP)与邻苯二甲酸二乙基己酯(di-(2-ethylhexyl) phthalate, DEHP)、邻苯二甲酸二丁酯(dibutyl phthalate, DBP)都属于邻苯二甲酸酯[2],但因前者碳链较长,相对分子质量较大,沸点高,毒性较小,由其添加应用的增塑剂,更适合于做增塑剂,常被通俗地称为环保型增塑剂[3-4]。
流行病学研究指出,长期接触含DIDP的聚氯乙烯(polyvinyl chloride, PVC)玩具、吸食室内灰尘和空气的儿童,仍有较高的健康风险[5],而且在人体尿液中已检测出了DIDP的一些代谢物[6]。动物实验研究表明,DIDP虽然对实验动物具有低毒性,但仍可引起肝脏肿大,促进过氧化物酶体的增生[7]。肺是人体的呼吸器官,也是人体重要的造血器官,一方面人体可经肺吸入室内灰尘和空气而直接接触DIDP,另一方面,通过接触玩具而摄入的DIDP极有可能经肝脏代谢后作用于肺脏[4]。目前,国内有关DIDP对小鼠肺组织的影响研究并不多见。
已有研究报道,DIDP的同系物邻苯二甲酸二异壬酯(diisononyl phthalate, DINP)可以造成小鼠肺细胞氧化损伤[8],维生素E(vitamin E, VitE)在小鼠肺组织氧化损伤中具有拮抗作用[9]。因此本研究以无特定病原体(specefic pathogen free, SPF)级雄性BALB/c小鼠为实验对象,以不同剂量DIDP作为暴露物,VitE为拮抗剂,通过检测肺组织匀浆测定活性氧(ROS)、还原型谷胱甘肽(GSH)、丙二醛(MDA)、8-羟基脱氧鸟苷(8-OHdG)的含量,并同时观察肺组织的病理变化与荧光染色结果,探讨DIDP致小鼠肺组织氧化损伤及VitE的拮抗作用,以期为全面评估DIDP的毒性效应及分子机制提供参考。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 主要仪器与试剂
Power wave XS酶标仪(美国Bio-Tek仪器有限公司),FLx 800荧光酶标仪(美国Bio-Tek仪器有限公司),Olympus BX-53荧光正置显微镜(日本Olympus公司),5415R低温冷冻离心机(德国Eppendorf公司),RM2245切片机(德国LEICA公司),HH-42三用电热恒温水箱(长源实验仪器厂,北京);DCFH-DA荧光染料(>99.9%,Sigma公司),Hoechst 33258荧光染料(>99.9%,Sigma公司),蛋白酶 K(Sigma公司),小鼠GSH试剂盒、8-OHdG鸟苷ELISA检测试剂盒(济南朋远生物技术有限公司),硫代巴比妥酸(TBA,分析纯,国药集团化学试剂有限公司),邻苯二甲酸二异癸酯(DIDP,≥99%,Sigma公司)。
1.1.2 实验动物
选用湖北省实验动物研究中心提供的雄性BALB/c小鼠70只,饲养1周后实验,实验过程中,小鼠饲养于笼内,保持温度在20~25 ℃内,笼内相对湿度为50%~70%,以商业鼠粮饲养小鼠,及时补充饮用水,并避免其接触其他干扰致病源,小鼠可自由进食进水。
1.2 实验方法1.2.1 动物分组和染毒
70只BALB/c小鼠随机分为7组,包括1个阴性对照组、4个DIDP染毒组(0.15、1.5、15、150 mg·kg-1)、1个拮抗剂VitE组,1个150 mg·kg-1DIDP+100 mg·kg-1VitE处理组。每组10只。每组均经口灌胃给予,灌胃量为10 mL·kg-1,每天一次,连续染毒14 d,分别于实验前称小鼠体重并记录。
1.2.2 肺组织切片的制备和观察
染毒结束后用颈椎脱臼法处死小鼠,立即取肺组织,肺组织用4%的多聚甲醛固定,常规脱水,石蜡切片,苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色,普通光学显微镜下观察肺组织的病理组织学变化。
1.2.3 肺组织荧光染色
称取Hoechst 33258试剂1 mg,用20 mL蒸馏水溶解后,过滤,4 ℃避光保存。使用时,用10倍的蒸馏水稀释成染色液,工作浓度为5 mg·L-1。常规包埋切片后,脱蜡,透明;磷酸缓冲盐溶液(phosphate buffer saline, PBS)或0.9%生理盐水洗2遍,每次3 min,吸尽液体,手动晃动数次;加入0.5 mL Hoechst 33258染色液,染色5 min;用PBS或0.9%生理盐水洗2遍,每次3 min;将切片置于载玻片上,滴一滴抗淬灭封片液,盖上一洁净的盖玻片,尽量避免产生气泡,然后用Olympus BX-53荧光显微镜观察。
1.2.4 肺组织匀浆和悬液的制备
将肺组织在冰冷的PBS(pH7.5)中漂洗,滤纸拭干,给肺组织加PBS制成10%匀浆液,低温离心后取上清,用于ROS、GSH、MDA和8-OHdG的检测。
1.2.5 ROS含量的测定
取上清液4μL,加入396μL PBS作100倍稀释。取100μL稀释液于酶标板中排列,并加入100μL荧光染料2,7-二氯荧光黄双乙酸盐(DCFH-DA)染色,避光反应5 min,用荧光酶标仪检测。
1.2.6 蛋白质含量和GSH含量的测定
蛋白质含量按照Folin酚法测定,GSH含量的测定严格按照试剂盒操作说明进行。GSH含量(μmol·g prot-1)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×标准管浓度×样本稀释倍数÷待测匀浆蛋白浓度(g prot·L-1)。
1.2.7 MDA含量的测定
取500μL上清液于试管中,并加入2 mL 0.6% 2-硫代巴比妥酸(2-thiobarbituric acid, TBA),沸水浴15 min。取上清1 mL于EP管中,10 000 r·min-1离心5 min。取上清100μL于酶标板中排列,用全波长酶标仪检测,分别在450、532、600 nm波长下测定吸光值(以加PBS的为参照),按照公式计算MDA浓度(μmol·L-1)=6.45(A532-A600)-0.56A450,式中A为吸光度。
1.2.8 8-OHdG含量的测定
8-OHdG含量的测定严格按照试剂盒操作说明进行。以0、3、6、12、24、48 ng·mL-1等标准品浓度为横坐标,450 nm处OD值为纵坐标,绘制标准曲线,根据标准曲线来确定样品中8-OHdG的含量。
1.3 统计分析
实验数据均采用x±s表示,采用SPSS 12.0统计分析软件进行统计分析,多组间均数比较使用单因素方差分析(ANOVA),然后使用LSD-t检验比较2组间均数的差异性,P<0.05,表示差异具有统计学意义。
2 结果(Results)
2.1 小鼠肺组织形态的光镜观察结果
结果如图1所示:空白对照组肺组织结构正常,肺泡腔结构完整,肺泡壁清晰可见,肺泡间隔未见明显毛细血管扩张;0.15 mg·kg-1DIDP组肺组织结构轮廓清晰,肺泡腔基本完整,干净透亮。肺泡壁稍增宽,肺泡间隔细胞轻度增生,肺间隔毛细血管可见不连续轻度扩张;1.5 mg·kg-1DIDP组肺组织结构轮廓可以区分,肺泡腔结构基本存在,但受压扭曲肺泡壁明显增宽,肺泡间隔细胞大量增生,肺间隔毛细血管若隐若现不呈连续状分布,提示有的血管受压受损,有的血管尚可见;15 mg·kg-1DIDP组肺组织结构改变,肺泡腔结构基本存在,但明显变小,腔大小不等,少量红细胞漏出,肺泡壁明显增宽增厚,肺泡隔细胞大量增生明显,肺组织内血管扩张充血,肺泡壁未见毛细血管,见少量红细胞,提示血管受压破损;150 mg·kg-1DIDP组肺组织结构难以辨认,肺泡腔大小不一,腔内可见散落不均的红细胞,肺泡壁弥漫性增宽,肺泡隔细胞大量增生,肺组织内血管扩张充血,肺泡间隔未见毛细血管,但见红细胞,提示明显出血,血管损伤严重。与空白对照组相比较,100 mg·kg-1VitE组肺组织结构和细胞形态正常,而100 mg·kg-1VitE+150 mg·kg-1DIDP组肺组织结构轮廓基本可见,但不规则,肺泡腔大小不一,基本能分辨肺泡壁,但宽窄不均,细胞增生不均,部分肺泡壁增厚,部分断裂,肺组织内血管扩张充血明显,可见肺泡壁毛细血管扩张。
2.2 小鼠肺组织的荧光染色观察结果
由Hoechst荧光染料33258染色的细胞核呈蓝色,细胞质及其他组织呈绿色。如图2所示,对照组中细胞核大多数呈圆形或椭圆形、淡蓝色、视野内细胞核分布密集,肺泡腔结构基本完整;0.15 mg·kg-1DIDP组中,细胞核大多数呈椭圆形、淡蓝色,且细胞核分布较为密集,但肺泡壁增宽;1.5 mg·kg-1DIDP组中,细胞核大多数呈椭圆形,开始缩小,呈蓝色,有明显的蓝色颗粒,细胞核内突显凋亡小体,肺泡壁明显增宽,受压扭曲;15 mg·kg-1DIDP组中,细胞核大多数不规则,开始变形,呈亮蓝色,细胞核内凋亡小体明显增多,肺组织结构基本存在,明显变小;150 mg·kg-1DIDP组中,细胞核稍显畸形,不规则,出现细胞核边集,呈亮蓝色,且细胞核内凋亡小体十分密集,肺组织结构血管不规则,扭曲变形;150 mg·kg-1DIDP+VitE组与150 mg·kg-1DIDP组相比,细胞核大多数呈椭圆形,颜色改变为蓝色,细胞核内凋亡小体减少,且肺泡壁相对变窄,说明VitE能起到一定的保护作用。
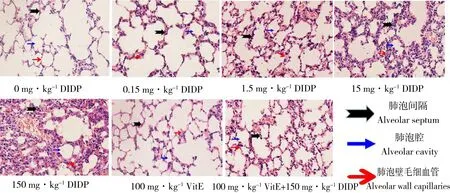
图1 邻苯二甲酸二异癸酯(DIDP)不同处理组小鼠肺组织H&E染色结果(10×40)Fig. 1 H&E staining of lung tissue in different treatment groups of diisodecyl phthalate (DIDP) (10×40)

图2 DIDP不同处理组小鼠肺组织荧光染色结果(10×40)Fig. 2 Fluorescence staining of lung tissue in different treatment groups of DIDP (10×40)
2.3 小鼠肺组织ROS含量的变化
ROS含量是反映机体氧化应激水平的指标,图3可见不同处理组肺组织的ROS含量的变化,随着染毒剂量的增多,ROS含量逐渐上升,呈一定的剂量-效应关系。与对照组比较,较高剂量的DIDP能造成ROS含量的上升。与单独150 mg·kg-1的DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的ROS含量显著下降。
2.4 小鼠肺组织GSH含量的变化
GSH是谷胱甘肽过氧化物酶(GPx)催化过氧化物还原的必需底物,可反映机体抗氧化应激的水平,由图4可以看出随着DIDP染毒剂量的升高,GSH含量逐渐下降,呈一定的剂量-效应关系。与对照组比较,0.15、1.5 mg·kg-1剂量组差异无统计学意义,15、150 mg·kg-1剂量组差异有统计学意义(P< 0.01)。在较高剂量的DIDP作用下,小鼠肺的GSH含量下降明显。与150 mg·kg-1DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的GSH含量显著上升。

图3 不同处理组小鼠肺组织ROS含量注:图中DIDP的浓度单位为mg·kg-1,下同;** P < 0.01,与对照组相比较;## P < 0.01,与150 mg·kg-1 DIDP+ 100 mg·kg-1 VitE组比较。Fig. 3 ROS content in mouse lung of different groupsNote: The concentration unit of DIDP in the figure is mg·kg-1. ** P < 0.01, compared with the control group; ## P < 0.01, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.

图4 不同处理组小鼠肺组织GSH含量注:** P < 0.01,与对照组相比较;## P < 0.01,与150 mg·kg-1 DIDP+ 100 mg·kg-1 VitE组比较。Fig. 4 GSH content in mouse lung of different groupsNote: ** P < 0.01, compared with the control group; ## P < 0.01, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.
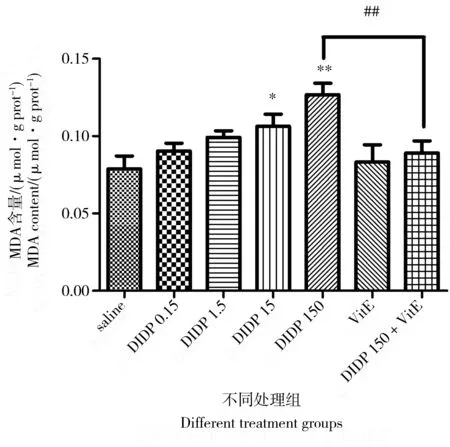
图5 不同处理组小鼠肺组织MDA含量注:* P < 0.05,** P < 0.01,与对照组相比较;## P < 0.01, 与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 5 MDA content in mouse lung of different groupsNote: * P < 0.05, ** P < 0.01, compared with the control group; ## P < 0.01, compared with the 150 mg·kg-1 DIDP+ 100 mg·kg-1 VitE group.
2.5 小鼠肺组织MDA含量的变化
脂质过氧化反应的主要代谢产物是MDA,其反映的是脂质的过氧化作用。由图5可见,与对照组比较,不同剂量的DIDP均能使小鼠肺MDA含量有不同程度的升高。0.15、1.5 mg·kg-1剂量组差异无统计学意义,15、150 mg·kg-1剂量组差异有统计学意义(P< 0.05,P< 0.01),这表明小鼠肺组织已受到损伤。与单独150 mg·kg-1的DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的MDA含量显著下降。
2.6 小鼠肺组织8-OHdG含量的变化
不同处理组肺组织的8-OHdG含量的变化见图6。与对照组比较,不同剂量的DIDP能使小鼠肺8-OHdG含量有不同程度的升高。0.15、1.5 mg·kg-1剂量组差异无统计学意义,15、150 mg·kg-1剂量组差异有统计学意义(P< 0.05,P< 0.01),在较高剂量的DIDP作用下,小鼠肺组织的8-OHdG含量升高明显。与单独150 mg·kg-1的DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的8-OHdG含量显著下降。
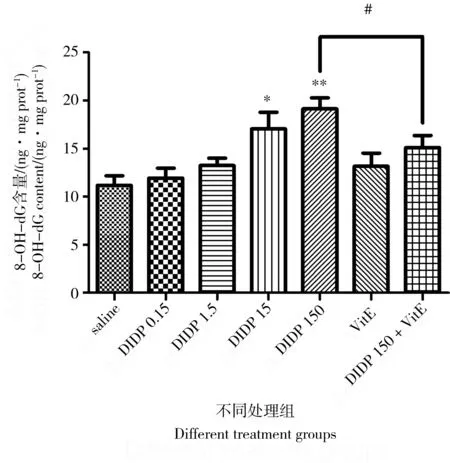
图6 不同处理组小鼠肺组织8-OHdG含量注:* P < 0.05,** P < 0.01,与对照组相比较;# P < 0.05, 与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 6 8-OHdG content in mouse lung of different groupsNote: * P < 0.05, ** P < 0.01, compared with the control group; # P < 0.05, compared with the 150 mg·kg-1 DIDP+ 100 mg·kg-1 VitE group.
3 讨论(Discussions)
DIDP可通过饮食摄入、呼吸道吸入和皮肤接触等途径进入人体,其中饮食摄入是普通人群接触DIDP的最主要途径[4]。有研究指出,邻苯二甲酸酯可经消化道吸收进入血液循环到达肺脏[8]。本研究中病理学观察结果显示,随着DIDP染毒剂量的升高,小鼠肺组织出现不同程度的病理损伤,尤其150 mg·kg-1DIDP组肺组织结构难以辨认,肺泡腔大小不一,肺泡壁弥漫性增宽,肺泡间隔细胞大量增生,提示较高剂量DIDP可对肺实质部的肺泡和肺泡囊造成损伤,而肺泡是气体交换的主要功能单位,对肺泡细胞的损伤将直接影响肺功能。此外,通过Hoechst 33258荧光染色分析结果表明,当DIDP的染毒浓度达到15 mg·kg-1以上时,细胞核开始变形,核由于浓集由淡蓝色逐渐变为亮蓝色,或核呈分叶、碎片状,肺组织结构发生改变。这提示较高剂量的DIDP可对肺组织结构造成一定的损伤。
Ma等[10]的研究表明,氧化应激可能是邻苯二甲酸酯致相关疾病和毒理作用的重要机制之一,其原因在于:人和动物机体内由于细胞呼吸和能量代谢时刻发生着有氧氧化,在细胞中产生活性氧分子(ROS)。而肺是直接暴露于高氧环境中的唯一器官,肺泡部分的氧分压要比心、肝、脑等其他脏器要高得多,更易导致氧化应激。氧化应激分子能够对生物大分子如蛋白质、脂质、核酸等造成损伤,引发肺组织细胞凋亡、肺部炎症反应,进而表现出各种病理学改变。
ROS在线粒体氧化代谢过程中产生,是反映细胞内氧自由基水平的主要指标[11]。ROS在机体正常代谢状态下含量很低,但当细胞受到内外环境的刺激后,ROS产生增多,过量的ROS会使细胞内氧化与抗氧化不平衡,从而导致氧化应激的发生[12]。谷胱苷肽(GSH)是维持细胞氧化还原状态重要的巯基氧化还原反应系统。还原型的GSH是ROS的主要清除剂,它的消耗能反映机体的受氧化损伤程度[13-14],因此在评价氧化损伤中具有重要意义。本研究中,随着DIDP染毒剂量的升高,ROS含量逐渐上升,GSH含量逐渐下降,且有浓度效应关系,说明较高剂量DIDP暴露可使小鼠肺组织细胞产生过量的ROS,GSH消耗,导致细胞的抗氧化能力下降;同时,加入抗氧化剂VitE后,DIDP+VitE组ROS含量下降,GSH含量上升,提示VitE可降低DIDP暴露后产生的ROS。
脂质发生过氧反应是由过量的ROS造成的,其使细胞膜脆性增加、膜之间的成分发生交联,导致离子转运、能量代谢等细胞稳态功能紊乱。脂质过氧化反应的主要代谢产物是MDA,MDA反映的是脂质的过氧化作用,其水平的高低代表脂质的过氧化强度[15]。在本研究中,15、150 mg·kg-1DIDP剂量组MDA含量与对照组差异有统计学意义(P< 0.05,P< 0.01),这表明小鼠肺组织的脂膜已受到损伤。同时,加入抗氧化剂VitE后,DIDP+VitE组MDA含量下降,提示VitE可降低DIDP暴露后产生的MDA。
8-OHdG是活性氧自由基如羟自由基、单线态氧等攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物,是内源性及外源性因素对DNA氧化损伤作用的生物标志物[16]。8-OHdG在体内稳定存在,为代谢终产物,且只能通过DNA氧化损伤途径形成,是目前国际上公认的一种新型评价DNA氧化损伤和氧化应激的生物标志物,测定机体8-OHdG含量对评估体内氧化损伤和修复程度有重要意义[17]。本研究中,随着DIDP染毒剂量的增加,小鼠肺组织中8-OHdG含量有不同程度的升高,与对照组比较15、150 mg·kg-1DIDP剂量组差异有统计学意义(P< 0.05,P< 0.01),说明较高剂量的DIDP能在小鼠肺组织内形成8-OHdG,造成肺组织的损伤。同时,加入抗氧化剂VitE后,DIDP+VitE组8-OHdG含量下降,提示VitE可降低DIDP暴露后产生的8-OHdG。
本研究中,DIDP作为外源物质,可在肺脏内参与氧化还原代谢途径,产生大量ROS,一方面破坏肺脏的抗氧化保护机制,另一方面直接诱发肺细胞的脂质过氧化作用,进而损伤肺细胞的结构和功能[8,18]。维生素E(Vitamin E, VitE),又称生育酚(tocopherol, TH),是一种脂溶性维生素,主要存在于细胞线粒体膜和内质网上,具有良好的抗衰老、抗过氧化及抗紫外线损伤作用,VitE结合在细胞膜上使细胞免受自由基进攻和氧化损伤[19-21]。根据本实验结果,在DIDP的高剂量组中加入抗氧化剂VitE与高剂量DIDP单独暴露组相比,小鼠肺组织所致的氧化损伤程度有所减轻,提示VitE可拮抗DIDP产生的氧化应激从而对肺组织起着一定的保护作用。
综上所述,在较高剂量的DIDP诱导下,小鼠肺组织产生过量的ROS,破坏自身的氧化与抗氧化平衡,使细胞的抗氧化能力下降,间接引起了小鼠肺组织的脂质过氧化反应和8-OHdG的形成,造成肺组织的氧化损伤和病理损伤。抗氧化剂VitE可通过拮抗氧化应激,从而降低DIDP所致小鼠肺组织的氧化损伤和病理损伤。
