微囊藻毒素-LR对雄性黑斑蛙精巢中CYP46A1,CYP2H2和CYP2G1 mRNA表达的影响
2018-03-16刘正权唐娟刘文丽蒋锦晓杜琼霞李宁张杭君贾秀英
刘正权,唐娟,刘文丽,蒋锦晓,杜琼霞,李宁,张杭君,2,贾秀英,*
1. 杭州师范大学 生命与环境科学学院,杭州 310036 2. 杭州师范大学 生态系统保护与恢复杭州市重点实验室,杭州 310036
蓝藻水华产生的微囊藻毒素是全球性水环境污染物[1-4]。微囊藻毒素-LR(microcystin-LR, MC-LR)是微囊藻毒素100多种异构体中,分布最广泛和毒性最强的一种变体[5]。MC-LR主要通过抑制丝氨酸/苏氨酸蛋白磷酸酶1(serine/threonine protein phosphatase 1, PP1)和2A(serine/threonine protein phosphatase 2A, PP2A),导致蛋白质过磷酸化而引起毒效应。MC-LR可以在动物肝脏、肾脏、肠等多个组织中积累[6-7],并造成毒性效应。也有许多研究表明,MC-LR会对动物精巢产生毒性效应。Chen等[8]表明MC-LR能导致雄性大鼠精巢中线粒体肿胀、细胞质收缩、细胞膜空泡化、细胞核变形,破坏一些细胞支架相关基因的转录平衡,导致活性氧(ROS)产生和DNA损伤。Li等[9]证明MC-LR能引起大鼠精子质量下降,破坏睾酮、促黄体生成素和促卵泡激素等的激素水平平衡,造成严重的生殖毒性。我们先前的研究也证明低剂量MC-LR体内暴露会引起黑斑蛙精巢细胞凋亡、内分泌干扰和精子质量下降等生殖毒性效应[10-11]。黑斑蛙(Rananigromaculata)栖息于湿地,对环境污染物极其敏感[12],而其主要生命过程与有毒蓝藻水华发生时期相一致,因此很容易遭受MC-LR影响。目前,在精巢中,关于微囊藻毒素MC-LR对内源性物质的代谢作用及对微囊藻毒素MC-LR的代谢调节作用还不是很清楚,相关的生殖毒性分子机理有待进一步研究。
细胞色素P450是亚铁血红素的超家族蛋白酶,能催化多种反应,包括内源性化合物(如类固醇、胆固醇、维生素D、胆酸等)和外源性化合物(如药物、化学毒物、致癌物等)的代谢。其中,CYP46A1基因编码的胆固醇24-羟化酶,是一种内质网蛋白,能在大脑、精巢、眼睛和肝脏中表达。胆固醇24-羟化酶能催化大脑中胆固醇转化为24S-羟化胆固醇,促使胆固醇穿过血液-大脑屏障[13],进入血液循环,并在肝脏中进行分解代谢,使脑内多余的胆固醇清除[14]。许多体外和体内调查研究表明胆固醇24-羟化酶缺陷,能引起大脑中胆固醇代谢异常,引发阿尔茨海默病[13,15-16];Burlot等[17]表明阿尔茨海默病样tau病理模型小鼠与对照组相比,其海马体的CYP46A1酶和24S-羟化胆固醇水平更低;Kuo等[18]研究发现高摄入胆固醇会引起大脑海马体和皮质中的胆固醇水平升高,产生明显的认知障碍,并伴随着的CYP46A1 mRNA表达水平和24S-羟化胆固醇水平显著增加。因此,CYP46A1基因编码的胆固醇24-羟化酶是一种涉及胆固醇平衡的代谢调节酶,一些病理引起的胆固醇平衡异常往往伴随着胆固醇24-羟化酶水平的改变。然而,有研究表明,在精巢中存在血睾屏障的条件下,CYP46A1酶对精巢中胆固醇水平也具有调节作用[19]。胆固醇是性激素合成的重要底物[20],精巢中的胆固醇代谢水平的异常影响性激素的合成[21]。因此,对CYP46A1转录水平的调查研究,有助于阐明环境污染物干扰动物体精巢中胆固醇水平平衡,引起生殖毒性的分子机理,并利于评估该污染物的健康风险。而CYP2家族是已知的最大、最复杂的细胞色素P450家族,其活性的高低可间接反映多种环境污染物对生物体机体的毒性作用。有研究表明镇静剂苯巴比妥及相似化合物能诱导CYP2家族基因的表达[22],包括CYP2H2和CYP2H1基因的表达。Hamilton等[23]表明,在鸡胚肝细胞中,多种蛋白合成抑制剂(环已酰亚胺、链菌生素、乙酸环已基酰亚胺、密旋酶素和蓖麻毒素)能引起CYP2H2转录水平的增加。CYP2G1酶也能代谢外源性化合物[24];具有解毒作用的Nrf2(NF-E2-related factor 2, Nrf2)因子能激活CYP2G1转录[25];当缺少Nrf2因子,CYP2G1的mRNA水平会减少。
我们通过基因克隆,已发现CYP46A1、CYP2H2和CYP2G1均能在黑斑蛙精巢中表达,克隆得到的Genebank基因序列号如表1所示。MC-LR引起的生殖毒性是否对CYP46A1、CYP2H2和CYP2G1转录水平存在作用尚不清楚,其毒性机理有待进一步研究。为此,我们探究了低剂量MC-LR(0、0.1、1和10 μg·L-1)在体内暴露0、7和14 d后对黑斑蛙精巢组织中CYP46A1、CYP2H2和CYP2G1转录水平的影响,阐明低剂量MC-LR诱导这些基因转录水平变化的时间和剂量效应特征,为探索MC-LR的生殖毒性机理提供理论依据。
1 材料与方法(Materials and methods)
1.1 试剂与仪器设备
MC-LR(纯度≥ 95%;Enzo Life Sciences公司,CAS No. 101043-37-2),TRIzol®Plus RNA Purification Kit试剂盒(Invitrogen公司,美国,货号:12183-555),RNase-Free DNase Set试剂盒(Qiagen公司,德国,货号:79254),SuperScriptTMIII First-Strand Synthesis SuperMix试剂盒(Invitrogen Life Technologies公司,美国,货号:11752-050),Power SYBR®Green PCR Master Mix试剂盒(Applied Biosystems公司,美国,货号:4367659)。
DTH-2050R型高速冷冻离心机(上海德洋意邦仪器有限公司),Nano-200型微量分光光度计(杭州奥盛仪器有限公司),HH-2型恒温水浴锅(常州智博瑞仪器制造有限公司),CFX384型多重实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 实验动物和实验设计
健康成年雄性黑斑蛙(R.nigromaculata)购买自浙江长兴创意生态农业发展有限公司,平均体长为(74.5±4.3) mm,平均体重为(36.6±9.8) g。在室内盛有3 cm深的曝气脱氯自来水(温度:18~22 ℃;pH:6.0~7.0;溶解氧:6~8 mg·L-1)的玻璃水族缸(60 cm × 40 cm × 35 cm)中暂养7 d后,挑选健壮、规格整齐的黑斑蛙进行暴露试验。
挑选的雄蛙随机分成7组,每组20只,随后分别暴露于深为3 cm的0、0.1、1和10 μg·L-1的MC-LR溶液。在这些实验组中,有3组为空白组,分别暴露于脱氯自来水0、7和14 d,有2组暴露于1 μg·L-1MC-LR 7 d和14 d,另有2组分别暴露于0.1和10 μg·L-1MC-LR 14 d。该暴露实验使用静态置换法,每24小时更换MC-LR全部溶液,投喂蚯蚓(Eiseniafetida)2次,并提供自然光/暗周期暴露条件(14 h:10 h)。每组待暴露时间结束后,黑斑蛙分别以脑脊髓刺毁法处死。随后取精巢组织,迅速用磷酸盐缓冲液(phosphate buffered saline)冲洗2次,并放入冷冻管。冷冻管储存于-80 ℃液氮中待测。所有动物处理程序符合实验动物科学协会的指导方针。
1.3 mRNA分析
mRNA分析实验之前,我们已对黑斑蛙精巢组织中的CYP46A1、CYP2H2和CYP2G1基因进行了基因克隆,得到基因序列,并把该基因序列提呈到了Genebank,得到Genebank的基因序列号,基因序列号见表1。精巢中总RNA采用TRIzol®Plus RNA Purification Kit试剂盒提取,并使用RNase-Free DNase Set试剂盒去除残留的基因组DNA。通过紫外分光光度计(260/280 nm吸光度比值)和1%甲醛琼脂糖凝胶电泳来测定总RNA的含量、纯度及质量。随后,采用SuperScriptTMIII First-Strand Synthesis SuperMix试剂盒合成cDNA。在cDNA的PCR扩增前,使用Primer Premier 6.0和Beacon Designer 7.8软件设计引物,引物序列见表1。其次,使用CFX384多重实时荧光定量PCR仪进行二步法qRT-PCR的PCR扩增。qRT-PCR的反应体系为:8.0 μL无菌蒸馏水(SDW),10.0 μL power SYBR®Green Master Mix (Applied Biosystems),0.5 μL forward primers(10 μmol·L-1),0.5 μL the reverse primers(10 μmol·L-1)和1.0 μL cDNA。qRT-PCR的反应体系为:95 ℃变性1 min,随后进行40个热循环(95 ℃、15 s,63 ℃、25 s,收集荧光)。基因表达通过比较的Ct(2-△△Ct)方法进行统计学分析,基因相对表达通过2-△△Ct计算,Ct代表循环阀值[26]。每个样品做3次平行实验。
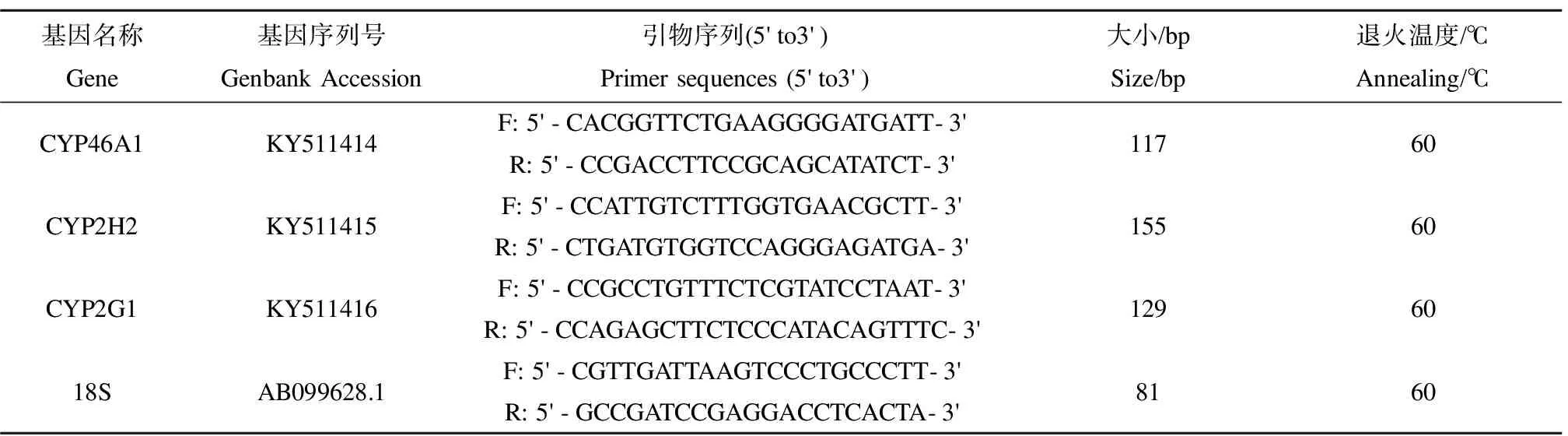
表1 实时荧光定量PCR的引物序列和条件Table 1 Real-Time PCR primers and conditions
图1 CYP46A1、CYP2H2、CYP2G1和18S(内参)的实时荧光定量PCR熔点曲线Fig. 1 The real-time PCR melt curve of CYP46A1, CYP2H2, CYP2G1 and 18S (control)
图2 CYP46A1、CYP2H2、CYP2G1和18S(内参)的实时荧光定量PCR熔点曲线Fig. 2 The real-time PCR amplification curve of CYP46A1, CYP2H2, CYP2G1 and 18S (control)
1.4 统计分析
数据以平均值±标准偏差表示,并使用Origin 8.5软件进行统计分析。MC-LR暴露组与空白对照组的统计学差异通过单因素方差分析,随后进行费雪最小显著差异法(Fisher's least significant difference test)分析。*P< 0.05、**P< 0.01表示差异显著。
2 结果(Results)
2.1 CYP46A1、CYP2H2和CYP2G1这3种扩增基因特异性分析
在55~95 ℃,通过熔解曲线对扩增产物进行特异性分析。各基因的熔解曲线见图1,扩增曲线见图2。图1和图2的结果表明扩增得到的3种CYP基因产物均具有较好特异性。
2.2 MC-LR对黑斑蛙精巢中CYP46A1 mRNA表达的影响
CYP46A1基因编码胆固醇24-羟化酶,对胆固醇平衡调节具有重要作用。图3和图4为MC-LR暴露后雄性黑斑蛙精巢中CYP46A1 mRNA表达变化。当黑斑蛙暴露于0.1、1和10 μg·L-1MC-LR溶液14 d后,精巢中CYP46A1的mRNA表达水平分别上调了1.86、1.65、1.22倍(图3)。黑斑蛙暴露于1 μg·L-1MC-LR溶液7 d后,精巢中CYP46A1的mRNA表达水平上调了2.13倍(图4)。结果表明,0.1 μg·L-1MC-LR暴露组精巢中CYP46A1表达强度最高,随着MC-LR暴露浓度增加,CYP46A1的mRNA表达水平逐渐下降,说明MC-LR具有潜在的干扰精巢中胆固醇水平平衡和毒物低剂量兴奋效应。
2.3 MC-LR对黑斑蛙精巢中CYP2H2 mRNA表达的影响
CYP2H2具有代谢外源性物质的作用。图5和图6显示MC-LR暴露后雄性黑斑蛙精巢中CYP2H2 mRNA表达变化。黑斑蛙暴露于0.1、1和10 μg·L-1MC-LR溶液14 d后,精巢中CYP2H2的mRNA表达水平分别上调了4.62、1.80和1.04倍(图5),其中在1 μg·L-1和10 μg·L-1MC-LR暴露下,CYP2H2 mRNA表达水平与对照组相比没有显著差异。暴露于1 μg·L-1MC-LR溶液7 d,黑斑蛙精巢中CYP2H2的mRNA表达水平上调了5.25倍(图6)。上述结果同样表明,低剂量MC-LR暴露会诱导CYP2H2的mRNA表达水平变化呈现毒物低剂量兴奋效应。
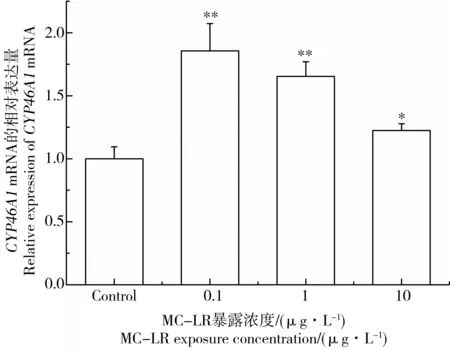
图3 低剂量微囊藻毒素-LR(MC-LR)对雄性黑斑蛙精巢中CYP46A1 mRNA表达的影响注:雄性黑斑蛙分别暴露于0、0.1、1和10 μg·L-1 MC-LR溶液14 d。柱状图表示平均值±标准偏差。*、**表示与对照组相比差异显著(*P<0.05,**P<0.01)。Fig. 3 Effects of low dose microcystin-LR (MC-LR) on CYP46A1 mRNA expressions in testes of male frogsNote: Male frogs were respectively exposed to 0, 0.1, 1, and 10 μg·L-1 MC-LR for 14 d. Bars represented mean±S.D.. Asterisks denote significant differences when compared with the control (*P < 0.05, **P < 0.01).
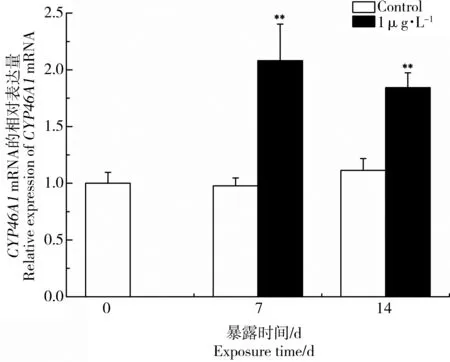
图4 低剂量MC-LR对雄性黑斑蛙精巢中CYP46A1 mRNA表达的影响注:雄性黑斑蛙分别暴露于1 μg·L-1 MC-LR溶液0、7和14 d。柱状图表示平均值±标准偏差。*、**表示与对照组相比差异显著(*P<0.05,**P<0.01)。Fig. 4 Effects of low dose MC-LR on CYP46A1 mRNA expressions in testes of male frogsNote: Male frogs were respectively exposed to 1 μg·L-1 MC-LR for 0, 7 and 14 d. Bars represented mean±S.D.. Asterisks denote significant differences when compared with the control (*P<0.05, **P<0.01).
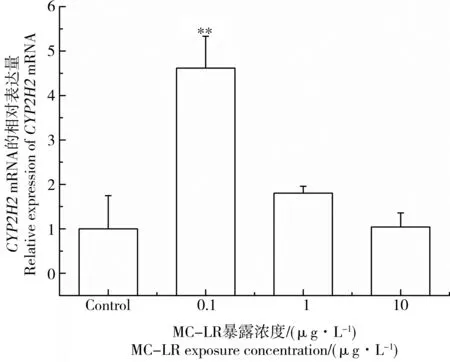
图5 低剂量MC-LR对雄性黑斑蛙精巢中CYP2H2 mRNA表达的影响注:雄性黑斑蛙分别暴露于0、0.1、1和10 μg·L-1 MC-LR 14 d。柱状图表示平均值±标准偏差。*、**表示与对照组相比差异显著(*P<0.05,**P<0.01)。Fig. 5 Effects of low dose MC-LR on CYP2H2 mRNA expressions in testes of male frogsNote: Male frogs were respectively exposed to 0, 0.1, 1, and 10 μg·L-1 MC-LR for 14 d. Bars represented mean±S.D.. Asterisks denote significant differences when compared with the control (*P<0.05, **P<0.01).
2.4 MC-LR对黑斑蛙精巢中CYP2G1 mRNA表达的影响
CYP2G1可参与Nrf2的解毒过程[25]。图7和图8显示MC-LR暴露后雄性黑斑蛙精巢中CYP2G1 mRNA表达水平变化。当黑斑蛙暴露于0.1、1和10 μg·L-1MC-LR溶液14 d后,精巢中CYP2G1的mRNA表达水平分别上调了2.63、2.16和1.56倍(图7)。当暴露于1 μg·L-1MC-LR溶液7 d后,黑斑蛙精巢中CYP2G1的mRNA表达水平上调了3.59倍(图8)。结果表明,低剂量MC-LR暴露会诱导精巢中CYP2G1的mRNA表达水平变化,呈现毒物低剂量兴奋效应。
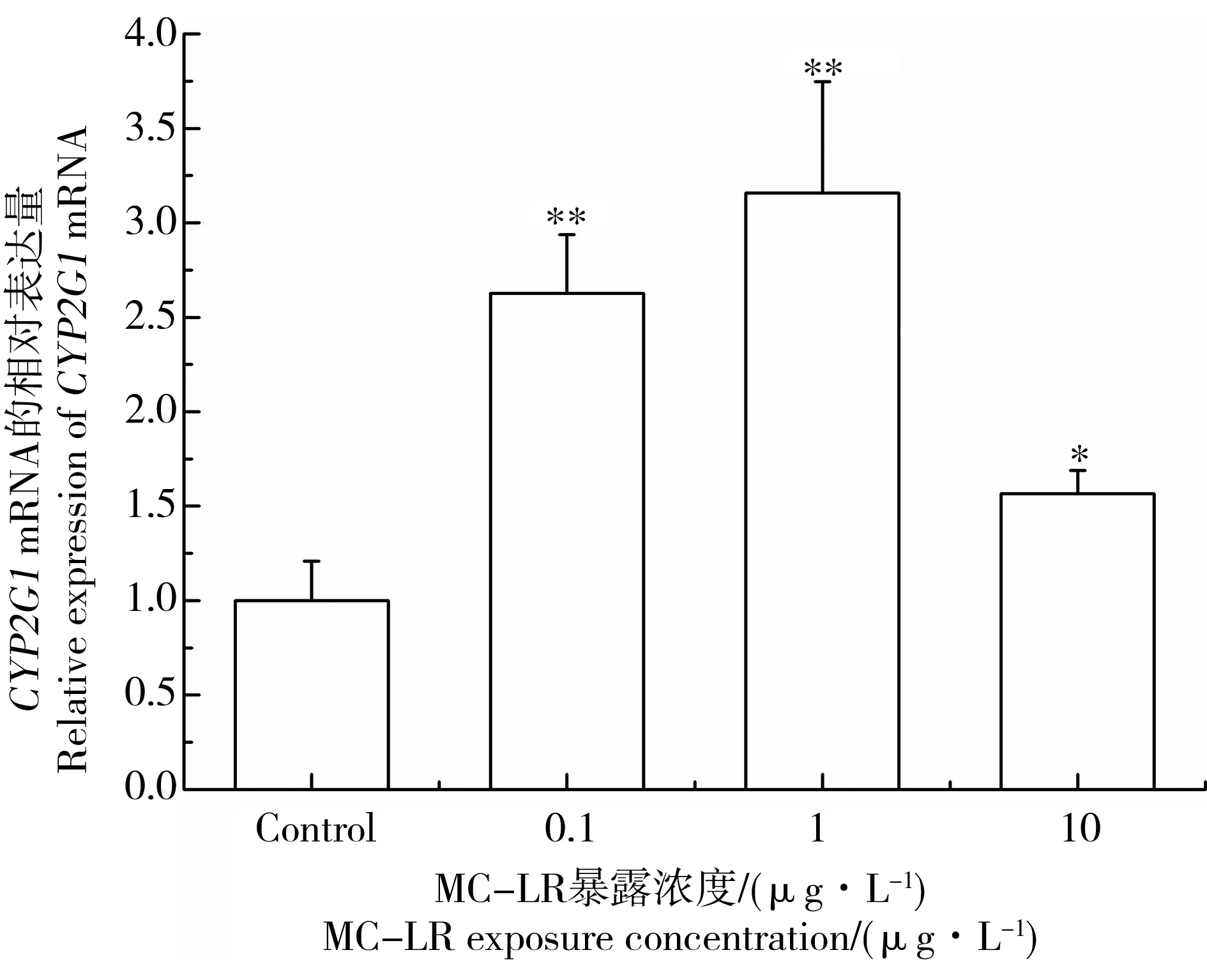
图7 低剂量MC-LR对雄性黑斑蛙精巢中CYP2G1 mRNA表达的影响注:雄性黑斑蛙分别暴露于0、0.1、1和10 μg·L-1 MC-LR 14 d。柱状图表示平均值±标准偏差。*、**表示与对照组相比差异显著(*P<0.05,**P<0.01)。Fig. 7 Effects of low dose MC-LR on CYP2G1 mRNA expressions in testes of male frogsNote: Male frogs were respectively exposed to 0, 0.1, 1, and 10 μg·L-1 MC-LR for 14 d. Bars represented mean±S.D.. Asterisks denote significant differences when compared with the control (*P<0.05, **P<0.01).
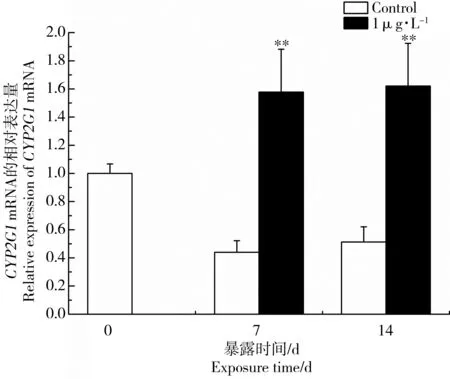
图8 低剂量MC-LR对雄性黑斑蛙精巢中CYP2G1 mRNA表达的影响注:雄性黑斑蛙分别暴露于1 μg·L-1 MC-LR溶液0、7和14 d。柱状图表示平均值±标准偏差。*、**表示与对照组相比差异显著(*P<0.05,**P<0.01)。Fig. 8 Effects of low dose MC-LR on CYP2G1 mRNA expressions in testes of male frogsNote: Male frogs were respectively exposed to 1 μg·L-1 MC-LR for 0, 7 and 14 d. Bars represented mean±S.D.. Asterisks denote significant differences when compared with the control (*P<0.05, **P<0.01).
3 讨论(Discussion)
细胞色素P450酶系常作为毒物毒性的生物学标志物,并广泛应用于毒理学研究中。细胞色素P450酶系可以通过生物转化亲脂性有毒化合物,变成极性强的易溶物质,使毒性物质失活,易于排出体外,从而起到解毒作用。而CYP46A1对精巢中胆固醇平衡具有调节作用,能转化胆固醇为24S-羟化胆固醇,促进胆固醇进入血液循环并进行分解代谢;其表达水平的变化也反映该精巢存在一定的病变。在本研究中,0.1、1和10 μg·L-1MC-LR暴露14 d均引起CYP46A1 mRNA水平的增加,同时1 μg·L-1MC-LR暴露7 d也能引起CYP46A1 mRNA水平的增加。该结果表明低剂量MC-LR的短期暴露会引起CYP46A1 mRNA表达显著上升,促进精巢中的胆固醇代谢。有研究表明,CYP46A1表达上升会引起24S-羟基胆固醇含量升高,并伴随着胆固醇合成减少[27-28];氧化应激会转变胆固醇代谢和CYP46A1转录活性[27-28]。相一致地,我们前期研究表明低剂量MC-LR会诱导雄性黑斑蛙精巢的氧化应激[10]。作为性激素合成的底物,精巢中胆固醇含量的减少,会引起性激素合成的减少,从而引起内分泌干扰作用。因此,低剂量MC-LR的短期暴露会引起CYP46A1 mRNA表达显著异常,胆固醇平衡被破坏,具有干扰性激素合成的风险;本结果也验证了低剂量MC-LR暴露会引起黑斑蛙精巢的氧化应激和细胞凋亡,并阐明了其氧化应激和细胞凋亡的毒效应,与胆固醇平衡和CYP46A1基因表达水平之间的相关性等机理。
CYP2亚族成员在许多外源物的生物转化中起着重要作用。为此,我们调查了CYP2H2和CYP2G1基因的转录水平。在研究中发现,0.1 μg·L-1MC-LR暴露14 d会显著上调CYP2H2 mRNA表达,然而,1和10 μg·L-1的MC-LR暴露14 d,CYP2H2 mRNA表达与对照组相比,没有显著差异。1 μg·L-1MC-LR暴露7 d会显著上调CYP2H2 mRNA表达水平。相对短时期低剂量的MC-LR暴露,CYP2H2 mRNA表达水平明显高于相对长时间的高剂量MC-LR暴露。结果表明,0.1 μg·L-1MC-LR暴露14 d和1 μg·L-1MC-LR暴露7 d都会诱导CYP2H2 mRNA表达水平上调,促进CYP2H2酶对有毒的MC-LR的代谢。而在1和10 μg·L-1MC-LR的短期暴露后,会使CYP2H2 mRNA表达水平相对稳定,降低精巢组织对MC-LR的代谢能力,导致MC-LR在精巢中蓄积而产生生殖毒性。另外,有研究表明,一些蛋白合成抑制剂能诱导CYP2H2 mRNA水平上调[23]。已有研究表明,MC-LR会引起细胞骨架相关基因转录水平的破坏和解毒物质谷胱甘肽(GSH)合成的减少[8,10];并且MC-LR存在PP2A/PP1毒性,能使蛋白质过磷酸化,引起靶组织病变[29]。这些毒性效应可能导致了精巢CYP2H2 mRNA水平上调。因此,该研究结果表明相对低剂量短时期的MC-LR暴露,会增强CYP2H2转录水平,进而利于MC-LR代谢,而相对高剂量的MC-LR暴露会使CYP2H2转录水平保持相对稳定,不利于MC-LR的代谢,使MC-LR引发生殖毒性。
CYP2G1酶也属于CYP2家族,对外源物质有代谢作用。本实验对CYP2G1的转录水平进行了检测,结果表明,0.1、1和10 μg·L-1MC-LR 14 d暴露均引起CYP2G1 mRNA水平的增加。1 μg·L-1MC-LR的7 d暴露也能引起CYP2G1 mRNA水平的增加。Wu等[25]的研究表明抵御外源性刺激和毒物的抗氧化应答反应核心转录因子Nrf2的激活会引起CYP2G1 mRNA表达量上升。因此,研究结果表明低剂量MC-LR暴露会上调CYP2G1的转录水平,增强对MC-LR毒物的代谢。该代谢过程可能由解毒作用转录因子Nrf2激活,这需要后期进一步研究。
