羟基多溴联苯醚(OH-PBDEs)小鼠肝脏微粒体体外代谢及对雌激素代谢的影响研究
2018-03-16陈玫宏徐怀洲宋宁慧张芹张圣虎李江
陈玫宏,徐怀洲,宋宁慧,张芹,张圣虎,*,李江
1. 生态环境部南京环境科学研究所,南京 210042 2. 贵州大学资源与环境工程学院,贵阳 550025
羟基多溴联苯醚(OH-PBDEs)作为一类具有内分泌干扰性质的酚类化合物已经引起了人们的广泛关注[1-3]。与母体多溴联苯醚(PBDEs)相比,具有更大的生物毒性效应[4-5],目前在环境介质[6-8]、生物体[9-11]甚至人体[12-14]中均有检出,表明OH-PBDEs具有一定的持久性。目前有研究表明,OH-PBDEs可以在生物体内通过生物酶催化氧化进一步形成一相代谢产物,代谢速率受溴原子数量及羟基、溴原子和醚键三者之间的位置等因素的影响[15-19]。
由于生物体内雌激素的合成和代谢受多种因素的调节,外源性雌激素可能通过影响这些调节发挥其雌激素活性效应[20-22]。目前研究表明OH-PBDEs在生物体内能够影响磺基转移酶的生物活性[23-25]。细胞色素P450酶作为生物体内重要代谢酶系,是维持哺乳动物体内适当17β-雌二醇(E2)水平的主要因素,Lai和Cai[26]发现OH-PBDEs对E2的代谢能够产生非竞争性抑制作用。
因此,本研究用小鼠肝微粒体对4种OH-PBDEs(5'-OH-BDE-99、6'-OH-BDE-99、6-OH-BDE-99和6-OH-BDE-137)进行体外代谢研究,并考察OH-PBDEs对雌激素包括雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、17α-炔雌醇(EE2)等代谢的影响,有助于更加全面的评价OH-PBDEs在生物体的代谢行为和毒性效应。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
AG-285电子天平(Mettle公司,瑞士);Biofuge stratos高速冷冻离心机(Heraeus公司,德国);Avanti J-30I超高速离心机(Beckman Coulter公司,美国);Tecan Infinite 200酶标仪(Tecan公司);恒温振荡培养箱(INNOVA 43R,NBS公司);UVmini-1240紫外分光光度计(Kyoto公司,日本);超高效液相色谱-串联质谱仪(LC-Agilent Technologies 1290 Infinity, MS-AB SCIEX QTRAP 4500,美国)。
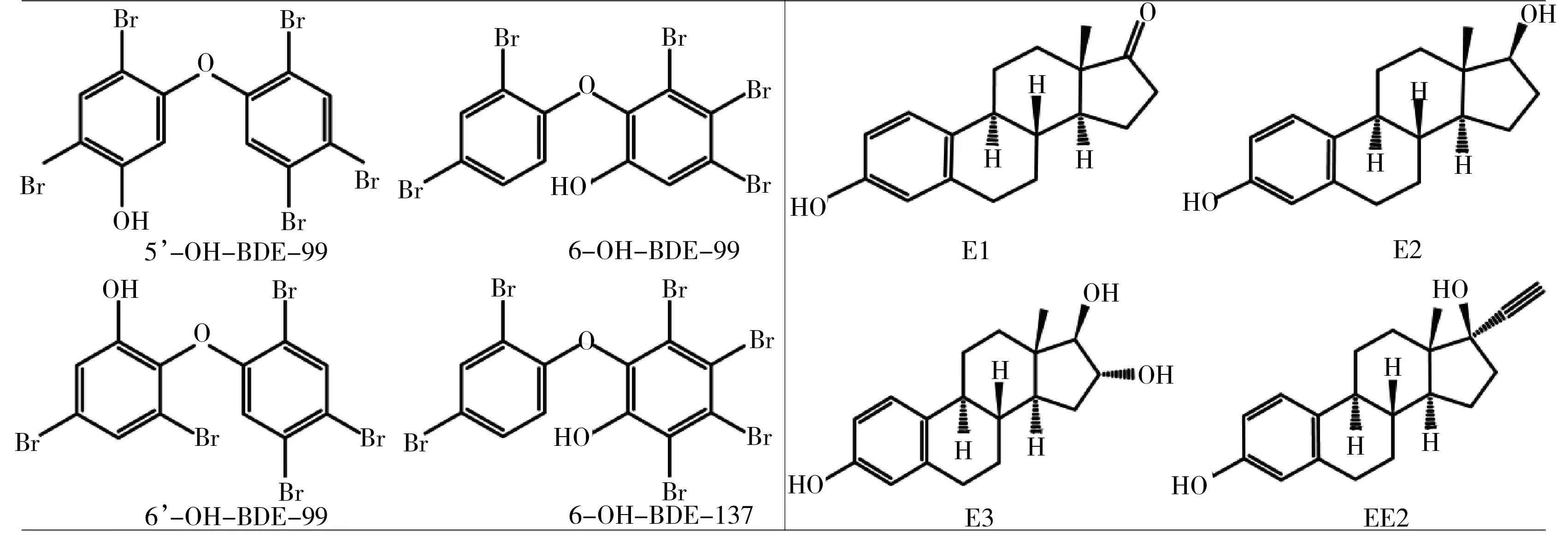
图1 羟基多溴联苯醚(OH-PBDEs)和雌激素的结构图注: 5'-OH-BDE-99为5’-羟基-2,2',4,4',5-五溴联苯醚,6'-OH-BDE-99为6’-羟基-2,2',4,4',5-五溴联苯醚,6-OH-BDE-99为6-羟基-2,2',3,4,4'-五溴联苯醚,6-OH-BDE-137为6-羟基-2,2',3,4,4',5-六溴联苯醚;E1为雌酮,E2为17β-雌二醇,E3为雌三醇,EE2为17α-炔雌醇。Fig. 1 Constructions of hydroxyl polybrominated diphenyl ethers (OH-PBDEs) and estrogensNote: 5'-OH-BDE-99 (5'-Hydroxy-2,2',4,4',5-pentabromodiphenyl ether), 6'-OH-BDE-99 (6'-Hydroxy-2,2',4,4',5-pentabromodiphenyl ether), 6-OH-BDE-99 (6-Hydroxy-2,2',3,4,4'-pentabromodiphenyl ether), 6-OH-BDE-137 (6-Hydroxy-2,2',3,4,4',5-hexabromodiphenyl ether); E1 (Estrone), E2 (17β-Estradiol), E3 (Estriol), EE2 (17α-Ethynylestradiol).
4种OH-PBDEs和4种雌激素(图1):5'-羟基-2,2',4,4',5-五溴联苯醚(5'-OH-BDE-99)、6'-羟基-2,2',4,4',5-五溴联苯醚(6'-OH-BDE-99)、6-羟基-2,2',3,4,4'-五溴联苯醚(6-OH-BDE-99)、6-羟基-2,2',3,4,4',5-六溴联苯醚(6-OH-BDE-137)、雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、17α-炔雌醇(EE2)购于百灵威科技有限公司(J&K公司)。
三(羟甲基)氨基甲烷(Tris)、乙二胺四乙酸二钠盐二水合物(Na2EDTA)、二硫苏糖醇(DTT)、牛血清蛋白(BSA)、考马斯亮蓝G250、7-乙氧基试卤灵、试卤灵、甘氨酸、7-乙氧基香豆素、7-羟基香豆素、盐酸苯胺、4-氨基苯酚均购于J&K公司;烟酰胺腺嘌呤二核苷酸磷酸(NADPH)购自Sigma Aldrich公司;甲醇和乙腈为色谱纯,购自德国Merck公司;氨水(色谱纯)、二甲基亚砜(DMSO,药检专用)、氯化钾和氢氧化钠(分析纯)均购于国药集团药业股份有限公司。
1.2 肝微粒体的制备
无特定病原体(specific pathogen free, SPF)级ICR小白鼠(约6周龄)购自上海杰思捷实验动物有限公司。通过颈椎脱臼法处死小鼠,迅速取出肝脏,在冰浴中用冰冷的生理盐水(0.9%)冲洗,滤纸拭干后称重,剪碎后加入由20%甘油、0.15 mol·L-1KCl、1 mmol·L-1Na2EDTA、0.1 mmol·L-1二硫苏糖醇(DTT)、0.1 mol·L-1Tris-HCl(pH 7.4)配制而成的缓冲液(m(肝脏)∶V(缓冲液)=1∶3),匀浆后以9 000 g(4 ℃)离心20 min。将所得上清液在105 000 g(4 ℃)下进一步离心30 min,弃去上清液,淡红色沉淀物即为肝脏微粒体。按单位肝脏重量(g)加0.5 mL重悬缓冲液(20%甘油、1 mmol·L-1Na2EDTA、0.1 mmol·L-1DTT,以0.1 mol·L-1Tris-HCl(pH 7.4)配制。制成匀浆,分装后储存于液氮中备用。用Bradford法测定微粒体蛋白质浓度,以牛血清蛋白作为标准蛋白[27],以上步骤均在冰浴中进行。
1.3 酶活性测定方法
乙氧基香豆素-O-脱乙基酶(ECOD)活性的测定方法[16,18]:反应体系包括1 mg·mL-1牛血清蛋白(BSA)、1 mmol·L-17-乙氧基香豆素、微粒体样品液,Tris-HCl缓冲液用于维持体系的pH值,整个反应体系总体积为1 mL。37 ℃预热5 min后加入NADPH开启反应,反应10 min后,添加三氯乙酸(15%)终止反应。加入2 mL三氯甲烷萃取反应产物,涡旋2 min后于3 000 g下离心5 min;随后,取1 mL有机相加入5 mL 0.6 mol·L-1NaOH-甘氨酸缓冲液(pH 10.4),涡旋萃取,用酶标仪在激发波长370 nm和发射波长450 nm处检测7-羟基香豆素的吸光度值。酶活性最终用7-羟基香豆素的生成量表示,单位为pmol·min-1·mg-1。
1.4 OH-PBDE对微粒体活性影响
通过在NADPH存在下将小鼠肝脏微粒体与OH-PBDE一起孵育,分别考察不同浓度的OH-PBDE对小鼠肝脏微粒体CYP450的ECOD活性的影响。设定OH-PBDE在代谢体系中浓度为1.5、3、6、15、30μmol·L-1,于37 ℃条件下代谢2 h,终止反应后,测定ECOD的活性,对照组不添加OH-PBDE。
1.5 体外代谢实验
1.5.1 OH-PBDEs的体外代谢
代谢反应体系体积为2 mL(pH=7.4),包含0.1 mol·L-1Tris-HCl、3μmol·L-1OH-PBDE、1 mg·mL-1微粒体,OH-PBDEs用DMSO助溶(反应体系中DMSO比例为1%)。将反应体系在37 ℃(120 r·min-1)恒温震荡器中预孵育5 min,然后加入辅酶NADPH启动反应。NADPH的最终浓度为0.8 mg·mL-1,对照组不含辅酶。孵育2 h后,加入2 mL冰乙腈终止反应,放入-20 ℃冰箱20 min后,取上清液过0.22μm有机滤膜,待HPLC-MS/MS测定目标物的浓度。4种OH-PBDEs单独进行体外代谢实验,每组设置3个平行,一个对照组,并根据代谢反应结束时OH-PBDEs的浓度与零时刻浓度比值计算代谢率。
1.5.2 OH-PBDEs对雌激素体外代谢影响
分别将4种OH-PBDEs添加到含2.7μmol·L-1雌激素的代谢体系中进行代谢影响研究。代谢反应体系体积为2 mL,包含0.1 mol·L-1Tris-HCl、1.5~6(1.5、3、6)μmol·L-1OH-PBDE、2.7μmol·L-1雌激素(E1、E2、E3、EE2)、1 mg·mL-1微粒体,加入辅酶NADPH启动反应,37 ℃下分别振荡培养2 h,每组设置3组平行,对照组不含OH-PBDEs。代谢反应结束时加入2 mL冰乙腈,放入-20 ℃冰箱20 min后,取上清液过0.22μm有机滤膜后测定雌激素的含量,并根据代谢反应结束时雌激素的含量与零时刻含量比值计算代谢率。
1.6 仪器分析1.6.1 OH-PBDEs的测定
样品测定采用高效液相色谱串联质谱(HPLC-MS/MS):质谱条件为电喷雾离子源(ESI-),多反应离子监测(MRM),负离子模式,离子源温度500 ℃,离子喷雾电压4 500 V,气帘气压力206 851.8 Pa,喷雾气压力241 327.1 Pa,辅助加热气压力275 802.4 Pa;色谱条件为ZORBAX Eclipse Plus C18色谱柱(150 mm × 2.1 mm, 3.5μm),OH-PBDEs测定的流动相为0.2% (V/V)氨水(A)和乙腈(B),A与B的比例为3:7(V/V),柱温40 ℃,进样体积5μL,外标法定量。具体参数见表1。4种OH-PBDEs均在1~100μg·L-1范围内线性相关,相关系数(r2)为0.9789,定量限(LOQ)范围为0.01~1.03μg·L-1,回收率范围为65%~116%。
1.6.2 雌激素及其产物的测定
4种雌激素及产物2-羟基雌二醇(2-OH-E2)采用高效液相色谱串联质谱(HPLC-MS/MS)进行检测分析。质谱条件为电喷雾离子源(ESI-),多反应离子监测(MRM),负离子模式,离子源温度400 ℃,离子喷雾电压4 500 V,气帘气压力206 851.8 Pa,喷雾气压力241 327.1 Pa,辅助加热气压力275 802.4 Pa;色谱条件为ZORBAX Eclipse Plus C18色谱柱(150 mm × 2.1 mm,3.5μm),流动相为水(A)和乙腈(B),A与B的比例为3:7(V/V),柱温40 ℃,进样体积5μL,外标法定量,其他具体参数见表2。
1.7 数据处理
本文所有结果均采用平均值±标准偏差(mean±SD)表示。采用SPSS19.0和独立样本T检验(单因素方差分析,Dunnett’s T3(3)),对各处理组与对照组数据进行差异显著性分析,P<0.05为差异显著(*)。
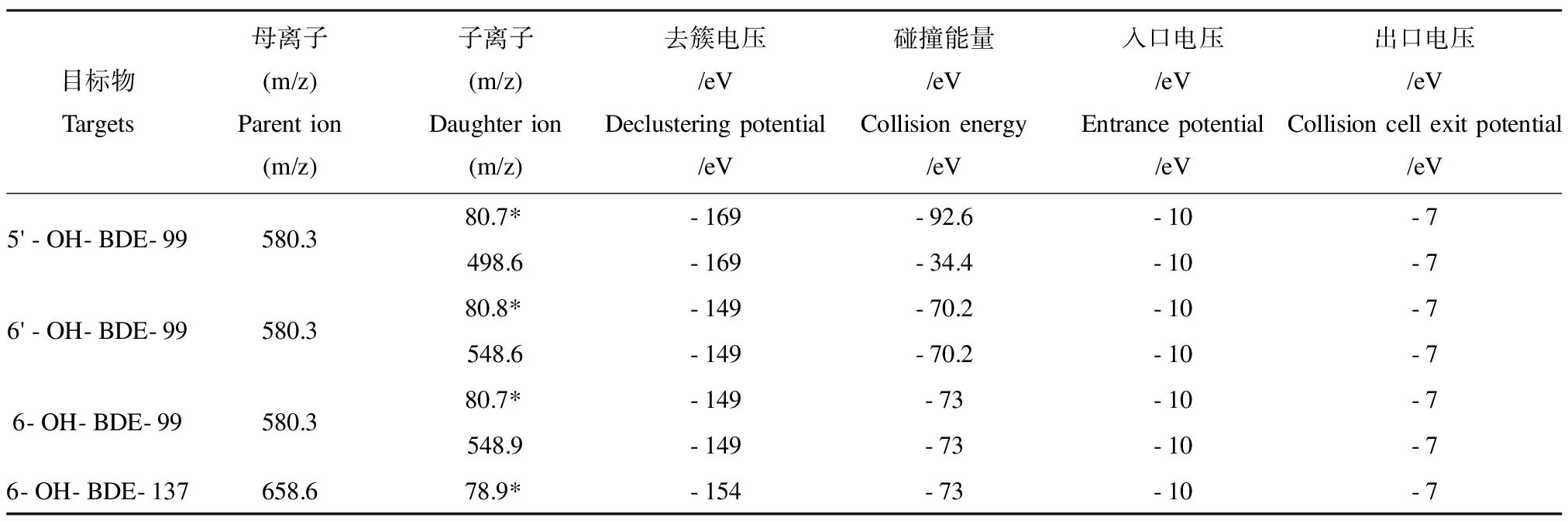
表1 4种OH-PBDEs的质谱条件Table 1 Mass spectrometric conditions of four OH-PBDEs
注:*为定量离子。
Note: * represents quantitative ions.
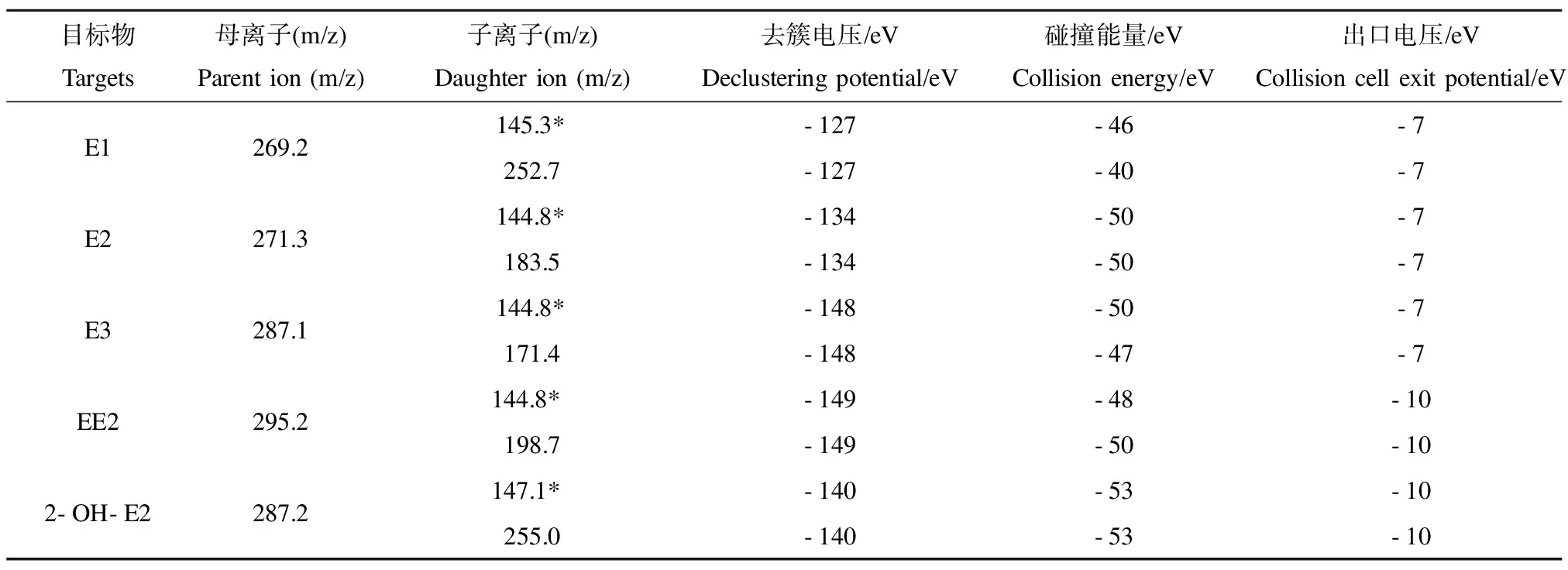
表2 4种雌激素及产物的质谱条件Table 2 Mass spectrometric conditions of four estrogens and products
注:*定量离子; 2-OH-E2表示2-羟基雌二醇。
Note: * represents quantitative ions; 2-OH-E2 stands for 2-hydroxyestradiol.
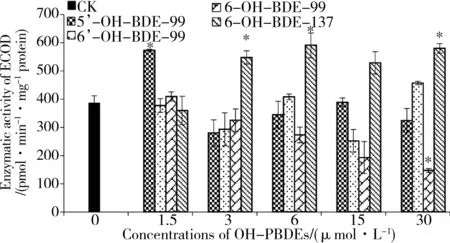
图2 不同浓度的OH-PBDEs对7-乙氧基香豆素-O-脱乙基酶(ECOD)活性的影响注:CK表示未添加OH-PBDEs时,孵育2 h后ECOD活性; *表示与对照相比有显著性差异(P<0.05)。Fig. 2 Effect of OH-PBDEs at different concentrations on the 7-ethoxycoumarin-O-deethylase (ECOD) activityNote: CK indicates ECOD activity after 2 h incubation without OH-PBDEs; * indicates significant difference (P<0.05), compared with CK.
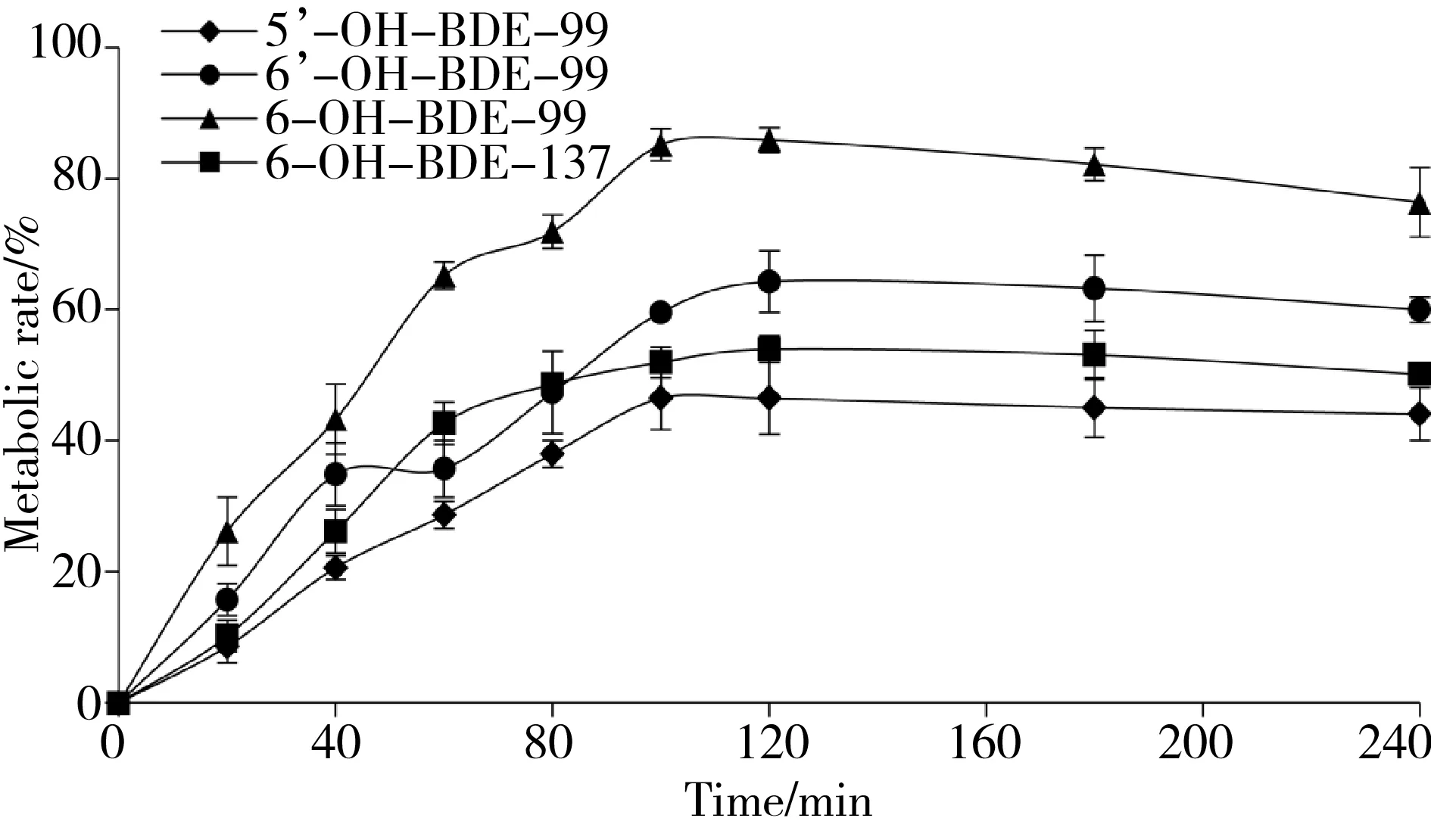
图3 OH-PBDEs与孵育时间的关系Fig. 3 Concentrations of OH-PBDEs as a function of incubation time
2 结果与讨论(Results and discussion)
2.1 OH-PBDEs对ECOD活性的影响
由于ECOD可以表征CYP1A1、CYP1A2、CYP2A6、CYP2B1、CYP2B6、CYP2E1等多种CYP450酶亚系的活性,因此ECOD活性一般可以作为表征CYP450总活性的指标。
在未添加OH-PBDEs时,微粒体孵育2 h后ECOD活性为(2 500±43) pmol·min-1·mg-1protein。不同OH-PBDEs浓度下ECOD活性结果如图2所示,随着反应体系中OH-PBDEs浓度的增加,5'-OH-BDE-99在低浓度(1.5μmol·L-1)下显著促进ECOD活性(P<0.05),其余浓度条件下与对照相比不存在显著性差异;6-OH-BDE-99随浓度的增加降低了ECOD活性,但是与对照相比不存在显著性差异;6-OH-BDE-137在低浓度(1.5μmol·L-1)下对ECOD活性无显著影响,但是随着浓度的增加显著促进ECOD活性,与对照相比存在显著性差异(P<0.05);6'-OH-BDE-99随浓度的增加,对ECOD活性的影响不明显。由此可见,4种OH-PBDEs对微粒体ECOD活性存在不同作用。
2.2 OH-PBDEs的体外代谢
图3为4种OH-PBDEs的代谢率随孵育时间的变化图。由图3可以看出,随孵育时间的增加,4种OH-PBDEs的代谢率逐渐增大,在100 min左右达到最高,反应结束时基本达到平衡位置,其中6-OH-BDE-99代谢率最大,为85.9%,其他3种OH-PBDEs(5’-OH-BDE-99、6’-OH-BDE-99、6-OH-BDE-137)的代谢率分别为46.0%、64.3%、53.9%。
研究表明,溴原子数量会影响OH-PBDEs的代谢,Li等[16]用猪肝微粒体体外代谢3种OH-PBDEs (3’-OH-BDE-7、4’-OH-BDE-17和3-OH-BDE-47),发现代谢率随溴原子数量的增加而降低。Lai和Cai[26]用大鼠肝微粒体体外代谢11种OH-PBDEs,发现溴原子含量较多的6-OH-BDE-137代谢率最小,这与本研究结论一致(6-OH-BDE-137<6-OH-BDE-99)。此外,对于溴原子数量相同的3种五溴OH-PBDEs,醚键与羟基(OH)官能团及溴原子互为邻位时代谢率最高,表明醚键、OH官能团和溴原子的相对位置对代谢有重要影响,这与Lai和Cai[26]以及本实验室[18]前期研究结论一致。
2.3 OH-PBDEs对雌激素体外代谢的影响
4种不同浓度OH-PBDEs对雌激素代谢影响见图4。结果表明,除EE2外(代谢率91.0%),4种OH-PBDEs不同浓度下对其余3种雌激素(E1、E2和E3)代谢具有不同影响。与未添加OH-PBDEs的空白对照组相比(52.3%),5’-OH-BDE-99在实验设置的低浓度时对E1代谢无影响,但是随着实验添加浓度的增加,对E1代谢表现出显著的抑制作用(P<0.05);6’-OH-BDE-99和6-OH-BDE-99在实验设置的低浓度时具有显著的促进作用(P<0.05),但随着实验添加浓度的增加,对E1代谢的促进作用逐渐降低;6-OH-BDE-137在实验设置浓度下对E1代谢无影响。
E2与E1的代谢率接近,为47.1%。与未添加OH-PBDEs的空白对照组相比,5’-OH-BDE-99随实验添加浓度的增加略有降低,但是无显著性影响;其余3种OH-PBDEs在实验设置的低浓度时对E2代谢具有显著的促进作用(P<0.05),但随着实验添加浓度的增加,6’-OH-BDE-99对E2代谢的促进作用逐渐降低,并在实验设置的高浓度时表现出显著的抑制作用(P<0.05),而6-OH-BDE-99和6-OH-BDE-137随着实验添加浓度的增加促进作用略有降低,但仍表现出显著的促进作用(P<0.05)。目前,OH-PBDEs对雌激素代谢的影响的研究报道较少,Lai和Cai[26]研究了BDE 47、6-CH3O-BDE-47和2种OH-PBDEs(2’-OH-BDE-28和3’-OH-BDE-100)在浓度范围0.9~412.0μmol·L-1内对E2代谢的影响,结果发现相对母体BDE 47和甲氧基6-CH3O-BDE-47,2种OH-PBDEs更能够显著抑制E2的代谢,而且对E2代谢表现为非竞争性抑制。与本研究结果不同,这可能与OH-PBDEs的结构以及设置浓度有关,对生物体内E2代谢的差异可能源于OH-PBDEs对本身代谢体系酶活性的影响所致,有待于进一步研究。
E3的代谢率相对较低,仅为16.9%,这可能是由于E3作为E2的代谢物,生物利用性相对较低[28]。与未添加OH-PBDEs的空白对照组相比,5’-OH-BDE-99、6’-OH-BDE-99和6-OH-BDE-99对雌激素代谢影响表现出相似的趋势,在实验设置的低浓度时表现为促进作用,且随着OH-PBDEs浓度的增加,促进作用逐渐增加,在实验设置的高浓度时具有显著的促进作用(P<0.05);6-OH-BDE-137与上述3种OH-PBDEs对E3代谢的影响略有不同,在实验设置的低浓度时对E3代谢具有显著的促进作用(P<0.05),但随着实验添加浓度的增加,6’-OH-BDE-137对E3代谢的促进作用逐渐降低。
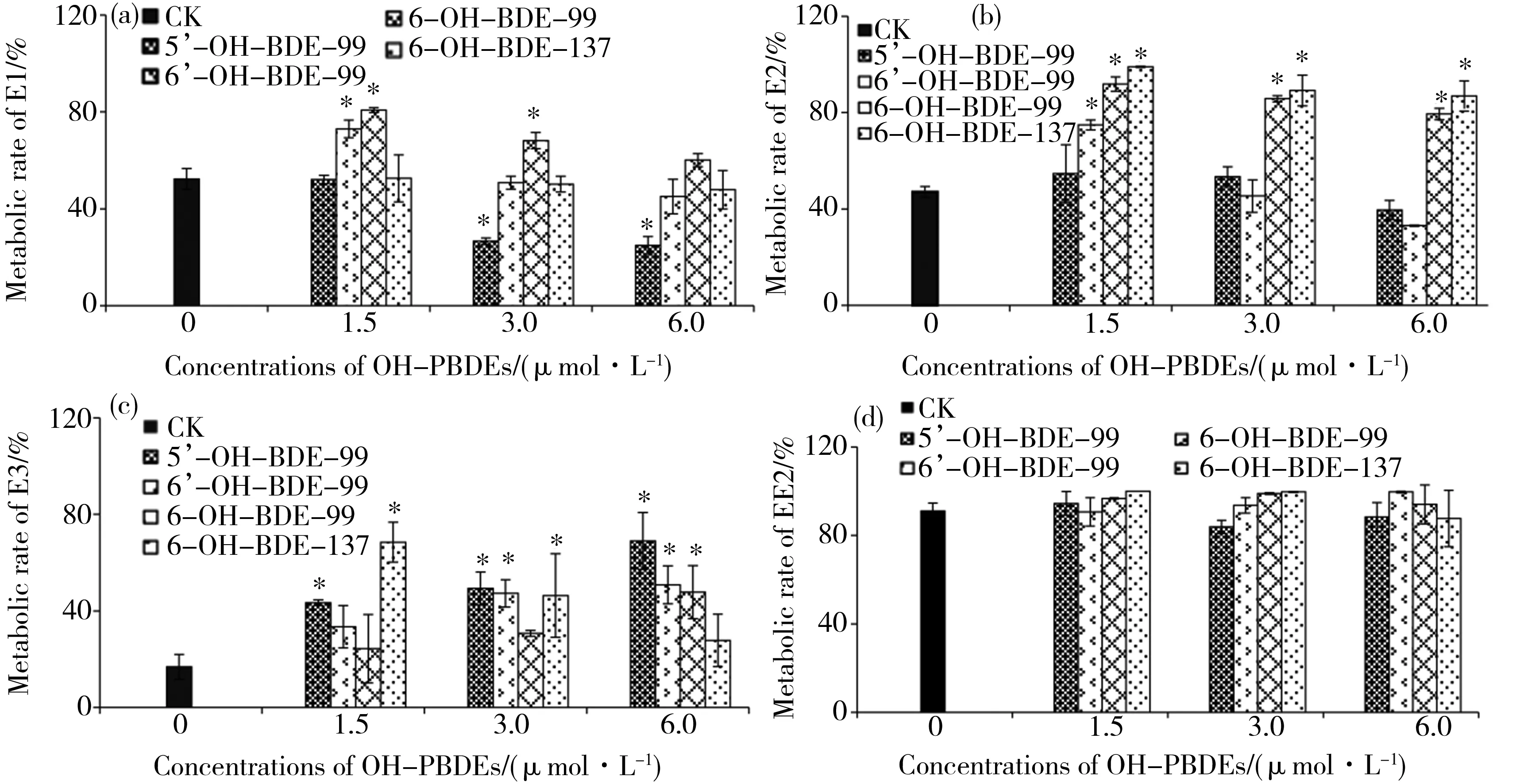
图4 不同浓度OH-PBDEs对雌激素代谢的影响注:CK表示未添加OH-PBDEs时,孵育2 h后雌激素的代谢率;*表示与对照相比有显著性差异(P<0.05)。Fig. 4 Effects of different concentrations of OH-PBDEs on metabolism of estrogensNote: CK indicates metabolic rate of estrogen after 2 h incubation without OH-PBDEs; * indicates significant difference (P<0.05), compared with CK.
由于不同的雌激素是由不同的酶催化[25],Kester等[24]报道了OH-PBDEs对E2磺基转移酶的抑制作用,导致E2硫酸化降低和内源性雌激素的生物利用度增加。因此不同结构和浓度的OH-PBDEs对E1、E2、E3代谢产生的不同效应,在一定程度上说明外源性物质可能对代谢雌激素的生物酶的活性位点产生作用,进而影响其代谢,但是具体如何影响将进一步研究。
雌激素的代谢途径较为复杂,最常见的有2、6α、6β、15α、16α羟基化,17β羟基脱氢氧化以及3-羟基硫酸酯化[29]。为了进一步研究OH-PBDEs对雌激素代谢的影响,以E2为代表定量表征其代谢产物生成量,由于2-OH-E2是E2在I相酶中的主要代谢产物之一,能够评估外源性化合物对E2代谢的抑制[30],因此,本研究利用外标法定量测定了E2代谢产物2-OH-E2的生成量,结果见表3。与未添加OH-PBDEs的空白对照相比,5’-OH-BDE-99能够抑制2-OH-E2的生成量,但是随着实验添加浓度的增加,抑制作用无明显差异;其余3种OH-PBDEs在实验设置的低浓度时对2-OH-E2的生成量具有促进作用,但随着实验添加浓度的增加,6’-OH-BDE-99和6-OH-BDE-137抑制了2-OH-E2的生成量,且6-OH-BDE-137抑制能力更强,而6-OH-BDE-99随着实验添加浓度的增加促进作用反而增加,这表明OH-PBDEs的不同暴露水平对2-OH-E2的生成量存在差异,也间接表明对E2代谢途径的影响不同,有待于进一步研究。
