急性温度胁迫对许氏平鲉肝脏代谢机能和血液指标的影响及生理机制❋
2018-03-16张思敏李吉方温海深吕里康李兰敏
张思敏, 李吉方, 温海深, 吕里康, 李兰敏, 赵 吉
(海水养殖教育部重点实验室(中国海洋大学), 山东青岛 266003)
鱼类是水生低等变温脊椎动物,容易受外界环境的影响。在养殖生产过程中温度、盐度、酸碱度等因素是影响鱼类生长的主要胁迫因子[1]。温度直接影响到鱼类的生长、发育、繁殖、代谢、存活等生命过程。温度的剧烈波动是鱼类在养殖、运输等过程中极易遭遇到的一种环境胁迫[2]。鱼类血液生理生化与环境条件、生理状况等密切相关。当鱼体受到外界因子影响时,必定会在血液指标中反映出来,因此血液指标被广泛用来评价鱼类健康状况、营养状况和对环境适应状况[3-4]。
转氨酶在氨基酸代谢和蛋白质、脂肪与糖类三者相互转化的过程中有极重要的地位,其中以谷草转氨酶(AST)和谷丙转氨酶(ALT)最重要[5]。AST和ALT是联系糖类、脂肪和蛋白质三大物质代谢的关键酶,AST起催化谷氨酸与草酰乙酸之间的转氨作用, ALT起催化谷氨酸与丙酮酸之间的转氨作用。正常情况下,AST 和ALT 主要存在于肝脏中,只有少量被释放到血浆中,血清中的ALT 活性较小。因此,鱼类血清AST和ALT的活性可以被用作监测鱼体的健康状况的指标[6,7]。碱性磷酸酶(ALP) 是一种在生物界中分布广泛的磷酸酯酶,是生物体的一种重要的代谢调控酶,可直接参与生物机体磷酸基团的转移、调节机体磷的代谢、维持体内钙磷比例等作用,为ADP 磷酸化形成ATP 提供所需的无机磷酸[8-9]。
AST、ALT和LDH均是血清肝脏代谢酶,谷草转氨酶基因(GOT1)、谷丙转氨酶基因(GPT1)和乳酸脱氢酶基因(LDH)均在肝脏中表达[10]。在肝脏受到损伤时,AST和ALT被释放进入血液,所以它们在血液中的活性可以用来估计肝损程度。LDH是无氧糖酵解代谢酶,鱼类受到应激,在机体剧烈运动后LDH参与乳酸代谢的氧化还原反应。然而,GOT1、GPT1和LDH的表达水平也可以反映它们的其他功能,如能量代谢变化和代谢改变[11-12]。本研究探讨了在鱼类受到应激时,机体代谢发生改变,相关代谢酶的活性发生变化是否有基因调控参与。
本文从组织学层面分析了急性温度胁迫对许氏平鲉(Sebastesschlegelii)肝脏的影响以及肝脏中GOT1、GPT1和LDH表达水平的变化情况,同时探讨了急性温度胁迫下许氏平鲉血清中2种转氨酶(AST、ALT)、血液生理生化指标,旨在探究许氏平鲉对急性温度胁迫的生理适应及响应机制,丰富鱼类环境生理学内容,为鱼类养殖与运输提供理论依据。
1 材料与方法
1.1 实验对象与实验设计
实验用许氏平鲉于2015年11月采自山东省青岛市黄岛区沿海网箱养殖群体。挑选30尾健康活泼,无伤无病,发育良好的个体(体质量为(610.4±15.7)g,体长为(27.3±1.5)cm)用于实验,将实验鱼饲养在0.6 m3圆柱形塑料白桶中,每桶放置10尾,在室温16 ℃下暂养24 h。
实验设急性低温(5 ℃)胁迫组、急性高温(27 ℃)胁迫组和室温(16 ℃)对照组。暂养结束后,将实验鱼随机分为3组,每组10尾,分别转移到预先设置好的温度梯度环境中。12 h后采集所有实验鱼的待测样品。
1.2 样品采集
采样前将实验鱼放入MS-222麻醉剂(200 mg/L) 中麻醉。先进行尾静脉采血并制备血清和抗凝血分别用于血液生理生化和血细胞分析,然后迅速解剖实验鱼,取新鲜的肝脏组织迅速于液氮中速冻后转移至超低温冰箱(-80 ℃)中保存备用;取部分新鲜肝脏组织用波恩溶液(Bouins)24 h固定后转存于70%酒精。
1.3 石蜡组织切片及观察
肝脏组织经过Bouins固定24 h后,经梯度酒精脱水,二甲苯透明,浸蜡,石蜡包埋,LEICA-RM201切片机连续切片,切片厚度为5 μm,展片,烘干,苏木精-伊红染色(H.E染色),中性树脂封片,晾干。置显微镜下观察并拍照。
1.4 血液样本分析
采用BS-180全自动生化分析仪(迈瑞,深圳)测定血清中的谷草转氨酶(AST),谷丙转氨酶(ALT),碱性磷酸酶(ALP)和乳糖脱氢酶(LDH)的活性以及血糖(GLU)的含量。采用BS-1800全自动血液细胞分析仪(迈瑞,深圳)对采集的抗凝血样品进行检测与分析。所有检测试剂盒均采购自深圳迈瑞生物医疗电子股份有限公司。
1.5 总RNA的提取和cDNA文库的构建
运用Trizol法的相应步骤提取总RNA,使用核酸测定仪测定提取后每个样品总RNA的浓度,以备反转录。同时进行琼脂糖凝胶电泳检测RNA的完整性。使用PrimeScriptTMRT Reagent Kit with gDNA Eraser试剂盒(TAKARA,日本)进行去除基因组DNA和反转录。在RNase-free分子管中加入总RNA0.5~1.0 μL(根据所得到的RNA浓度计算而定),分别加入gDNA Eraser,5×gDNA Eraser Buffer,补加RNase free H2O使分子管中混合液体的总体积达到10 μL。在PCR仪中42 ℃反应,2 min之后立即在冰块上加入反转录试剂。加入上一步反应体系、RNase free H2O、RT Primer Mix、PrimeScript RT Enzyme Mix I、5×PrimeScript Buffer2分别为10、4、1、1、4μL,反应体系为20μL。在PCR仪中37 ℃,15 min、85 ℃,5 s反应,-80 ℃保存备用。
1.6 GPT1、GOT1、LDH相对表达量的分析
根据许氏平鲉转录组数据(NCBI:SRR4409372)得到的GOT1、GPT1和LDH的序列,利用Primer 5.0 软件设计引物,其序列见表1。设计成功的引物由华大基因Oligo进行合成。

表1 基因表达分析的特异性引物
实时荧光定量PCR(qRT-PCR)试剂盒为SYBR Premix Ex TaqTM(TAKARA,日本)。对样品cDNA 进行4倍梯度稀释,以稀释后的cDNA 为模板进行实时定量PCR,每个样品设3个平行。PCR反应体系(共20 μL):SYBR Premix Ex Taq10 μL、上、下游引物各0.4 μL、cDNA模板2.0 μL、ddH2O 6.8 μL。上机程序:95 ℃下预变性30 s、95 ℃下变性5s,相应基因退火温度下退火30 s,72 ℃下延伸40 s,40个循环以后,从退火温度以每30 s 0.4 ℃的增长直至95 ℃。建立标准曲线,根据实时荧光定量PCR的结果,以18 S为内参基因,根据目的基因以及18 S的Ct值,按照2-ΔΔCt法计算目的基因的相对表达量。
1.7 数据处理
本实验数据利用SPSS19.0统计软件进行单因素方差分析(ANOVA),并采用Duncan多重检验法对各组间进行数据处理和检验分析。利用Excel(2007版)和SigmaPlot13.0绘制图表。实验所得数据均表示为平均值±标准误(Mean±S.E.),以P<0.05表示差异显著。
2 结果与分析
2.1 急性温度胁迫对肝脏组织的影响
对照组肝脏组织中肝细胞为多边形,排列整齐有序,细胞间界限清晰,细胞质均匀,细胞核明显呈圆形(见图1B)。高温胁迫组肝脏损伤较为明显,肝细胞排列无序、较多肝细胞均出现空泡化、细胞间界限杂乱模糊、细胞核萎缩,严重的甚至出现溶解(见图1A)。低温胁迫组肝脏组织损伤并不明显,无明显的组织结构变化,肝细胞排列整齐有序,细胞核明显呈圆形,细胞间界限清晰,细胞质均匀(见图1C)。高温胁迫组与对照组相比肝脏组织破损较为严重,而低温胁迫组与对照组相比肝脏组织的变化并不明显。高温可能使肝脏受到了较严重的损伤,低温对肝脏的损伤并不明显。
2.2 急性温度胁迫对许氏平鲉血液指标的影响
由表2可知,高温胁迫组(27 ℃)与对照组(16 ℃)相比,除了平均红细胞血红蛋白含量(MCH)变化不显著,其他指标均出现显著性变化。其中平均红细胞血红蛋白浓度(MCHC)显著下降(P<0.05),从16 ℃时的368.71 g/L下降到27 ℃时的282.78 g/L。而白细胞(WBC)、血红蛋白(HGB)、红细胞数目(RBC)、红细胞压积(HCT)、平均红细胞体积 (MCV)、红细胞分布宽度变异系数(RDW-CV)、红细胞分布宽度标准差(RDW-SD)等指标均显著上升。
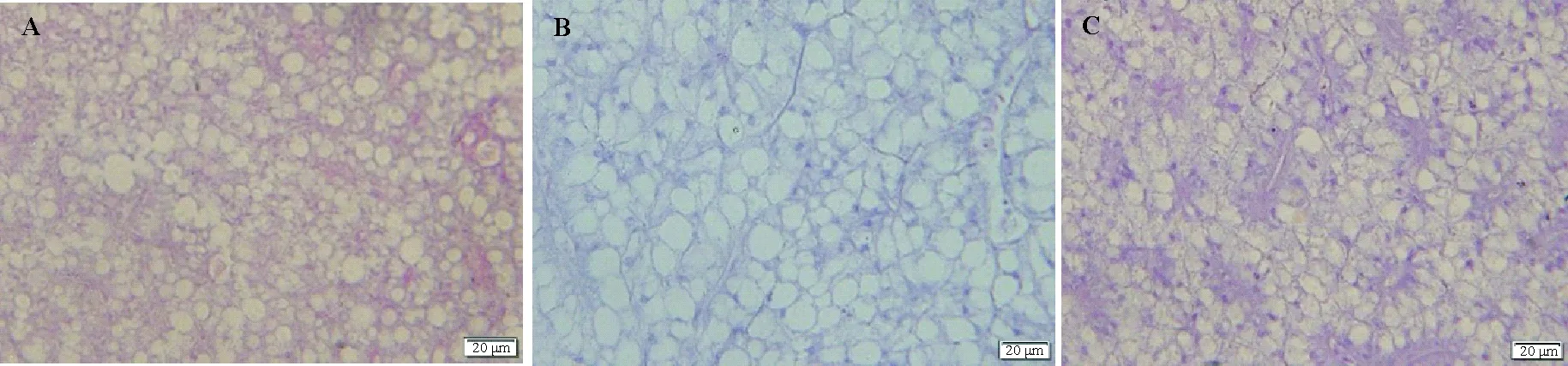
(A:高温胁迫组(27 ℃),B:对照组(16 ℃),C:低温胁迫组(5 ℃)(×400)。比例尺=20μm。A: Thermal treatment (27 ℃). B: Control treatment (16 ℃). C: Cold treatment (5 ℃(×400)). Scale=20μm.)
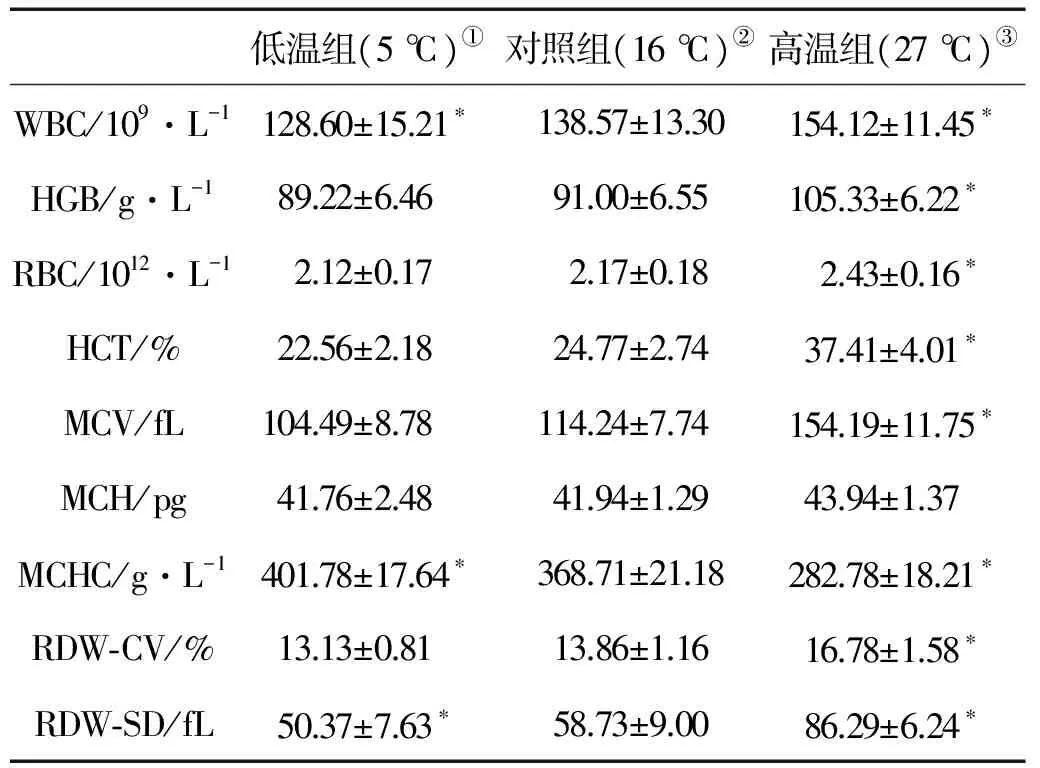
图1 不同温度胁迫下许氏平鲉肝脏组织学变化
注:*表示显著性差异(P<0.05)。
Note:*indicates significant difference (P<0.05).
①Low temperature (5 ℃);②Normal temperature (16 ℃);③Hightemperature (27 ℃)
低温胁迫组(5 ℃)与对照组(16 ℃)相比,白细胞(WBC)和红细胞分布宽度标准差(RDW-SD)显著下降(P<0.05),分别从16 ℃时的138.57×109/L和58.73 fL下降到5 ℃时的128.60×109/L和 50.37 fL。平均红细胞血红蛋白浓度(MCHC)显著上升(P<0.05),由16 ℃时的368.71 g/L下降到5 ℃时的401.78 g/L。其他指标无显著性变化。
2.3 急性温度胁迫对许氏平鲉血清指标的影响
由图2A可知,在高温胁迫下许氏平鲉血清中ALT、AST和ALP的水平分别由16 ℃时的11.54、34.92和46.16 U/L上升到27 ℃时的33.30、112.03和85.84 U/L,且差异显著(P<0.05)。LDH变化并不显著。在低温胁迫下,ALP和LDH的水平显著下降(P<0.05),分别由16 ℃时的46.16和102.38 U/L下降到5 ℃时的15.62和52.58 U/L。而ALT和AST的水平与对照组相比有所下降,但并不显著。急性温度胁迫下许氏平鲉血清中GLU的水平在低温和高温胁迫下均显著上升(P<0.05),由16 ℃时0.97 mmol/L分别上升到5 ℃时3.29 mmol/L、27 ℃时6.14 mmol/L,并且高温胁迫比低温胁迫的GLU水平上升较显著(见图2B)。

(A:急性温度胁迫对许氏平鲉血清中ALT、AST、ALP以及LDH水平的影响;B:急性温度胁迫对许氏平鲉血清中GLU水平的影响。图中标注的小写字母表示同一指标在不同温度之间存在显著性差异(P<0.05)。Effect of acute temperature stress on ALT、 AST、 ALP、 LDH (A) and serum GLU (B) inSebastesschlegelii.Different small letters indicate significant differencesin different temperature of the same index (P<0.05).)
图2 急性温度胁迫对许氏平鲉血清中代谢酶及葡萄糖水平的影响
Fig.2 Effect of acute temperature stress on metabolic enzymes and serum GLU inSebastesschlegelii
2.4 急性温度胁迫对肝脏中GOT1、GPT1和LDH mRNA表达的影响
低温组和高温组GOT1 mRNA的表达水平与对照组相比有所下降,但差异不显著(P>0.05)。处理组GPT1 mRNA的表达水平与对照组相比呈上升趋势,但差异不显著(P>0.05)。低温组LDHmRNA的表达水平相比于对照组几乎不变,但高温组有所上升,无显著性差异(P>0.05)。
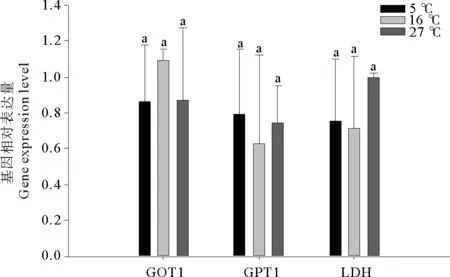
(图中标注的小写字母表示同一指标在不同温度之间存在显著性差异(P<0.05)。Different small letters indicate significant differencesin different temperature of the same index (P<0.05).)
图3 急性温度胁迫对许氏平鲉肝脏中GOT1、GPT1和LDHmRNA相对表达水平的影响
Fig.3 Effect of acute temperature stress on the expression level ofGOT1、GPT1 andLDHmRNA in the liver ofSebastesschlegelii
3 讨论
肝脏是鱼体内较大的组织器官,是维持生命活动和物质代谢的重要器官之一。大量研究表明,当肝脏受到损伤后主要表现为肝细胞空泡化、细胞核偏移,严重的导致细胞核溶解、细胞破损、细胞间界线模糊等[13]。Liu B等[14]对团头鲂(Megalobramaamblycephala)高温处理48 h后,与对照组相比,肝脏细胞细胞核偏移到细胞边缘,细胞质流失,细胞核萎缩并呈多边形,表明高温导致肝脏细胞受损。Salazar-Lugo R等[15]对大盖巨脂鲤(Colossomamacropomum)进行温度处理后,高温29 ℃的肝细胞结构异常、核溶解,部分区域细胞坏死;低温18 ℃的肝脏组织出现空泡化,表明高温和低温会导致肝脏会受到不同程度的损伤。本研究表明,高温27 ℃时,肝脏损伤较为明显,肝细胞排列杂乱、较多肝细胞均出现空泡化、细胞间界限杂乱模糊、细胞核萎缩,严重的甚至出现溶解,而低温5 ℃时,与对照组相比,肝脏组织损伤并不明显。高温使肝脏受到了较严重的损伤,低温对肝脏的损伤并不明显,这表明许氏平鲉不耐高温,较耐低温,高温使肝脏损伤较为严重。
在血液中WBC、HGB、RBC等,常被作为评价鱼类应激状况的辅助指标。而在鱼类血液中RBC和HGB主要是受水温的影响。鱼类血液中WBC是参与机体免疫的重要成分。鱼体受到急性温度胁迫后,血液中WBC的数量发生改变,标志着机体免疫机能的改变[16-17]。黄姻等[18]研究表明,随温度降低,罗非鱼(Oreochromisniloticus)血液的HGB、MCH和MCHC均明显升高,12 ℃时RDW-CV显著下降。MCHC和RDW-CV与本研究结果一致。温海深等[19]研究表明,在高温27 ℃处理2h,6h后许氏平鮋HGB和RBC呈先上升后下降的趋势,WBC显著上升。在本研究中,高温27 ℃处理12h后,MCHC显著下降,许氏平鮋血液中WBC、HGB、RBC、HCT、MCV、RDW-CV、RDW-SD等指标均显著上升。HGB和RBC显著升高,可能是由于当水温升高时,鱼类新陈代谢增强,并且运动加剧,对氧的消耗量增加,导致了HGB和RBC上升。WBC显著上升,可能是由于机体的免疫系统对高温应激应答的结果。低温5 ℃处理12h后,随着温度的降低,WBC和RDW-SD显著下降,MCHC显著上升,其他指标变化不明显,说明许氏平鲉对低温有较强的耐受性,而不耐高温,高温时血液中大多数指标出现显著性差异。
血清中AST和ALT活性是检测肝脏功能是否正常的重要指标。正常生理代谢条件下, AST和ALT只有少量被释放到血浆中,因此,血清中AST和ALT活性较小[20]。但当机体受到外界环境胁迫,如温度过低或过高时,可能造成机体损伤,尤其会造成正常的肝脏细胞受损,导致肝脏中的AST和ALT被释放至血液中影响机体正常的代谢功能。ALP能够直接参与调节磷代谢,为ADP磷酸化形成ATP提供更多所需的无机磷酸。LDH是参与糖酵解酶的重要酶,也是公认的组织损伤的潜在标记[21-22]。Dalvi R S等[23]研究表明,在高温33和36 ℃时,短体下眼鲿(Horabagrusbrachysoma)血清中ALT、AST和LDH的活性随温度的升高而升高,与对照组26 ℃相比,差异显著(P<0.05),在高温36 ℃时, ALP的活性比对照组26 ℃也升高。这与本研究结果基本一致。在本研究中,高温27 ℃时,血清中ALT和AST的活性显著上升,可能是由于鱼体受到胁迫,引起肝脏受损,细胞内的AST和ALT被释放到血液中,导致血液中这2种酶的活性显著升高。27 ℃时,ALP的活性显著升高,5 ℃时,ALP的活性显著下降。ALP是一种重要的代谢调控酶,其活性主要受温度的影响。鱼类处于应激状态时,将影响血清中ALP活性[24]。因此,许氏平鲉体内代谢受了到温度胁迫的影响。27 ℃时,LDH活性也有所上升,5 ℃时,LDH活性显著下降,说明糖代谢途径也受到了温度胁迫的影响。在应激反应中能量代谢方面以血糖的变化为主要指标[25]。在Lermen C L等[26]研究中,鲶鱼(Rhamdiaquelen)血清中血糖在高温31 ℃时升高,在低温15 ℃时降低。而在本研究中,高温27 ℃和低温5 ℃时,血糖水平均显著升高。鱼类受到温度胁迫时,一方面可能由于交感—肾上腺髓质系统被调动起来,作用于中枢神经系统,以利于应急时重要器官得到更多的血液供应;另一方面由于机体为了抵抗温度应激,以适应在应激情况下对能量的需要,加快了糖的利用,糖异生作用加强,血糖含量不断上升,使葡萄糖含量超过正常水平[27-29]。
Edgar A D[30]等研究表明,ALT和AST广泛用于组织损伤过程中血清标记,其中基因调控也是在增加血清转氨酶的活性的一个重要因素。然而在本研究中,GOT1、GPT1和LDHmRNA的表达水平虽然有所变化,但均不显著(P>0.05)。这表明血清中ALT、AST和LDH的活性变化并没有受到基因表达的调控,同时进一步证明,血清中ALT和AST活性的上升是由于高温使肝脏受到了损伤,肝组织中的ALT和AST进入到了血清中,而非由于基因表达水平上升造成了血清中ALT和AST活性上升。
4 结语
急性温度胁迫对许氏平鲉肝脏代谢和血液生理生化指标产生了一定影响。各项结果表明,许氏平鲉对高温胁迫更敏感,较耐低温,养殖适宜温度范围为18~24 ℃,建议在养殖和运输过程中,尽量避免高温对许氏平鲉的胁迫。
[1] 洪磊, 张秀梅. 环境胁迫对鱼类生理机能的影响[J]. 海洋科学进展, 2004, 22(1): 114-121.
HONG Lei, ZHANG Xiu-mei. Effects of environmental stress on physiological function of fish[J]. Advances in Marine Science, 2004, 22(1): 114-121.
[2] Pankhurst N W, King H R. Temperature and salmonid reproduction: implications for aquaculture. [J]. Journal of Fish Biology, 2010(76): 69-85.
[3] 陈洁, 熊邦喜, 顾钱洪, 等. 内源及外源因子对鱼类血液生理生化指标的影响[J]. 湖北农业科学, 2011, 50(9): 1861-1865.
CHEN Jie, XIONG Bang-xi, GU Qian-hong, et al. The effect of endogenous and environment factors on hematology physiological and biochemical indices of fish[J]. Hubei Agricultural Sciences, 2011, 50(9): 1861-1865.
[4] 韩京成, 刘国勇, 梅朋森, 等. 温度对鲫血液生化指标和消化酶的影响[J]. 水生态学杂志, 2010, 3(1): 87-92.
HAN Jing-cheng, LIU Guo-yong, MEI Peng-sen, et al. Effects of temperature on the hematological indices and digestive enzyme activities of crucian carp (Carassiusauratus)[J]. Journal of Hydroecology, 2010, 3(1): 87-92.
[5] 何福林, 向建国, 李常健, 等. 水温对虹鳟血液学指标影响的初步研究[J]. 水生生物学报, 2007, 31(3): 363-369.
HE Fu-Lin, XIANG Jian-Guo, LI Chang-Jian, et al. Preliminary study on the effect of water temperature on hematology indices of rainbow trout[J]. Acta Hydrobiologica Sinica, 2007, 31(3): 363-369.
[6] Hermenean A, Damache G, Albu P, et al. Histopatological alterations and oxidative stress in liver and kidney of Leuciscus cephalus following exposure to heavy metals in the Tur River, North Western Romania[J]. Ecotoxicology & Environmental Safety, 2015, 119(9): 198-205.
[7] 管标, 温海深, 刘群, 等. 急性温度胁迫对虹鳟肝脏代谢酶活性及生长相关基因表达的影响[J]. 大连海洋大学学报, 2014(6): 566-571.
GUAN Biao, WEN Hai-shen, LIU Qun, et al. Effects of acute temperature stress on metabolic enzyme activity and gene expression related to growth in rainbow troutOncorhynchusmykiss[J]. Journal of Dalian Ocean University, 2014(6): 566-571.
[8] Jia R, Liu B L, Han C, et al. The physiological performance and immune response of juvenile turbot (Scophthalmusmaximus) to nitrite exposure[J]. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp, 2016, 40: 181-182.
[9] 冯广朋, 庄平, 章龙珍, 等. 温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J]. 水生生物学报, 2012, 36(1): 137-142.
FENG Guang-Peng, ZHUANG Ping, ZHANG Long-Zhen, et al. Effects of water temperature on metabolic enzyme and antioxidase activities in juvenile Chinese sturgeon (AcipenserSinensis)[J]. Acta Hydrobiologica Sinica, 2012, 36(1): 137-142.
[10] Wu S J, Lin Y X, Ye H, et al. Prognostic value of alkaline phosphatase, gamma-glutamyl transpeptidase and lactate dehydrogenase in hepatocellular carcinoma patients treated with liver resection[J]. International Journal of Surgery, 2016, 36(A): 143-151.
[11] Honma K, Kamikubo M, Mochizuki K, et al. Insulin-induced inhibition of gluconeogenesis genes, including glutamic pyruvic transaminase 2, is associated with reduced histone acetylation in a human liver cell line. [J]. Metabolism-clinical & Experimental, 2017, 71: 118-124.
[12] Echigoya Y, Sato T, Itou T, et al. Molecular characterization and expression pattern of the equine lactate dehydrogenase A and B genes. [J]. Gene, 2009, 447(1): 40.
[13] 王晓光. 溴氰菊酯对斑马鱼鳃、肝脏的影响[D]. 济南:山东师范大学, 2015.
WANG Xiao-guang. Effect of Deltamethrin on Gills and Livers in Danio Rerio[D]. Jinan: Shandong Normal University, 2015.
[14] Liu B, Xu P, Brown P B, et al. The effect of hyperthermia on liver histology, oxidative stress and disease resistance of the Wuchang bream, Megalobrama amblycephala. [J]. Fish & Shellfish Immunology, 2016, 52: 317-324.
[15] Salazar Lugo R, Mata C, Oliveros A, et al. Histopathological changes in gill, liver and kidney of neotropical fish Colossoma macropomum exposed to paraquat at different temperatures[J]. Environmental Toxicology & Pharmacology, 2011, 31(3): 490-495.
[16] Qiang J, Yang H, Wang H, et al. Interacting effects of water temperature and dietary protein level on hematological parameters in Nile tilapia juveniles,Oreochromisniloticus(L.) and mortality underStreptococcusiniaeinfection[J]. Fish & Shellfish Immunology, 2013, 34(1): 8-16.
[17] 崔素丽. 高温下大黄素对团头鲂生长、血液指标及抗氨氮应激的影响[D]. 南京:南京农业大学, 2012.
CUI Suli. Effects of Emodin on Growth, Blood Physiology and Resistance to Ammonia Nitrogen tress in Wuchang Bream (MegalobramaAmblycephala)Under High Temperature[D]. Nanjing:Nanjing Agricultural University, 2012.
[18] 黄姻, 唐章生, 林勇, 等. 低温胁迫对罗非鱼生理生化指标的影响[J]. 水产科技情报, 2012, 39(4): 193-197.
HUAN Yin, TANG Zhang-sheng, LIN Yong, et al. Effects of low temperature stress on physiological and biochemical indexes of tilapia[J]. Fisheries Science & Technology Information, 2012, 39(4): 193-197.
[19] 温海深, 吕里康, 李兴敏, 等. 急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 44-51.
WEN Hai-Shen, LV Li-Kang, LI Lan-Min, et a1. Effect of temperature on physiological and biochemical parameters and gene expression of maleSebastesschlegelii[J]. Periodical of Ocean University of China, 2016, 46(11): 44-51.
[20] 强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromisniloticus)幼鱼生化指标和肝脏HSP70mRNA表达的影响[J]. 海洋与湖沼, 2012, 43(5): 943-953.
QIANG Jun, YANG Hong, WANG Hui, et al. The effect of acute temperature stress on biochemical indices and expression of liver HSP70 mRNA in gift nile tilapia juveniles(Oreochromisniloticus)[J]. Oceanologia et Limnologia Sinica, 2012, 43(5): 943-953.
[21] Peres H, Santos S, Olivateles A. Blood chemistry profile as indicator of nutritional status in European seabass (Dicentrarchuslabrax). [J]. Fish Physiology and Biochemistry, 2014, 40(5): 1339-1347.
[22] Abhijith B D, Ramesh M, Poopal R K. Responses of metabolic and antioxidant enzymatic activities in gill, liver and plasma of Catla catla, during methyl parathion exposure[J]. Journal of Basic & Applied Zoology, 2016, 77: 31-40.
[23] Dalvi R S, Das T, Debnath D, et al. Metabolic and cellular stress responses of catfish, Horabagrus brachysoma, (Günther) acclimated to increasing temperatures[J]. Journal of Thermal Biology, 2017, 65: 32-40.
[24] 张亚晨, 温海深, 李兰敏, 等. 急性温度胁迫对妊娠期许氏平鲉血清皮质醇和血液生理指标的影响[J]. 水产学报, 2015, 39(12): 1872-1882.
ZHANG Ya-chen, WEN Hai-shen, LI Lan-min, et al. Effect of acute temperature stress on serum cortisol and hematological physiology of gestatedSebastesschlegelii[J]. Journal of Fisher of China, 2015, 39(12): 1872-1882.
[25] Ottolenghi C, Puviani A C, Ricci D, et al. The effect of high temperature on blood glucose level in two teleost fish ( Ictalurus melas, and Ictalurus punctatus )[J]. Comparative Biochemistry & Physiology Part A Physiology, 1995, 111(2): 229-235.
[26] Lermen C L, Lappe R, Crestani M, et al. Effect of different temperature regimes on metabolic and blood parameters of silver catfishRhamdiaquelen[J]. Aquaculture, 2004, 239(1-4): 497-507.
[27] 彭婷, 胡庭俊, 林勇, 等. 低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响[J]. 水产科学, 2012, 31(5): 259-263.
PENG Ting, HU Ting-j un, LIN Yong, et al. Effects of low temperature stress on indices of biochemistry, immunity and antioxidation in nile tilapi[J]. Fisheries Science, 2012, 31(5): 259-263.
[28] Eme J, Dabruzzi T F, Bennett W A. Thermal responses of juvenile squaretail mullet (Lizavaigiensis) and juvenile crescent terapon (Teraponjarbua) acclimated at near-lethal temperatures, and the implications for climate change[J]. Journal of Experimental Marine Biology & Ecology, 2011, 399(1): 35-38.
[29] Di M P, Priori A, Finoia M G, et al. Physiological responses of European sea bassDicentrarchuslabraxto different stocking densities and acute stress challenge[J]. Aquaculture, 2008, 275(1-4): 319-328.
[30] Edgar A D, Tomkiewicz C, Costet P, et al. Fenofibrate modifies transaminase gene expression via a peroxisome proliferator activated receptor alpha-dependent pathway. [J]. Toxicology Letters, 1998, 98(1-2): 13-23.
