胸腺瘤组织c-kit、PTEN表达变化及其与WHO分型、患者预后的关系
2018-03-15夏钰弘杨树东郭庆孙爱娟洪建刚
夏钰弘,杨树东,郭庆,孙爱娟,洪建刚
(南京医科大学附属无锡市人民医院,江苏无锡 214023)
胸腺瘤是以胸腺存在上皮细胞和淋巴细胞为特征的胸腺上皮肿瘤,是常见的纵隔肿瘤,约占前纵隔病变的50%[1],其发病原因尚不明确[2]。WHO根据胸腺瘤微观结构变化、上皮细胞形态、上皮细胞/淋巴细胞将胸腺瘤分为A型、AB型、B1型、B2型、B3型及C型(胸腺癌),胸腺瘤患者的预后与肿瘤组织学类型和分级密切相关。胸腺瘤患者的5年和10年总生存率分别为95%和91%,而胸腺癌患者分别为60%和40%[3,4]。既往研究显示,c-kit、PTEN均与肿瘤发生、发展密切相关[5,6]。本研究观察了胸腺瘤组织c-kit、PTEN表达变化,并探讨其与WHO分型及患者预后的关系。
1 资料与方法
1.1 临床资料 选取2009年3月~2016年1月于我院行手术治疗的胸腺瘤患者64例,其中男37例、女27例,年龄30~76(59.3±8.2)岁;均经术后病理检查证实诊断。WHO分型:A型9例,AB型16例,B1型7例,B2型21例,B3型4例,C型(胸腺癌)7例;Masaoka分期:Ⅰ期20例,Ⅱ期18例,Ⅲ期17例,Ⅳ期9例。术前均未行放化疗及免疫治疗。排除存在其他肿瘤或癌症病史者,合并心肝肾等功能不全者。收集患者术中切除的胸腺瘤组织64例份作为观察组,颈部淋巴结清扫过程中存在的正常胸腺组织50例份作为对照组。本研究通过医院伦理委员会审核,患者及其家属均知情同意。
1.2 c-kit、PTEN表达检测 采用免疫组化法。取两组石蜡包埋的组织标本,4 μm厚度切片,二甲苯脱蜡,以70%、80%、90%、95%及无水乙醇梯度脱水。将样品以柠檬酸钠修复液(pH值为6.0)中孵育20 min,3%过氧化氢中孵育10 min,10%正常山羊血清中孵育30 min。加入c-kit、PTEN一抗,4 ℃孵育过夜,以加入磷酸盐缓冲溶液(PBS)孵育的切片作为阴性对照。将切片与生物素化的二抗孵育30 min,链霉亲和素过氧化物酶孵育15 min。每个孵育步骤均在37 ℃条件下进行,PBS洗涤3次,每次5 min。去除PBS,加入100 μL DAB溶液,于显微镜下观察直到显色。自来水冲洗后,苏木精进行复染,氨水返蓝后自来水冲洗。最后将切片加入乙醇中脱水、二甲苯透明。c-kit蛋白表达定位于细胞质和细胞膜,染色后阳性表达呈黄色颗粒。PTEN表达定位于细胞质,染色后阳性表达呈棕色颗粒。染色强度及阳性细胞百分比由两名对临床和病理资料不知情的病理医师独立进行评分。染色强度:无染色为0分,淡黄色为1分,棕色为2分,棕黄色颗粒状为3分。阳性细胞百分比[10]:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。计算染色强度及阳性细胞比例评分乘积,≥6定义为阳性表达,<6定义为阴性表达。
1.3 随访方法 通过电话、信访、门诊等方式进行随访,随访至2017年5月,记录患者的生存情况。分析胸腺瘤组织c-kit、PTEN表达与WHO分型及患者预后的关系。
1.4 统计学方法 采用SPSS20.0统计软件。计数资料以率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组c-kit、PTEN表达比较 观察组及对照组c-kit阳性表达率分别为23.4%(15/64)、2%(1/50),PTEN阳性表达率分别为62.5%(40/64)、84.0%(42/50),P均<0.05。
2.2 胸腺瘤组织c-kit、PTEN表达与WHO分型的关系 A型、AB型胸腺瘤组织c-kit阳性表达率均为0, B3型、C型c-kit阳性表达率均高于B1型、B2型(P均<0.05),B3型与C型胸腺瘤组织c-kit阳性表达率比较差异无统计学意义(P>0.05)。B3型、C型胸腺瘤组织PTEN阳性表达率均低于A型、AB型、B1型及B2型(P均<0.05),B3型与C型胸腺瘤组织PTEN阳性表达率比较差异无统计学意义(P>0.05)。不同WHO分型的胸腺瘤组织c-kit、PTEN表达情况见表1。
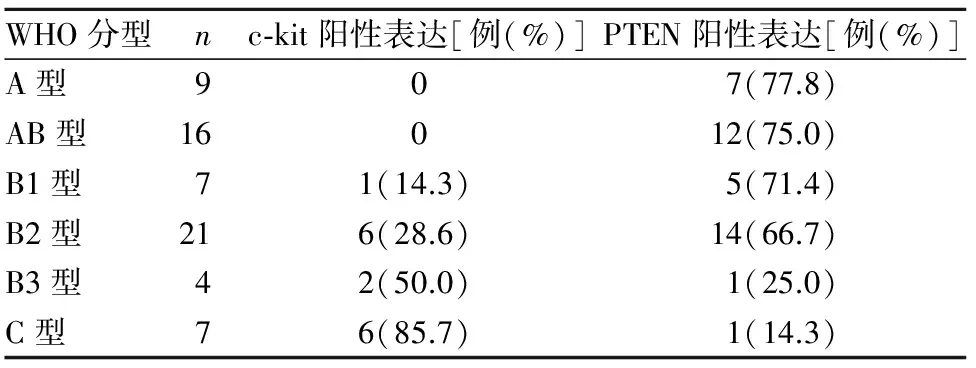
表1 不同WHO分型的胸腺瘤组织c-kit、PTEN表达情况
2.3 胸腺瘤组织c-kit、PTEN表达与患者预后的关系 患者术后随访14~96个月。c-kit阳性及阴性表达的胸腺瘤患者总体生存率分别为56.3%(9/16)、95.8%(46/48),二者比较P<0.05;见图1。PTEN阳性及阴性表达的胸腺瘤患者总体生存率分别为91.7%(33/36)、71.4%(20/28),二者比较P<0.05;见图2。
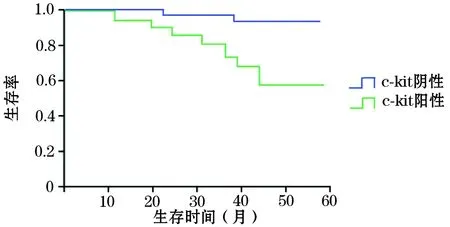
图1 c-kit阳性及阴性表达的胸腺瘤患者生存曲线
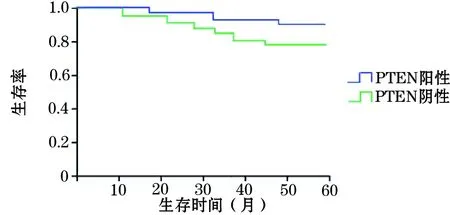
图2 PTEN阳性及阴性表达的胸腺瘤患者生存曲线
3 讨论
c-kit是由原癌基因c-kit编码的酪氨酸激酶受体蛋白,其与配体结合后通过介导广泛的级联反应参与细胞分化、增殖、迁移、侵袭和凋亡过程。研究发现,c-kit在多种肿瘤细胞中表达异常,如乳腺癌、前列腺癌、肝癌等[7~9]。c-kit是多种肿瘤的成熟和潜在预测生物标志物,如胃肠癌等[10]。Kit抑制剂是胸腺瘤患者单克隆治疗的靶向药物之一[11]。研究表明,胸腺瘤组织c-kit异常与患者的疾病进展及预后密切相关[12]。WHO根据胸腺瘤的组织学改变将标本进行病理分型:①A型:肿瘤组织内见厚的纤维间隔,部分区域肿瘤细胞形成实性片状结构,瘤细胞呈卵圆形及短梭形,淋巴样细胞稀少。②B型:淋巴细胞散在分布肿瘤性上皮细胞,上皮细胞呈圆形、卵圆形,根据淋巴细胞分布情况,进一步分为B1、B2、B3型。③AB型:肿瘤组织呈分叶状,部分为梭形细胞席纹状或卵圆形排列,部分为小淋巴细胞中见散在的上皮样细胞,表现为A型与B型混合型。③C型(胸腺癌):肿瘤细胞巢状分布,细胞多边形,核大深染,肿瘤细胞周围炎细胞浸润,表现出明显恶性肿瘤细胞学特征。既往研究发现,B2型、B3型胸腺癌细胞较A型、AB型、B1型侵袭性更高,提示WHO分型是与胸腺瘤预后相关的因素[13,14]。本研究结果显示,胸腺瘤组织c-kit阳性表达率明显高于正常胸腺组织,并随着WHO分型级别的升高而逐渐升高,c-kit阳性表达的胸腺瘤患者总体生存率明显低于阴性表达患者。提示胸腺瘤组织c-kit表达升高,并提示WHO分型级别较高的患者预后较差,与既往研究结论一致[15]。
PTEN是位于10q23.3上的肿瘤抑制基因,编码多功能磷酸酶。PTEN是第一个被报道的具有磷酸化酶活性的肿瘤抑制基因,其通过负向调控磷脂酰肌醇3-激酶(PI3K)途径,在细胞凋亡、细胞周期阻滞和细胞迁移中发挥关键作用[16]。既往在多种恶性肿瘤细胞系中均发现PTEN基因缺陷和蛋白表达异常[17],在多种肿瘤组织如脑肿瘤、前列腺癌、小细胞肺癌、乳腺癌等中均发现PTEN的频繁缺失和突变[18]。本研究结果显示,胸腺瘤组织PTEN阳性表达率明显低于正常胸腺组织,并随着WHO分型级别的升高而逐渐降低,PTEN阳性表达的胸腺瘤患者总体生存率明显高于阴性表达患者。提示胸腺瘤组织PTEN表达降低,并提示WHO分型级别较高的患者预后较差。
综上所述,胸腺瘤组织c-kit表达升高、PTEN表达降低,并与患者的WHO分型级别升高及预后不良有关。检测瘤组织c-kit、PTEN表达有助于判断胸腺瘤的病理分型,对胸腺瘤的临床治疗和预后判断有指导作用。本研究样本量较小,关于c-kit和PTEN在胸腺瘤中的具体作用机制仍有待深入探究。
[1] Kaiser LR, Surgical treatment of thymic epithelial neoplasms[J]. Hematol Oncol Clin North Am, 2008,22(3):475-488.
[2] Serpico D, Trama A, Haspinger ER, et al. Available evidence and new biological perspectives on medical treatment of advanced thymic epithelial tumors[J]. Ann Oncol, 2014,26(5):838-847.
[3] Marx A, Chan JK, Coindre JM, et al. The 2015 World Health Organization classification of tumors of the thymus: continuity and changes[J]. J Thoracic Oncol, 2015,10(10):1383-1395.
[4] Marx A, Ströbel P, Badve SS, et al. ITMIG consensus statement on the use of the WHO histological classification of thymoma and thymic carcinoma: refined definitions, histological criteria, and reporting[J]. J Thoracic Oncol, 2014,9(5):596-611.
[5] Ahmad U, Yao X, Detterbeck F, et al. Thymic carcinoma outcomes and prognosis: results of an international analysis[J]. J Thorac Cardiovasc Surg, 2014,149(1):95-101.
[6] Safieddine N, Liu G, Cuningham K, et al. Prognostic factors for cure, recurrence and long-term survival after surgical resection of thymoma[J]. J Thorac Cardiovasc Surg, 2014,9(7):1018-1022.
[7] Ulivi P, Zoli W, Medri L, et al. c-kit and SCF expression in normal and tumor breast tissue[J]. Brest Cancer Res Treat, 2004,83(1):33-42.
[8] Atala A. Re: bone-induced c-kit expression in prostate cancer: a driver of intraosseous tumor growth[J]. J Urol, 2015,194(1):260.
[9] Andres R, Zhang P, Wang Y, et al. A Positive TGF-beta/c-KIT feedback loop drives tumor progression in advanced primary liver cancer[J]. Neoplasia, 2016,18(6):371-386.
[10] Koch C, Trojan J. Established and potential predictive biomarkers in gastrointestinal cancer--c-Kit, Her2, Ras and Beyond[J]. Digestion, 2015,91(4):294-302.
[11] Chau NG, Kim ES, Wistuba I. The multidisciplinary approach to thymoma: combining molecular and clinical approaches[J]. J Thorac Oncol, 2010,5(10 Suppl 4):313-317.
[12] Aisner SC, Dahlberg S, Hameed MR, et al. Epidermal growth factor receptor, C-kit, and Her2/neu immunostaining in advanced or recurrent thymic epithelial neoplasms staged according to the 2004 World Health Organization in patients treated with octreotide and prednisone: an Eastern Cooperative Oncology Group study[J]. J Thoracic Oncol, 2010,5(6):885-892.
[13] Chen G, Marx A, Chen WH, et al. New WHO histologic classification predicts prognosis of thymic epithelial tumors: a clinicopathologic study of 200 thymoma cases from China [J]. Cancer, 2002,95(2):420-429.
[14] Rena O, Papalia E, Maggi G, et al. World Health Organization histologic classification: an independent prognostic factor in resected thymomas [J]. Lung Cancer, 2005,50(1):59-66.
[15] Song N, Chen G, Zhang P, et al. Diagnostic and clinical significance of KIT(CD117) expression in thymic epithelial tumors in China[J]. Asian Pac J Cancer Prev, 2012,13(6):2745-2748.
[16] Zhu Y, Hoell P, Ahlemeyer B, et al. PTEN: a crucial mediator of mitochondria-dependent apoptosis[J]. Apoptosis, 2006,11(2):197-207.
[17] Yang L, Kuang LG, Zheng HC, et al. PTEN encoding product: a marker for tumorigenesis and progression of gastric carcinoma[J]. World J Gastroenterol, 2003,9(1):35-39.
[18] 苏连明,朱雯,王程程.抑癌基因PTEN研究进展[J].牡丹江医学院学报,2010,31(2):77-78.
