脂肪干细胞与羟基磷灰石/β-磷酸三钙复合体在兔椎体缺损修复中的应用效果
2018-03-15王腾飞宋兴华龙志成麦麦提艾力阿不力克木陈江涛陶颖杨勇
王腾飞,宋兴华,龙志成,麦麦提艾力·阿不力克木,陈江涛,陶颖,杨勇
(新疆医科大学第一附属医院,乌鲁木齐 830054)
~11%。脊柱结核是最常见的骨关节结核,占所有骨结核患者的50%以上。骨结核最常用的治疗方法是外科手术清除骨结核病灶。而结核病灶清除后,留有的骨缺损称为结核性骨缺损[2~4]。结核性骨缺损的修复一直是临床上的难题。自体骨移植是修复结核性骨缺损的“金标准”[5],但自体骨来源有限,患者术后易出现取骨区感染、疼痛等。同种异体骨移植有免疫排斥、愈合缓慢、容易感染等确点。因此研发新型骨缺损修复材料迫在眉睫。Vacanti等[6]提出的骨组织工程技术为骨缺损的治疗提供了新的方法。骨组织工程技术的3个基本要素为种子细胞、支架材料、细胞生长和分化因子。种子细胞是构建骨组织工程和应用的重要环节[7],脂肪干细胞(ADSCs)作为新的种子细胞,由于来源丰富、取材方便、对机体组织损伤小、增殖快、能多向分化、获取数量大等众多优点迅速成为新的研究热点[8,9]。理想的骨组织工程支架材料需要良好的生物相容性,适宜的生物降解性,羟基磷灰石不仅能满足以上条件,而且植入体内不仅安全、无毒,还具有一定的骨传导性[10]。但目前尚未见用rADSCs和羟基磷灰石/β-磷酸三钙(HA/β-TCA)复合体修复骨缺损的研究。本研究用分化诱导后的rADSCs与HA/β-TCA复合后植入兔椎体缺损中,观察其修复兔椎体缺损的效果。现报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康新西兰大白兔38只,雌雄不限,3月龄,体质量(3.0±0.3)kg,均由新疆维吾尔自治区实验动物研究中心提供,许可证:SCXK(新2011-0001)。饲养条件:温度24~27 ℃,相对湿度:55%~60%。动物实验伦理审批号:IAU90010。
1.1.2 主要仪器 超净工作台(北京东联哈尔仪器制造)、CO2培养箱(力新HF240)、水浴箱(上海精密设备)、UV2550紫外可见分光光度计(日本岛津)、1721型电子天平(Sartorius)、酶标仪(Thermo)、流式细胞仪(Beckman),倒置显微镜、共聚焦荧光显微镜(Leica)、电镜(日本日立)、兽医用X线摄影(天地智慧ELITE 2000 Plus型)。
1.1.3 主要试剂 低糖DMEM 培养基(Gibco公司)、胎牛血清(FBS)、Ⅰ型胶原酶(Worthington)、磷酸盐缓冲液 PBS(HyClone)、胰蛋白酶-EDTA、青一链霉素(Gibco公司)、地塞米松、抗坏血酸、维生素C、β-甘油磷酸钠、茜红素染液(Sigma公司)、ALP检测试剂盒(Sigma公司)、ALP染液(Sigma公司)、人工骨粒复合体(HA/β-TCA,由60%的羟基磷灰石和40%的β-磷酸三钙组成)。
1.2 rADSCs/HA/β-TCA复合体的构建 取新西兰大白兔2只,3%戊巴比妥钠耳缘静脉麻醉后,无菌条件下取双侧腹股沟区脂肪,分离大体可见的筋膜、血管,用眼科剪剪碎,放入装含有20 mLPBS的试管离心、消毒、消化,终止消化后加入低糖DMEM完全生长液,间隔2 d换液1次,约85%~90%融合时,进行细胞传代。 取第3代细胞,加入成骨诱导培养液进行成骨诱导培养,每3 d更换1次培养液,4周后进行茜素红染色。
取经分化诱导鉴定好的兔脂肪干细胞400 μL(融合率90%),配制成细胞浓度为3×106/mL的悬液,取12孔板培养皿,每孔放大小约5 mm×5 mm×3 mm大小的HA/β-TCA复合体。吸取1 mL细胞悬液加在各孔内HA/β-TCA支架表面,使得细胞悬液能完全接触到HA/β-TCA支架的各面。至复合体支架材料各面完全浸泡,然后置于湿化培养箱内孵育,每2 d换液,7 d后用扫描电镜观察rADSCs 在支架材料表面和空隙内的黏附及生长情况。电镜下见材料表面呈多孔状,rADSC黏附于材料上和空隙中,并向四周延伸,邻居细胞紧密连接,细胞在复合体上生长良好,增殖明显方为rADSCs/HA/β-TCA复合体构建成功。
1.3 椎体缺损兔模型的建立、分组及rADSCs/HA/β-TCA复合体植入 其余36只兔用3%戊巴比妥钠(1~2 mg/Kg)耳缘静脉注射麻醉,常规备皮消毒铺巾,沿腰3横突向下至髂嵴做一长约5 cm纵行切口,逐层分开皮下、肌层,充分显露L4/5椎体及左侧椎旁,在L4/5椎体前缘制备一大小约5 mm×5 mm×3 mm骨缺损。将36只兔随机分为A、B、C组,各12只。A组植入rADSCs/HA/β-TCA复合体,B组植入单纯HA/β-TCA支架材料,C组不植入任何材料。术毕逐层严密缝合切口,术区切口涂抹红霉素,术后连续3 d局部肌肉注射青霉素(80万U,1次/d),分笼常规条件饲养。
1.4 修复效果观察 ①X线:术后4、8、12周行脊柱正侧位X线检查,参照Lane-sandhu X线评分法对骨缺损修复情况进行评分[11]。②大体观察:术后观察兔饮食、活动及伤口愈合情况。术后12周处死兔,取缺损区骨组织观察骨缺损修复、骨痂形成情况。③组织病理学检查:取出的缺损区骨标本用4%甲醛固定,常规脱钙,标本流水冲洗过夜,脱水,透明石蜡包埋,切片(厚度5 μm),行HE染色,显微镜下观察骨组织结构。
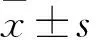
2 结果
2.1 三组兔骨缺损区X线检查结果 术后4周A组骨缺损区少量骨痂形成,复合体与周围骨组织紧密接触。B组缺损区材料与周围骨组织界线清晰,材料无明显变化。C组骨缺损区界线清晰,片状低密度影,未见骨痂形成。术后8周A组骨缺损区较前缩小,骨缺损区可见片状密度增高影,材料吸收,边界模糊。B组骨缺损区可见絮状高密度影,材料与周围骨组织尚清,少量骨痂形成。C组骨缺损区明显,可见点状钙化影。术后12周:A组骨缺损区复合体材料基本吸收,材料与骨有骨性连接,两椎体间基本融合。B组骨缺损区大部分修复,部分骨痂形成,边界模糊。C组骨缺损区边界尚清,缺损周边可见片状钙化影。术后4、8、12周三组兔骨缺损区Lane-Sandhu X线评分见表1。A、B组兔术后骨缺损区Lane-Sandhu X线评分逐渐上升(P均<0.05);相同时间点A组兔骨缺损区Lane-Sandhu X线评分高于B、C组(P均<0.05),B组兔骨缺损区Lane-Sandhu X线评分高于C组(P<0.05)。
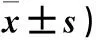
表1 术后4、8、12周三组兔骨缺损区Lane-Sandhu X线评分比较(分,
注:与C组相比,*P<0.05;与B组相比,#P<0.05。
2.2 三组兔骨缺损区大体观察结果 术后所有兔伤口愈合良好,3~4 d后活动、进食基本正常。术后12周处死各组兔取缺损区骨大体观察,A组可见骨缺损区被骨组织取代,表面未见明显复合体材料,愈合较好;B组骨缺损区基本修复,边界不清,有新骨形成,但硬度不高,可见少许纤维组织填充;C组骨缺损区见大量纤维组织,未见成骨形成。
2.3 三组兔骨缺损区组织病理学检查结果 术后12周后处死各组兔取缺损区骨行组织病理学检查,A组可见材料吸收明显,大量纤维骨痂组织生成骨组织,可见少量成纤维细胞及成骨细胞;B组可见部分材料残留,有纤维性骨痂及少许类骨样组织形成;C组可见大量纤维结缔组织和少许骨痂形成。
3 讨论
骨关节结核发病部位广泛,临床治愈率不甚理想,且致残率高,给患者以及患者家属带来了极大的社会负担。尽管随着外科技术的发展,骨关节结核治疗技术有了较大进步,但治疗效果仍不理想。结核性骨缺损修复效果决定着骨关节结核手术成功与否。自体骨及同种异体骨移植由于骨组织来源有限,且易出现术区取骨区感染、免疫排斥、愈合缓慢等[12],在临床应用非常局限。
骨组织工程的快速发展,为骨关节结核的治疗提供了新的思路。利用组织工程学的原理和方法对缺损骨组织进行修复和重建,形成组织工程骨,是一种理想的骨缺损修复材料。它不仅具有自体骨的优点,还可以避免二次创伤等缺点。骨组织工程的3个基本要素为种子细胞、支架材料、细胞生长和分化因子。种子细胞是骨组织工程研究中十分重要的环节,理想的种子细胞应取材方便,来源广泛,对机体损伤较小,具备定向分化为成骨的能力。骨髓间充质干细胞是早期研究的种子细胞之一,它具有稳定的成骨潜能,且骨髓间充质干细胞易分离培养,经连续传代后仍可保持较强的增殖能力,但因其获取创伤较大,实际获取的骨髓间充质干细胞数量较少,临床上很难大批量应用[13,14]。脂肪干细胞是存在于脂肪组织中的一种特殊的干细胞,其在一定条件下可以诱导成为骨细胞[15,16]。Tang等[17]将兔自体脂肪干细胞接种于纳米羟基磷灰石复合支架上,将其植入兔脊柱,发现复合体与兔脊柱的融合率及新骨生成量明显高于单纯植入支架。本课题组前期实验所分离、培养的rADSCs通过体外诱导证明了其有多项分化的潜能。本研究将分化诱导后的rADSCs与HA/β-TCA复合材料植入兔椎体缺损区域,结果表明诱导后的rADSCs能够向骨细胞分化,分化后的成骨细胞可以在支架材料上实现良好的黏附、增殖及迁移。
理想的骨组织工程支架材料不仅需要具备适合细胞生长的环境及细胞亲和性,而且需要维持较好的生物力学结构、机械强度、可降解性及生物相容性等。临床证实,一般在腰椎界面融合需要3~4个月,因此用于腰椎的负重支架材料降解速度不宜过快,单一材料往往不能满足上述要求。为了弥补单一材料的缺陷,常常将几种材料进行复合。羟基磷灰石化学成分、晶体结构及物理性能与人体骨骼中磷灰石相似,且钙磷比与天然骨接近,羟基磷灰石分子中的钙离子可与含有羟基的蛋白质、有机磷、氨基酸等发生反应,具有良好的生物活性及传导性。与骨组织结合后促进骨的生长,而且其形态比较稳定,抑制部分肿瘤细胞生长的同时对正常细胞没有毒性作用,是公认的性能良好的骨修复替代材料[18]。β-磷酸三钙主要是由钙、磷组成,其成分与骨基质的无机成分相似,而且β-TCA最终逐渐溶解消失,形成新骨,是理想的人体骨组织修复和替代材料之一。HA/β-TCA构成的复合材料是目前广泛应用于临床的人工复合材料,不仅具有较好的生物相容性、可降解性及骨传导性,可以诱导骨细胞生长,促进骨组织的生成,而且具有良好的孔隙率,有利于种子细胞与材料复合,是骨组织工程中比较理想的支架材料[19~22]。本研究将分化诱导后的rADSCs与HA/β-TCA复合材料体外培养,发现rADSCs较均匀的黏附在复合体上,并填充于支架材料微孔中,细胞在复合体上生长良好,增殖明显。本研究将分化诱导后的rADSCs与HA/β-TCA复合体植入兔椎体缺损中,结果表明经rADSCs诱导的复合材料更有利于骨缺损的修复。 综上,rADSCs与HA/β-TCA复合体修复兔椎体缺损效果满意。本研究的局限性在于观察时间不长、未研究rADSCs与HA/β-TCA的比例。
[1] Phillips PP, Fletcher HA, Abubakar I, et al. World TB Day 2016: an interview with leading experts in tuberculosis research[J]. BMC Med, 2016,14(1):1-4.
[2] Rasouli MR, Mirkoohi M, Vaccaro AR, et al. Spinal tuberculosis: diagnosis and management[J]. Asian Spine J, 2012,6(4):294-308.
[3] 曹雪飞,甄平.载药磷酸钙骨水泥治疗结核性骨缺损[J].实用骨科杂,2014,20(11):1009-1011.
[4] Yuan J, Zhen P, Zhao H, et al. The preliminary performance study of the 3D printing of a tricalcium phosphate scaffold for the loading of sustained release anti-tuberculosis drugs[J]. J Mater Sci, 2015,50(5):2138-2147.
[5] canti JP,Langer R.Tissue engineering[J].Science, 1993,260(14):920.
[6] 胡金龙.组织工程学技术治疗骨缺损的最新研究进展[J].中国矫形外科杂志,2013,21(2):150-153.
[7] Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies [J]. Tissue Eng, 2001,7(2):211-228.
[8] Zuk PA, Zhu M, Ashjian P, et al. Human adipose tissue is a source of multipotent stem cells [J]. Mol Biol Cell, 2002,13(12):4279-4295.
[9] 吴子征,李受珉,王泽,等.同种异体脂肪源性间充质干细胞复合β-磷酸三钙支架修复兔桡骨大段骨缺损[J].复旦大学学报医学版,2015,42(3):338-343.
[10] 李东亚,郑欣,邱旭升,等.新西兰兔桡骨骨缺损动物模型的制作[J].中华实验外科杂志,2013,30(9):2012-2013.
[11] Lane JM,Sandhu HS.Current approaches to experimental bone grafting[J]. Clin Orthop Rrlat Res, 1987,18(2):213-218.
[12] 张屹,陈建常,史振满.异种骨支架及其衍生材料治疗骨缺损的研究现状与进展[J].中国矫形外科杂志志,2014,22(14):1277-1279.
[13] Riggenbach MD, Jones GL, Bishop JY. Open reduction and internal fixation of clavicular nonunions with allograft bone substitute[J]. Int J Shoulder Surg, 2011,5(3):61-67.
[14] Mitchell JB, Mcintosh K, Zvonic S, et al. Immunophenotype of human adipose derived cells:temporal changes in stromal associated and stem cell-associated markers [J]. Stem Cells, 2006,24(2):376-385.
[15] Lange C, Bruns H, Kluth D, et a1. Hepatocytic differentiation of mesenchymal stem cells in coctdtures with fetal liver ceU4J1.World J Gastroenterol, 2006,12(15):2394-2397.
[16] 梁求真,折胜利,宋兴华,等.体外构建抗结核骨组织工程复合体的实验研究[J].中国矫形外科杂志,2014,22(19):1789-1796.
[17] Tang ZB,Cao JK,Wen N,et al.Posterolateral spinal fusion with nano-hydrox yapatite-collagen/PLA composite and autologous adipose derived mesenchymal stem cells in a rabbit model[J]. J Tissue Eng Regen Med, 2012,6(4):325-336.
[18] 折胜利,罗兰,宋兴华,等.PLA/PLGA共聚物在组织工程中的应用[J].组织工程与重建外科杂志,2011,7(4):235-237.
[19] Teixeira S, Fernandes H,Leusink A, et al. In vivo evaluation of highlymacroporous ceramic scaffolds for bone tissue engineering[J]. J Biomed Mater Red A, 2010,93(2):567-575.
[20] Khan SN, Tomin E, Lane JM. Clinical applications of bone graft substitute[J]. Orthop Clin North Am, 2000,31(3):389-398.
[21] 李海建,龙志成,宋兴华,等.HA/β-TCA复合材料与同种异体骨体外兔脂肪干细胞生物相容性的对比实验[J].新疆医科大学学报,2015,38(8):758-761.
[22] 刘正文,呼西旦,付明花,等.兔脊柱结核模型的构建[J].中华实验外科杂志,2012,29(4):758-761.
