长期氯化锰腹腔注射母鼠的子代雄鼠生精细胞凋亡变化及其机制探讨
2018-03-15王乾兴于明明李姣路健汤贤春张先平
王乾兴,于明明,李姣,路健,汤贤春,张先平
(1遵义医学院细胞生物学教研室,贵州遵义,563003;2 娄底市中心医院)
由于环境污染、不良生活习惯等的影响,男性精子数、精子活动率、正常精子率等均显著下降,已引起了学界的广泛关注[1,2]。环境锰暴露是雄性生殖障碍的一个重要原因素。锰可通过血睾屏障而蓄积于睾丸,引起男性精液质量下降和鸡、大鼠生精细胞凋亡等[3~5]。但上述关于动物实验的研究大多为急性或亚急性锰染毒对亲代雄性的影响,而慢性染毒对子代的生殖毒理效应尚未见报道。锰的毒性机制之一是上调体内活性氧簇(ROS)水平,产生氧化应激,导致内质网功能紊乱,产生内质网应激(ERS),过度ERS会导致细胞凋亡[6~8]。ERS是否与锰的雄性生殖毒性有关还不清楚。以往关于锰的毒性机制研究所采用的染毒剂量大都在7.5 mg/kg体质量以上,远远大于环境或特定场所的锰暴露水平。本研究中在母代大鼠腹腔长期注射氯化锰,观察子代雄性大鼠睾丸组织中生精细胞凋亡情况,明确母代长期氯化锰腹腔注射对子代雄性大鼠生精细胞凋亡的影响,并进一步观察了子代雄鼠睾丸组织ROS水平及ERS介导的凋亡相关蛋白表达情况,探讨ERS介导的凋亡途径在锰引起的生殖毒性中的作用。现报告如下。
1 材料与方法
1.1 材料 满月SPF级雌性SD大鼠32只,体质量90~120 g,购于第三军医大医学实验动物中心,许可证号:SCXK(渝)2012-0005。每天采光12 h,饲养环境温度20~22 ℃,自由进食饮水。
MnCl2·4H2O(分析纯 )购于中国医药集团上海化学试剂公司;原位细胞凋亡检测试剂盒购于美国Roche公司;葡萄糖调节蛋白78(GRP78)、C/EBP同源蛋白(CHOP)、含半胱胺酸的天冬氨酸蛋白水解酶3(Caspase 3)、含半胱胺酶的天冬氨酸蛋白水解酶12(Caspase 2)兔多抗购于英国Abcam公司;GAPDH鼠单抗购于美国Proteintech公司;ROS检测试剂盒(化学荧光法)购自南京建成生物工程研究所。
1.2 实验动物分组、染毒及取材 将大鼠随机分为观察1、2、3组和对照组,各8只。大鼠适应性饲养1周后,分别腹腔注射2、4、8 mg/kg的MnCl2和等容生理盐水,1次/d,连续注射5 d后休息2 d,共8周。然后与性成熟雄性SD大鼠按1∶3合笼交配,见阴栓者视为妊娠,雌雄分笼饲养。雌鼠在妊娠期和哺乳期继续染毒,总染毒时间共14周。从各组雌鼠的12周龄雄性子鼠中随机选取8只断头处死,立即分离双侧睾丸。
1.3 生精细胞凋亡指数(AI)测算 子鼠睾丸冠状面石蜡切片(4 μm)常规脱蜡、水化。微波修复抗原。0.3% H2O2-甲醇溶液封闭10 min,PBS冲洗。滴加50 μL TUNEL反应液,37℃湿盒避光温育1 h。PBS冲洗3次×5 min。加转化剂37 ℃反应30 min,PBS冲洗,DAB显色、苏木素复染、脱水、透明、封片、镜检。同时设阴性对照(只加标记反应液)和阳性对照(10 μg /mL的DNAase I预处理) 。每张切片随机选择10个生精小管,计算凋亡信号阳性的生精细胞数占总生精细胞数的比例,即为生精细胞AI。
1.4 睾丸组织ROS水平检测 准确称取少量睾丸组织, 剪碎,加入生理盐水,超声粉碎制备10%组织匀浆,3 000 r/min离心10 min,取上清液用化学荧光法检测ROS水平,按试剂盒说明书操作,结果以荧光强度表示。
1.5 睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白表达检测 取子代雄鼠睾丸组织100 mg加入500 μL RIPA 裂解液,同时加入5 μL蛋白酶抑制剂,4 ℃电动匀浆。 4 ℃环境下12 000g离心15 min,小心吸取上清,BCA法测定蛋白浓度。取40 μg蛋白变性后上样,10%分离胶120 V恒压电泳,100 mA恒流转印,5% 脱脂奶粉封闭1h,一抗4 ℃过夜,二抗37 ℃孵育1 h,ECL发光、显影、定影。将胶片扫描,用Image Pro Plus 软件计算各条带灰度值。以GAPDH为内参照,各目的蛋白相对表达量以目的蛋白条带灰度值与GAPDH条带灰度值之比表示。
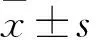
2 结果
2.1 各组雄性子鼠睾丸组织生精细胞AI比较 观察1、2、3组和对照组AI分别为9.05%±1.02%、15.87%±1.31%、19.59%±1.12%、5.72%±0.53%,各组生精细胞AI相比,P均<0.05。
2.2 各组雄性子鼠睾丸组织ROS水平比较 观察1、2、3组和对照组雄性子鼠睾丸组织ROS水平(以荧光强度表示)分别为335.67±41.12、452.75±37.55、547.25±41.11、210.32±37.58,各组睾丸组织ROS水平相比,P均<0.05。
2.3 各组雄性子鼠睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白比较 各组雄性子鼠睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白相对表达量见表1。观察1、2、3组雄性子鼠睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白相对表达量均高于对照组(P均<0.05),观察2、3组雄性子鼠睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白相对表达量均高于低剂量组(P均<0.05),观察3组雄性子鼠睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白相对表达量均高于观察2组(P均<0.05)。
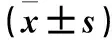
表1 各组雄性子鼠睾丸组织GRP78、CHOP、Caspase12、Caspase3蛋白相对表达量比较
注:与对照组比较,*P<0.05;与观察1组比较,#P<0.05;与观察2组比较,△P<0.05。
3 讨论
关于锰对子代生殖生殖毒性的影响尚未见报道。而且以往关于锰的毒性机制研究所采用的染毒剂量大都在7.5 mg/kg体质量以上,远远大于环境或特定场所的锰暴露水平,对锰毒性的职业防护的指导意义有限[9~11]。本研究用较低剂量氯化锰染毒,结果显示,随着锰染毒剂量的增加,雄性子鼠睾丸组织生精细胞AI增高,表明长期低剂量锰染毒可导致生精能力减弱[12]。
锰的毒性机制之一是提高机体的ROS水平。ROS是需氧细胞进行正常生化反应的产物,主要包括O2-、H2O2及HO2·、·OH等,可参与细胞内多种信号转导过程。ROS分子具有孤对电子,因而具有高氧化性。当机体内ROS过量产生时,可启动脂质过氧化反应而损伤膜功能及其完整性,从而造成氧化应激损伤,启动细胞凋亡程序[6,13,14]。本研究结果显示,长期低剂量锰染毒后,子代大鼠睾丸组织内ROS水平随锰剂量升高而逐渐升高。提示锰的蓄积可能作用于线粒体,增加子代大鼠睾丸组织ROS水平,提高其氧化应激状态。
内质网是细胞内调控蛋白质折叠、维持Ca2+稳态的最重要的一个细胞器。作为一个膜性细胞器,内质网对应激刺激极为敏感。当细胞内发生氧化应激时,ROS可直接攻击与蛋白质折叠有关酶的活性中心巯基而使其失活,诱导内质网中未折叠蛋白的积累,产生未折叠蛋白反应(UPR)。URP是ERS早期反应,其作用是减少蛋白质生物合成,同时加强蛋白质降解,降低内质网负荷,从而维持细胞的生存。当ERS进一步加剧时则抑制UPR,转而诱导促凋亡蛋白表达,促进细胞凋亡[15]。GRP78是定位在内质网的ERS标志性分子伴侣,其表达量的高低反映ERS反应强度;C/EBP同源蛋白(CHOP)是ERS特异性的转录因子,ERS诱导的凋亡信号转导途径最终都传导到CHOP,CHOP的表达可诱导内质网特异的凋亡蛋白Caspase12的表达,从而激活凋亡的最终执行者Caspase3表达,从而引起细胞凋亡[16,17]。本研究结果显示,与对照组相比,各锰染毒组GRP78、CHOP、Caspase12和Caspase3表达均升高,且随锰染毒剂量的增加而增加。提示氯化锰染毒可导致子代大鼠睾丸组织细胞发生ERS。随着锰染毒剂量的增加,ERS逐渐加重,启动了睾丸组织细胞内质网Caspase12信号通路,最终激活Caspase3而引起细胞凋亡[18,19]。
[1] Huang C, Li B, Xu K, et al. Decline in semen quality among 30,636 young Chinese men from 2001 to 2015 [J]. Fertil Steril, 2017,107(1):83-88.
[2] Jr BE, Setti AS, Braga DP, et al. Decline in semen quality among infertile men in Brazil during the past 10 years [J]. Int Braz J Urol, 2015,41(4):757-763.
[3] Wang YX, Yang S, Zhen H, et al. Associations of urinary metal levels with serum hormones, spermatozoa apoptosis and sperm DNA damage in a Chinese population [J]. Environ Int, 2016,94:177-188.
[4] Liu XF, Zhang LM, Guan HN, et al. Effects of oxidative stress on apoptosis in manganese-induced testicular toxicity in cocks[J].Food Chem Toxicol, 2013,60:168-176.
[5] 王乾兴,金华,张先平.谷胱甘肽拮抗锰致雄性大鼠生殖损伤的研究[J].中国计划生育学杂志,2011,19(9):537-539.
[6] Cordova FM, Aguiar AS Jr, Peres TV, et al. Manganese-exposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox [J]. Arch Toxicol, 2013,87(7):1231-1244.
[7] Maddirala Y, Tobwala S, Ercal N. N-acetylcysteineamide protects against manganese-induced toxicity in SHSY5Y cell line[J]. Brain Res, 2015,1608:157-166.
[8] Senft D, Ronai ZA. UPR, autophagy, and mitochondria crosstalk underlies the ER stress response [J]. Trends Biochem Sci, 2015,40(3):141-148.
[9] Saputra D, Chang J, Lee BJ, et al. Short-term manganese inhalation decreases brain dopamine transporter levels without disrupting motor skills in rats[J]. J Toxicol Sci, 2016,41(3):391-402.
[10] Aberration in epigenetic gene Wang L, Shiraki A, Itahashi M,et al. regulation in hippocampal neurogenesis by developmental exposure tomanganese chloride in mice[J]. Toxicol Sci. 2013,136(1):154-65.
[11] Santos D, Batoréu MC, Tavares de Almeida I, et al. Evaluation of neurobehavioral and neuroinflammatory end-points in the post-exposure period in rats sub-acutely exposed to manganese [J]. Toxicology, 2013,314(1):95-99.
[12] Austinc C, Niedzwiecki MM, Arora M, et al. Multielemental bioimaging of tissues in children's environmental health research[J]. Curr Opin Pediatr, 2016,28(2):216-220.
[13] Martinez-Finley EJ, Gavin CE, Aschner M, et al. Manganese neurotoxicity and the role of reactive oxygen species[J]. Free Radic Biol Med, 2013,62(9):65-75.
[14]Smith MR, Fernandes J, Go YM, et al. Redox dynamics of manganese as a mitochondrial life-death switch [J]. Biochem Biophys Res Commun, 2017,482(3):388-398.
[15]Farooqi AA, Li KT, Fayyaz S, et al. Anticancer drugs for the modulation of endoplasmic reticulum stress and oxidative stress[J]. Tumour Biol, 2015, 36(8):5743-5752.
[16] Lewy TG, Grabowski JM, Bloom ME. BiP: Master regulator of the unfolded protein response and crucial factor in flavivirus biology [J]. Yale J Biol Med, 2017,90(2):291-300.
[17] Lee WS, Sung MS, Lee EG, et al. A pathogenic role for ER stress-induced autophagy and ER chaperone GRP78/BiP in T lymphocyte systemic lupus erythematosus [J].J Leukoc Biol, 2015,97(2):425-433.
[18] Wang T, Li X, Yang D, Zhang H, et al. ER stress and ER stress-mediated apoptosis are involved in manganese-induced neurotoxicity in the rat striatum in vivo [J]. Neurotoxicology, 2015,48:109-119.
[19] Seo YA, Li Y, Wessling-Resnick M. Iron depletion increases manganese uptake and potentiates apoptosis through ER stress [J]. Neurotoxicology, 2013,38(4):67-73.
