不同剂量珍龙醒脑灌胃对血管性痴呆大鼠学习记忆能力、空间探索能力的影响及其机制
2018-03-15项颖卿刘燕玲章国良
项颖卿,刘燕玲,章国良
(1江西科技学院,南昌 330098;2南昌市第二医院)
血管性痴呆(VaD)是一种大脑血流减少引起的进行性智力障碍疾病,是常见的老年性痴呆之一,严重影响患者认知能力,尤其是执行功能,是继阿尔茨海默病后的第二大痴呆性疾病[1]。研究[2~5]显示,某些药物如乙酰胆碱酯酶抑制剂、N-甲基D-天冬氨酸受体抑制剂、磷酸二酯酶抑制药等在VaD治疗中起到一定的效果,但治疗作用有限,且疗效不确定[7]。中药防治VaD的研究日益受到中医药研究者的重视,单味中药或其有效成分防治VaD具有选择性高、针对性强等特点[8]。珍龙醒脑主要含有珍珠、紫檀香、西红花、诃子、塞北紫堇、冬葵果等几十味名贵中药成分,是治疗缺血性脑血管疾病的经典验方。珍龙醒脑能减少缺血脑组织梗死面积,抑制大脑皮质和海马神经元凋亡,对脑神经细胞具有保护作用[9];珍龙醒脑在促进脑梗死患者的语言和肢体功能恢复,减轻脑梗死患者的后遗症方面疗效显著[10];但珍龙醒脑治疗VaD的研究鲜有报道。目前认为,VaD的发病机制可能与胆碱能环路传导损伤、突触可塑性病变、氧化应激、兴奋性氨基酸、细胞凋亡等有关[11]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路是一条经典的抗凋亡、促存活的信号转导通路,广泛存在各种细胞中。本研究观察了不同剂量珍龙醒脑灌胃对血管性痴呆(VaD)大鼠学习记忆能力、空间探索能力的影响,并探讨其可能机制。
1 材料与方法
1.1 实验动物 健康成年SD大鼠80只,3~4个月,体质量(250±30)g,雌雄各半,由江西中医药大学动物科学部提供。实验前将大鼠放置在Morris水池中行水迷宫定位航行测试(具体方法见行为学测试),观察记录大鼠的搜索持续时间(逃避潜伏期),每日训练1次,连续5 d。计算出大鼠逃避潜伏期的平均成绩,以平均成绩为参照,剔除不会游泳、体质弱及成绩明显低于平均值的大鼠。通过测评筛选出符合实验要求的大鼠50只,普通饲料适应性喂养1周,饲养温度25~26 ℃,每日光照12 h。
1.2 主要药物与试剂 珍龙醒脑胶囊购自青海金诃藏药药业股份有限公司,使用前用0.5%羧甲基纤维素钠溶液制备混悬溶液配置成10 mg/mL的混悬液。PI3K、Akt兔抗鼠多克隆抗体购自北京中杉金桥生物技术有限公司。
1.3 实验动物分组、VaD模型制备及珍龙醒脑给予方法 SD大鼠称重编号,按照随机数字表法分为A、B、C、D、E组各10只。前4组采用双侧颈总动脉结扎法制作Vad模型,即大鼠以10%水合氯醛(350 mg/kg)腹腔注射麻醉,麻醉成功后,颈部用碘伏消毒,正中矢状切口切开皮肤、皮下组织和筋膜,在双侧颈动脉三角处钝性分离迷走神经,游离出颈总动脉,取4号丝线结扎阻断双侧颈总动脉血流,缝合切口;E组除不结扎阻断颈总动脉外,其余手术步骤均与前4组相同。术后各组均注射青霉素20万U预防感染。大鼠苏醒后,A、B、C组分别以50、100、200 mg/kg珍龙醒脑灌胃,D、E组给予等量生理盐水,1次/d,连续4周。
1.4 大鼠学习记忆能力、空间探索能力评价 给药4周后,各组随机取6只大鼠进行Morris水迷宫实验。水迷宫主要由一个圆形水池和一个可移动位置的平台组成。水池直径120 cm,高60 cm,平台直径12 cm。将清水注入到水池中至水深30 cm,平台置于水面以下1 cm处。加入墨汁使池水变为不透明色。Morris水迷宫实验分为两部分:①定位航行实验:按顺时针方向依次由第一、二、三、四象限入水点顺序,将受试大鼠头面向池壁放入水中。记录120 s内寻找平台的时间(逃避潜伏期)。如果实验大鼠在120 s内未找到平台,则将其引上平台并停留15 s,逃避潜伏期记录为120 s。以大鼠4次逃避潜伏期的平均值作为其当日的测评成绩。连续测试5 d。②空间探索实验:第6天撤除原平台,将各组大鼠取同一入水点(第二象限)放入水中,观察并记录大鼠60 s内在原平台所在象限的停留时间百分比(停留时间百分比=停留时间/总游泳时间×100%),计算跳台穿越次数(60 s内通过原平台位置次数和)。
1.5 大鼠脑组织PI3K、Akt蛋白检测 给药4周后,各组另取4只大鼠以10%水合氯醛腹腔注射麻醉,后快速断头,取脑组织,石蜡切片,脱蜡至水。依据试剂盒说明书进行操作,采用免疫组化法SP检测脑组织PI3K、Akt蛋白。400倍镜下观察胞质呈棕褐色的细胞为阳性细胞。每张切片随机选取5个不重叠的视野,数码相机进行显微摄影。采用IPP图像分析软件进行图像采集,计数阴性细胞个数。
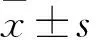
2 结果
2.1 各组大鼠实验第1~5天逃避潜伏期比较 结果见表1。
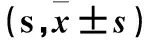
表1 各组大鼠实验第1~5天逃避潜伏期比较
注:与D组比较,*P<0.05;与A组比较,△P<0.05。
2.2 各组大鼠实验第6天停留时间百分比、跳台穿越次数比较 结果见表2。
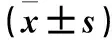
表2 各组大鼠实验第6天停留时间百分比、跳台穿越次数比较
注:与D组比较,*P<0.05;与A组比较,△P<0.05。
2.3 各组大鼠脑组织PI3-K、Akt蛋白阳性细胞数比较 结果见表3。
3 讨论
VaD主要表现为记忆力、定向力、计算力等认知功能的改变和情感行为异常,严重影响患者日常生活活动能力、生活质量及社会适应能力[8,12]。研究[13]表明,VaD是目前惟一可防治的痴呆性疾病,早期干预有望使病情逆转。西医治疗VaD的药物主要有乙酰胆碱酯酶抑制剂(多奈哌齐、利凡斯的明、加兰他敏)、N-甲基D-天冬氨酸受体抑制剂(美金刚)、磷酸二酯酶抑制剂(西洛他唑)、钙拮抗剂(尼莫地平)等药物的单用或联用,但临床治疗效果有限,且疗效不确定。中医认为,VaD多因年老体衰、肾精亏虚、痰浊阻窍、元神失聪所致,治疗多从痰、瘀、虚论治,或化痰祛瘀、醒脑开窍,或补肾益精、活血通络,或益气养阴,生精填髓等,治疗疗效多满意[14]。
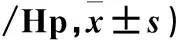
表3 各组大鼠脑组织PI3-K、Akt蛋白阳性细胞数比较(个
注:与D组比较,*P<0.05;与A组比较,△P<0.05。
珍龙醒脑为传统藏药,始载于《四部医典》,主要由珍珠、西红花、冬葵果、紫檀香、余甘子、诃子、人工牛黄、木香、塞北紫堇、麝香、短穗兔耳草等中药组成,具有养阴益气、开窍醒神,泻热通络、化痰、活血化瘀等功效[15]。多杰等[16]发现,珍龙醒脑在降低血液黏稠度、促使缺血脑组织侧支循环畅通、改善脑部供血等方面疗效显著,有益于中风后遗症患者的恢复。双侧颈总动脉永久结扎(2VO)模型已成为经典的研究VaD及评价药物的重要动物模型[17]。本研究采用Morris水迷宫实验评价动物模型的认知功能,结果显示,与D组比较,A、B、C、E组实验第2~5天逃避潜伏期短;与A组比较,C组实验第2~5天逃避潜伏期短。与D组比较,A、B、C、E组实验第6天停留时间百分比高,B、C、E组跳台穿越次数多;与A组比较,C组实验第6天留时间百分比高,B、C、E组跳台穿越次数多。证实珍龙醒脑对VaD有神经保护作用,且高剂量效果更佳。
PI3K/Akt信号通路广泛存在各种细胞中,是膜受体信号向细胞内转导的重要途径,具有调节细胞增殖、分化、代谢及抗细胞凋亡等作用[18]。正常情况下,细胞内的PI3K含量较少,各种信号转导刺激物和生长因子均可使PI3K活化,活化后的PI3K使肌醇环上3位的羟基磷酸化,进而3,4-二磷酸磷脂酰肌醇转化为3,4,5-三磷酸磷脂酰肌醇(PIP3)。PIP3作为第二信使再激活其下游蛋白发挥生物效应。Akt又名蛋白激酶B,在静息状态细胞中主要存在于细胞质,是一种丝氨酸/苏氨酸激酶,属于PI3K下游的直接靶蛋白。PI3K的激活将致Akt磷酸化,活化的Akt蛋白启动通路下游的级联反应,进一步磷酸化和纯化其下游底物,通过多种途径发挥其促进细胞存活、抗细胞凋亡的作用。本课题的前期研究表明,珍龙醒脑胶囊能通过上调Bcl-2、抑制Caspase-3蛋白表达发挥抗神经细胞凋亡作用[9],但对其上游信号通路未做探讨。本研究显示,与D组比较,B组和C组PI3K、Akt蛋白阳性细胞数增加,E组PI3K、Akt蛋白阳性细胞数减少;与A组比较,B组和C组PI3K、Akt蛋白阳性细胞数增加。表明珍龙醒脑胶囊可以通过增强PI3K/Akt信号通路的活化效应,从而发挥神经保护作用,此结果可为珍龙醒脑在防治VaD方面提供客观的实验理论依据。但由于本实验未涉及到PI3K/Akt信号通路抑制剂及其下游靶基因mTOR相关的神经元自噬作用的研究,具有一定局限性,有待在今后的实验研究中得到进一步完善。
[1] 朱金墙,宋宛珊,马妍,等.PI3K/Akt信号通路与血管性痴呆的关系及中药干预作用研究进展[J].中国实验方剂学杂志,2016,22(9):223-229.
[2] Narasimhalu K, Effendy S, Sim C, et al. A randomized controlled trial of rivastigmine in patients with cognitive impairment no dementia because of cerebrovascular disease[J]. Acta Neurol Scand, 2010,121(4):217-224.
[3] Chen YD, Zhang J, Wang Y. Efficacy of Cholinesterase Inhibitors in Vascular Dementia:An Updated Meta -Analysis[J]. Eur Neurol, 2016,75(3-4):132-141.
[4] Ritter A, Pillai JA. Treatment of vascular cognitive impairment[J]. Curr Treat Options Neurol, 2015,17(8):367.
[5] Kumar A, Kumar A, Jaggi AS, et al. Efficacy of cilostazol a selective phosphodiesterase-3 inhibitor in rat model of streptozotocin diabetes induced vascular dementia[J]. Pharmacol Biochem Behav, 2015(135):20-30.
[6] Ihara M, Nishino M, Taguchi A, et al. Cilostazol add on therapy in patients with mild dementia receiving donepezil: a retrospective study [J]. PLoS One, 2014,9(2):89516.
[7] 罗燕,付剑亮.血管性痴呆的诊断和治疗进展[J]. 国际神经病学神经外科学杂志,2017,44(5):550-554.
[8] 周伟.治疗血管性痴呆的中药研究进展[J].中西医结合研究,2016,8(1):47-50.
[9] 项颖卿,涂长春,章国良.珍龙醒脑胶囊对大鼠局灶性脑缺血再灌注损伤细胞凋亡及Bcl-2、Caspase-3 蛋白表达的影响[J].中国老年学杂志,2016,36(23):5835-5837.
[10] 孙秀华,邱进,孙美玲,等.珍龙醒脑胶囊治疗脑梗死临床观察[J].中医临床研究,2012,4(24):13-14.
[11] 廖伟龙,孙传河,高鹏琳,等.血管性痴呆的危险因素及发病机制的研究进展[J].中西医结合心脑血管病杂志,2017,15(8):941-944.
[12] 赵雪艳.Akt-GSK3β细胞信号通路在血管性痴呆大鼠认知障碍中的作用机制[J].中国老年学杂志,2015,35(17):4812-4814.
[13] Daietmar RT, Lea TG, Johannes A. Vascular dementia: different forms of vessel disorders contribute to the development of dementia in the elderly brain[J]. Exp Gerontol, 2012,47(11):816-824.
[14] 李忠泽,胡玉英.中医药治疗血管性痴呆研究进展[J].亚太传统医药,2016,12(4):58-60.
[15] 杨延林,张义智.珍龙醒脑胶囊治疗脑梗死临床观察[J].中国当代医药,2010,17(17):95-96.
[16] 多杰,付加雷.珍龙醒脑胶囊治疗中风后遗症临床观察[J].中国中医药信息杂志,2009,16(10):73.
[17] 张君,程笑,杨欢,等.山奈酚对慢性脑缺血大鼠学习记忆能力的影响及机制探讨[J].中国药理学通报,2017,33(1):39-44.
[18] 罗银利,黄晓松,谭李红,等.红景天苷对大鼠脑缺血再灌注损伤后PI3K/Akt信号通路的影响[J].中国医师杂志,2014,16(6):734-738.
