不同剂量山奈酚对胰腺癌细胞株PANC-1增殖、凋亡的影响及机制探讨
2018-03-15陈卓刘胜楠吴克俭陈光侠何晓华
陈卓,刘胜楠,吴克俭,陈光侠,何晓华
(1徐州市第一人民医院,江苏徐州221000;2徐州医科大学附属医院)
山奈酚是一种黄酮类化合物,主要来源于山奈、藏红花等药用植物,此外还广泛存在于西兰花、葡萄、绿茶等多种植物中。既往研究证实,山奈酚可以在肝癌、胃癌、乳腺癌等多种肿瘤中表现出诱导肿瘤细胞凋亡、阻滞肿瘤细胞周期、抑制肿瘤组织侵袭及转移的作用[1, 2],但至今为止,国内外尚未见山奈酚对胰腺癌细胞影响的报道。胰腺癌是一种具有高度侵袭性的恶性肿瘤,由于缺乏特异性的临床症状和早期诊断方法,往往患者在就诊时已经处于肿瘤晚期,但是由于胰腺癌细胞获得性或内在的耐药性,传统化疗药物的效果也不甚理想[3],因此继续探索有效的抗胰腺癌药物具有重要临床意义。另有研究发现Toll样受体4(TLR-4)/NF-κB信号通路参与了包括胰腺癌在内的多种肿瘤的进展[4]。本研究观察了山奈酚培养的人胰腺癌PANC-1细胞增殖、凋亡、周期分布及其TLR-4/NF-κB信号通路相关蛋白表达情况,探讨山奈酚作为胰腺癌化疗药物的可能性及其作用机制。现报告如下。
1 材料与方法
1.1 细胞株及主要试剂 人胰腺癌PANC-1细胞株购自中国科学院上海细胞资源中心。山奈酚为购自东京化成工业株式会社(纯度>97%)。DEME高糖培养基、胰蛋白酶、青霉素、链霉素购自美国Gibco公司。胎牛血清(FBS)、二甲亚砜(DMSO)、NF-κB p65抗体购自美国Sigma公司。激活型Caspase-3抗体、TLR-4抗体、VEGF抗体购自美国Santa Cruz公司。CCK-8试剂盒购自日本同仁化学研究所。细胞周期检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购自江苏凯基生物公司。
1.2 细胞培养、分组及山奈酚应用方法 将人胰腺癌PANC-1细胞用含有10% FBS、100 U/mL青霉素、100 μg/mL链霉素的DEME-高糖培养基,置于37 ℃、5% CO2、饱和湿度培养箱中培养。待PANC-1细胞贴壁生长后,取对数生长期的细胞用于实验。设对照组和观察1、2、3、4组,观察1、2、3、4组分别用20、40、80、160 μmol/L的山奈酚,对照组加等量生理盐水。
1.3 各组细胞增殖情况观察 采用CCK-8法。将对数生长期的PANC-1细胞接种于96孔板,每孔加入100 μL细胞悬液,PANC-1细胞密度3×104/mL。待细胞贴壁生长后,弃上清,每孔加入100 μL不同浓度(0、20、40、80、160 μmol/L,即对照组、观察1组、观察2组、观察3组、观察4组)的山奈酚培养24、48、72,每组设5个复孔。处理完毕后,每孔均避光更换为100 μL培养液加10 μL CCK-8溶液,继续避光培养2 h后,使用酶标仪测定在450 nm处每孔的吸光光度值(OD),根据OD值计算各组细胞增殖抑制率。细胞增殖抑制率(%)=(1-观察组OD值/对照组OD值)×100%。
1.4 各组细胞周期检测 采用流式细胞术。向6孔板中每孔加入2 mL密度为2×105/mL的PANC-1细胞悬液,待细胞贴壁生长后,更换含不同浓度(0、20、40、80、160 μmol/L,即对照组、观察1组、观察2组、观察3组、观察4组)的山奈酚溶液处理48 h,每组设3个复孔,重复3板。终止培养后,收集细胞,离心(2 000 r/min,5 min)沉淀细胞,弃上清,用PBS洗涤细胞2次后,制备密度为1×106/mL的细胞悬液,取1 mL细胞悬液离心,弃上清后,用0.5 mL PBS重悬细胞,并迅速打入3.5 mL预冷的乙醇中,吹打均匀,4℃过夜。取乙醇固定过的细胞离心,弃上清,用PBS洗涤细胞2次后,加入100 μL RNase A,37℃水浴30 min,随后加入400 μL碘化丙啶(PI)染色混匀,4℃避光保存30 min后,用流式细胞仪测算各期细胞百分比。
1.5 各组细胞凋亡率测算 用流式细胞术制备细胞密度为2×105/mL的PANC-1细胞悬液,每孔2 mL接种于6孔板中,每组设3个复孔,重复3板,待细胞贴壁生长后,更换含不同浓度(0、20、40、80、160 μmol/L,即对照组、观察1组、观察2组、观察3组、观察4组)山奈酚的培养液处理48 h。终止培养后,收集细胞,离心(2 000 r/min,5 min)沉淀细胞,弃上清,用PBS洗涤细胞2次后,用500 μL Binding Buffer悬浮细胞,随后加入5 μL Annexin V-FITC混匀,置于冰上,室温、避光保存10 min,然后加入5 μL PI混匀,置于冰上,室温、避光保存5 min,用流式细胞仪测算细胞凋亡率。
1.6 各组细胞中TLR-4、NF-κB、VEGF和Caspase-3蛋白检测 采用Western blotting法。对照组和观察1、2、3、4组分别用0、20、40、80、160 μmol/L的山奈酚处理PANC-1细胞48 h,然后用4℃预冷的PBS冲洗细胞3次,加入蛋白裂解液,摇匀后于冰上裂解30 min,结束后用细胞刮刀收集细胞,于4 ℃离心(12 000 r/min,10 min),取上清液,应用BCA法测定蛋白浓度。在经过蛋白提取及浓度检测后,每泳道上样50 μg蛋白,采用十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,转膜,封闭。结束后膜上加入TLR-4、NF-κB、VEGF、Caspase-3一抗4 ℃继续培养过夜,TBST洗膜3次,再加入二抗室温孵育2h,TBST洗膜3次,加入电化学发光法发光液,在暗室中显影X线片,图像扫描。以 β-actin 为内参照。目的蛋白相对表达量以目的蛋白条带灰度值与β-actin条带灰度值之比表示,以对照组表达量为100%,计算观察1~4组各蛋白表达量相对值。
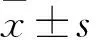
2 结果
2.1 各组细胞增殖抑制率比较 培养24、48、72 h各观察组细胞增殖抑制率见表1。作用相同时间的情况下,随着山奈酚药物浓度的递增,PANC-1细胞增殖抑制率逐渐升高(P均<0.05);在山奈酚浓度相同的情况下,随着作用时间增加,PANC-1细胞增殖抑制率逐渐升高(P均<0.05)山奈酚以时间-剂量依赖的方式对PANC-1细胞表现出显著的增殖抑制作用。

表1 培养24、48、72 h各观察组细胞增殖抑制率比较
注:与对照组相比,aP<0.05;与观察1组相比,bP<0.05;与观察2组相比,cP<0.05;与观察3组相比,dP<0.05;
2.2 各组细胞周期比较 各组细胞周期分布见表2。随着山奈酚浓度的递增,S期PANC-1细胞的比例逐渐上升(P均<0.05),G0/G1期PANC-1细胞的比例逐渐下降(P均<0.05)。山奈酚以剂量依赖的方式将PANC-1细胞增殖阻滞在S期。

表2 各组细胞周期分布比较
注:与对照组相比,aP<0.05;与观察1组相比,bP<0.05;与观察2组相比,cP<0.05;与观察3组相比,dP<0.05;
2.3 各组细胞凋亡率比较 对照组、观察1组、观察2组、观察3组、观察4组细胞凋亡率分别为6.5%±1.5%、8.5%±1.7%、17.4%±2.1%、38.3%±2.9%、73.1%±2.7%。随着山奈酚浓度的增加,PANC-1细胞凋亡率逐渐升高(P均<0.05),随着山奈酚浓度的增加,PANC-1细胞凋亡率逐渐升高(P均<0.05),山奈酚以剂量依赖的方式诱导了PANC-1细胞的凋亡。
2.4 各组细胞中TLR-4、NF-κB、VEGF和Caspase-3蛋白相对表达量比较 各观察组细胞中TLR-4、NF-κB、VEGF和Caspase-3蛋白相对表达量见表3。随着山奈酚浓度的增加,PANC-1细胞中TLR-4、NF-κB、VEGF蛋白相对表达量逐渐下降(P均<0.05),Caspase-3蛋白相对表达量逐渐上升(P均<0.05)。山奈酚以剂量依赖的方式抑制了TLR-4/NF-κB信号通路蛋白TLR-4、NF-κB的表达,并且下调了VEGF的表达,上调了Caspase-3的表达。

表3 各观察组细胞中TLR-4、NF-κB、VEGF和Caspase-3蛋白相对表达量比较
注:与对照组相比,aP<0.05;与观察1组相比,bP<0.05;与观察2组相比,cP<0.05;与观察3组相比,dP<0.05;
3 讨论
山奈酚作为在多种食材和传统中药中提取的有效作用成分,已经被证实在包括肝癌、结肠癌、乳腺癌等多种肿瘤中产生有效的抗肿瘤作用[5~7]。如Halimah等[8]报道,山奈酚可以在乳腺癌中通过释放细胞色素C等凋亡因子,最终通过激活Caspase级联反应在肿瘤细胞中产生诱导凋亡作用。也有研究显示,山奈酚可以通过调节环氧合酶-2等炎性介质,进而下调VEGF、低氧诱导因子(HIF-1)等mRNA转录,降低VEGF蛋白表达,最终抑制肿瘤侵袭[9]。本研究结果显示,山奈酚不仅可以以时间-剂量依赖的方式抑制PANC-1细胞的增殖,而且剂量依赖性诱导PANC-1细胞凋亡。此外,山奈酚还可以将PANC-1细胞阻滞于S期,其通过影响肿瘤细胞周期也是其抗肿瘤作用的机制之一。
TLR-4作为Toll样受体家族中第一个被识别的受体,和家族成员一样,在生物体先天性免疫反应和后天炎症反应之间起重要的纽带作用。越来越多的证据表明,TLR-4通过介导肿瘤细胞增殖、凋亡和侵袭等方式,深度参与了包括胰腺癌在内的多种肿瘤的发生和发展。如Yu等[10]在用黑灵芝多糖处理S-180肉瘤的体外实验中发现,TLR-4蛋白表达量的降低与Caspase-3之间存在负相关性。事实上有研究发现,TLR-4及其下游重要中转因子NF-κB在胰腺癌癌灶和癌周呈现过度表达的现象,并且实验数据显示,肿瘤组织中TLR-4表达缺失患者的生存期显著高于肿瘤中TLR-4过表达的患者的生存期[11]。本研究结果显示山奈酚以剂量依赖的方式下调TLR-4、NF-κB和VEGF蛋白表达,上调Caspase-3蛋白的表达。Caspase-3在Caspase凋亡信号转导网络中起执行者的作用[12]。VEGF通过刺激血管生成因子,促进肿瘤组织中新生血管的形成,与恶性肿瘤的侵袭和转移之间密切相关[13]。这说明山奈酚可以剂量依赖性的诱导胰腺癌细胞凋亡并抑制其侵袭,有可能是新的抗胰腺癌药物。
综上所述,山奈酚可以抑制胰腺癌细胞增殖,促进其凋亡,阻滞细胞周期于S期,其机制可能与TLR-4/NF-κB信号通路及其下游蛋白VEGF、Caspase-3有关。
[1] Kim SH, Choi KC. Anti-cancer Effect and Underlying Mechanism(s) of Kaempferol, a Phytoestrogen, on the Regulation of Apoptosis in Diverse Cancer Cell Models [J]. Toxicol Res, 2013,29(4):229-234.
[2] Jo E, Park SJ, Choi YS, et al. Kaempferol Suppresses Transforming Growth Factor-beta1-Induced Epithelial-to-Mesenchymal Transition and Migration of A549 Lung Cancer Cells by Inhibiting Akt1-Mediated Phosphorylation of Smad3 at Threonine-179 [J]. Neoplasia (NY), 2015,17(7):525-537.
[3] Yu X, Di Y, Xie C, et al. An in vitro and in vivo study of gemcitabine-loaded albumin nanoparticles in a pancreatic cancer cell line [J]. Int J Nanomedicine, 2015,10:6825-6834.
[4] Zhou L, Qi L, Jiang L, et al. Antitumor activity of gemcitabine can be potentiated in pancreatic cancer through modulation of TLR4/NF-kappaB signaling by 6-shogaol [J]. Aaps J, 2014,16(2):246-257.
[5] Guo H, Ren F, Zhang L, et al. Kaempferol induces apoptosis in HepG2 cells via activation of the endoplasmic reticulum stress pathway [J]. Mol Med Rep, 2016,13(3):2791-2800.
[6] Kim SH, Hwang KA, Choi K C. Treatment with kaempferol suppresses breast cancer cell growth caused by estrogen and triclosan in cellular and xenograft breast cancer models [J]. J Nutr Biochem, 2016(28):70-82.
[7] Tu LY, Bai HH, Cai JY, et al. The mechanism of kaempferol induced apoptosis and inhibited proliferation in human cervical cancer SiHa cell: From macro to nano [J]. Scanning, 2016,38(6):644-653.
[8] Halimah E, Diantini A, Destiani D P, et al. Induction of caspase cascade pathway by kaempferol-3--rhamnoside in LNCaP prostate cancer cell lines [J]. Biomed Rep, 2015,3(1):115-117.
[9] Chen AY, Chen YC. A review of the dietary flavonoid, kaempferol on human health and cancer chemoprevention [J]. Food Chem, 2013,138(4):2099-2107.
[10] Yu Q, Nie SP, Wang J Q, et al. Toll-like receptor 4 mediates the antitumor host response induced by Ganoderma atrum polysaccharide [J]. J Agric Food Chem, 2015,63(2):517-525.
[11] Zhang QQ, Ding Y, Lei Y, et al. Andrographolide suppress tumor growth by inhibiting TLR4/NF-kappaB signaling activation in insulinoma [J]. Int J Biol Sci, 2014,10(4):404-414.
[12] Rudrapatna VA, Bangi E, Cagan RL. Caspase signalling in the absence of apoptosis drives Jnk-dependent invasion [J]. EMBO Rep, 2013,14(2):172-177.
[13] Lv B, Zhang B, Hu XY, et al. Heparanase regulates VEGF-C expression and its clinical significance to pancreatic ductal cell adenocarcinoma [J]. Oncol Lett, 2016,11(2):1327-1334.
