高原缺氧对药物转运体影响的研究进展
2018-03-15张明霞李文斌罗冰峰刘晶晶贾正平
张明霞,王 荣,李文斌,鹿 辉,谢 华,罗冰峰,王 昌,刘晶晶,贾正平
(1. 兰州大学药学院,甘肃 兰州 730000;2. 兰州军区兰州总医院全军高原损伤防治重点实验室,甘肃 兰州 730050)
药物在体内的吸收、分布、代谢、排泄等转运过程,与生物膜对药物的通透性有关。生物膜对药物的通透程度,主要从药物的理化性质方面和转运药物跨过细胞膜这两方面考虑。机体组织的生物膜上存在着许多介导药物跨膜转运的蛋白质,称为药物转运体(drug transporters)[1]。药物转运体主要存在于肝、肾、肠、血脑屏障、胎盘屏障等组织器官中,其功能主要是将药物或内源性物质摄取或外排出细胞,影响药物在体内的吸收、分布、代谢、排泄过程,决定着药物的有效性及安全性[2]。
高原缺氧会引起机体组织缺氧,研究表明,组织缺氧会影响药物转运体的表达,进而对药物的体内代谢产生影响[3-4]。研究缺氧对药物转运体的影响,对于明确高原特殊环境下药物在体内的代谢参数的影响及指导机体的合理用药具有重要意义。本文将系统地对药物转运体的分类、缺氧对药物转运体基因和蛋白表达水平的影响、缺氧下药物转运体的调控机制等三方面进行综述,旨在为深入研究高原缺氧对药物转运体的影响和药物代谢动力学参数变化提供理论依据。
1 药物转运体的分类
机体内参与药物跨膜转运的药物转运体有很多,可分为ATP结合盒转运体(ATP binding cassette,ABC)和可溶性载体(solute carrier,SLC)[5-10]。
1.1ABC转运体ABC转运体规模庞大,它们的分子结构内含有1~2个ATP结合区域,可以直接利用ATP分解产生的能量来进行物质的跨膜转运,可转运许多底物通过细胞膜或细胞内膜。目前,ABC族转运体可分为7个不同的亚族,即ABCA~ABCG,其中与药物机体内转运最为相关的为P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multidrug resistance associated proteins,MRPs)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等。不同转运体存在的部位和介导的药物底物不相同,ABC家族转运体中主要药物转运体的分类、存在部位以及介导药物见Tab 1[5-8]。
1.2SLC族转运体SLC按照输送基质的种类和输送方式的不同,分为47大类(SLC1~SLC47),SLC族转运体的分子质量在50~100 ku之间[5,9-10]。
SLC族转运体中与药物转运相关的主要包括寡肽转运蛋白(peptide transporters,PEPTs)、一元羧酸转运蛋白(monocar-boxylate transporter,MCT)、新型有机阳离子转运蛋白(novel organic cation transporters,OCTNs)、Na+-依赖性续发性主动转运蛋白(sodium dependent secondary active transporters,SGLTs)、Na+-非依赖性易化扩散转运蛋白(sodium-independent facilitated diffusion transporters,GLUTs)、有机阳离子转运蛋白(organic cation transporters,OCTs)、有机阳离子转运多肽(organic cation transporting polypeptides,OCTP)、氨基酸转运蛋白(L-type amino transporter,LAT)、有机阴离子转运蛋白(organic anion transporters,OATs)、有机阴离子转运多肽(organic anion transporting polypeptides,OATPs)等。不同转运体存在的部位和介导的药物底物不相同,SLC家族转运体中主要药物转运体的分类、存在部位以及介导药物见Tab 2[6-10]。
2 缺氧对药物转运体基因和蛋白表达的影响
高原具有低氧、低压、寒冷、强辐射等特点,其中缺氧是影响人类生命活动最主要的因素之一。20世纪80年代,随着人类高原活动的增加,高原人群合理用药引起研究者的广泛关注。高原缺氧条件下,机体会产生一系列生理性变化,部分发生病理性变化,而这些变化影响药物的药代动力学特征,其主要原因是高原缺氧引起药物转运体的基因和蛋白表达水平的变化。
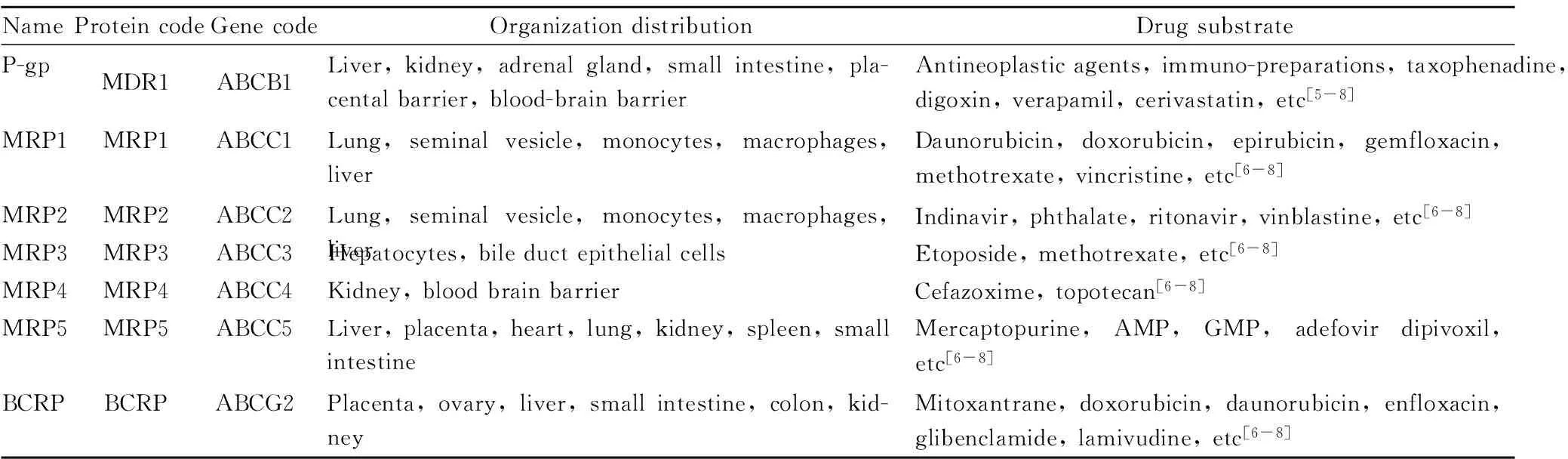
Tab 1 Classification, presence and mediation of ABC family drug transporters

Tab 2 Classification, presence and mediation of SLC family drug transporters
2.1缺氧对ABC族转运体的基因和蛋白表达的影响ABC族转运体中,各个转运体将使其底物药物由细胞内泵向细胞外。其中,文献报道最多的是由MDR1基因编码的糖蛋白,其与P-gp的功能紧密相关[9]。
P-gp是一种能量依赖性药物外排泵,最初发现于肿瘤细胞,能将细胞内的药物泵出细胞外,从而降低细胞内的药物浓度,产生多药耐药性。近年来,随着分子生物学的迅速发展,大量的研究表明,P-gp除了在肿瘤细胞中高度表达外,在正常机体组织和器官中也均有高水平的表达。从Tab 1可以看出,P-gp的底物分布较广,在联合用药时可能发生竞争性或非竞争性的药物相互作用,从而影响药动学过程,引起临床疗效的改变,或产生毒性或产生耐药性。因此,可以通过调控P-gp的表达来影响药动学过程,减少毒性或耐药性[8]。而研究缺氧条件下P-gp的表达对于指导高原合理用药有着重要的意义。
2.1.1缺氧对ABCB1/MDR1/ P-gp的蛋白和基因表达的影响 缺氧对不同组织中P-gp表达变化有不同影响,或上调、或下降。不同的研究者[11]对组织中MDR1 mRNA的相对表达水平进行了研究,John等[12]研究了缺氧条件下心肌和肝脏中P-gp表达的表达变化,结果显示,相比于常氧组,在缺氧条件下的大鼠心肌和肝脏的ABCB1 mRNA的表达水平增加(P<0.05)。课题组[3]比较了不同海拔缺氧条件下P-gp的相对表达水平,Wistar ♀大鼠被分为3组:上海组(海拔55米)、西安组(海拔500米)、玛多组(海拔4300米)。Western blot实验方法对3组中小肠、肝脏、肾脏组织中P-gp的相对表达量进行了研究,结果显示,上海组与西安组比较,小肠、肝脏、肾脏组织中P-gp的相对表达量差异均无显著性;而上海组与玛多组比较,小肠组织中P-gp的相对蛋白表达量明显下调了71.30%(P<0.05),而肝脏组织中明显上调了1.33倍(P<0.05),肾脏组织中明显上调了1.83倍(P<0.05)。RT-PCR法研究了缺氧对P-gp基因水平的影响,不同组织中MDR1 mRNA相对表达水平结果显示,上海组与玛多组比较,小肠中MDR1 mRNA的相对表达量明显下调了50.80%(P<0.05),肝脏组织中明显上调了1.15倍(P<0.05),肾脏组织中明显上调了49.00%(P<0.05)。
2.1.2缺氧对ABCC1 / MRP1的基因和蛋白表达的影响 MRP1介导许多有机阴离子的外排转运,它也是癌细胞多药耐药产生的重要因素之一[13]。MRP1在体内分布广泛,其中在肠道、肝、脑、肾有高水平的表达,MRP1负责将药物从细胞内外排出去,有利于药物在机体的排泄和消除,也可以防止外源性物质及有害代谢物进入脑部。雷婷等[14]研究了缺氧对MRP1表达水平的影响,利用Western blot方法检测不同时间缺氧处理胃癌细胞SGC7901中MRP1的变化。结果显示,与常氧状态下的SGC7901细胞相比,在缺氧培养8 h后,细胞内的MRP1蛋白表达水平增加(P<0.05)。该实验说明缺氧能够明显上调ABCC1 基因的表达以及增加其产物MRP1的蛋白水平。该实验同样也发现,与常氧状态下相比,缺氧能够明显上调MDR1基因的表达以及增加其产物P-gp的蛋白水平。闻镍等[15]同样将胃癌细胞SGC7901经过不同时间在常氧和缺氧状态下进行处理,并采用RT-PCR方法检测不同时间缺氧处理胃癌细胞SGC7901中MRP1的mRNA水平,与常氧状态下相比,缺氧能够使细胞内MRP1 mRNA 的表达水平增加。
2.1.3缺氧对ABCC2 / MRP2的基因和蛋白表达的影响 MRP2是一类位于肝细胞胆管侧膜非常重要的有机阴离子转运体,在肝细胞膜表面表达很高,是胆盐和胆红素排泄的主要转运体,负责胆红素及其他胆汁成分的排泄,能减少肝内胆汁中有毒成分的蓄积[13]。课题组[16]研究了不同海拔下缺氧对MRP2表达的影响,随机将大鼠分为3组,正常对照组、急进高海拔缺氧24 h组、急进高海拔缺氧72 h组。用Western blot方法对3组中小肠、肝脏、肾脏组织中MRP2的相对表达量进行了分析。结果显示,在小肠、肝脏组织,MRP2的蛋白表达量随着缺氧时间的延长而呈现上升的趋势;而在肾脏组织,缺氧24 h MRP2的表达增加,但缺氧72 h后,MRP2蛋白水平下降。用RT-PCR方法对不同缺氧条件下、不同组织中MRP2 mRNA相对表达水平进行了研究,得到了同样的结果。关于MRP2在缺氧条件下的变化,除了本课题组,也有研究者在肿瘤微缺氧环境及细胞缺氧[17]条件下进行了研究报道,研究结果表明,不同缺氧条件下,不同组织中MRP2表达变化规律不尽相同。究其原因与各个实验中涉及到的缺氧时间、海拔高度及研究对象不一致有关。建立一个规范性的平台,比较不同缺氧条件下,不同组织和器官中MRP2的变化,对于探索高原缺氧条件下药物转运体变化的规律具有重要意义。
2.2缺氧对SLC转运体的基因和蛋白表达的影响SLC族转运体家族庞大,种类较多,且在各个组织和器官中对药物的转运起着重要的作用。但是目前对于SLC族转运体的研究较少,而缺氧对SLC转运体表达变化的影响的研究鲜有报道。Wojtal等[18]系统研究了高海拔对人体十二指肠中17种SLC转运体表达的影响,这17种SLC转运体分别PEPT1、PEPT2、SGLT1、GLUT2、LAT1、LAT2、MCT1、MCT4、MCT8、OAT1、OAT2、OAT3、NTCP、ISBT(ASBT)、OCT1、OCT2、OCT3,运用Western blot和RT-PCR方法分别比较了常氧与缺氧状态下17种SLC转运体的蛋白和mRNA的表达变化。结果显示,人体的十二指肠中不同的SLC族转运体在常氧状态下蛋白表达量偏低的药物转运体占50%(PEPT1、PEPT2、SGLT1、LAT1、MCT4、MCT8、OAT3、NTCP),蛋白表达水平较低占29.4%[GLUT2、OAT2、ISBT(ASBT)、OCT2、OCT3],蛋白表达量高的仅占11.8%(LAT2、MCT1)。SLC族转运体在缺氧状态下,mRNA表达量上调占82.4%[PEPT1、PEPT2、SGLT1、GLUT2、LAT1、LAT2、MCT1、MCT4、MCT8、OAT2、OAT3、NTCP、ISBT(ASBT)、OCT3],下调占17.6%(OAT1、OCT1、OCT2)。但也有文献研究[19]了不同缺氧状态对SLC转运体的影响,研究结果表明,模拟缺氧与高原缺氧研究结果一致性有一定的差异。系统地研究不同缺氧状态下不同组织中SLC族转运体表达量变化规律,特别是SLC组转运体中重要的药物转运体OATP和MAT在缺氧状态下的变化规律,亟待进行深入研究。
3 缺氧下药物转运体的调控机制
缺氧会影响CYP酶活性和表达,并将改变药物药代动力学参数[20]。但Ribeiro等[21]报道,在缺氧条件下药物的药代动力学参数发生改变时,CYPs的活性和表达量并没有改变。CYPs的活性和表达量变化与否可能与在药物代谢过程中缺氧对药物转运体的调控机制有一定的关系,并决定药代动力学参数变化。
3.1缺氧条件下ABC族药物转运体的调控机制
3.1.1缺氧条件下ABCB1/MDR1/ P-gp的调控机制 MDR1在缺氧条件下的表达受很多信号通路的调节,已报道有多种通路,如p53通路、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)通路、NF-κB通路[22-25]、低氧诱导因子(hypoxia-inducible factor 1α,HIF-1α)通路[26]、孕烷X受体(pregnane X receptor,PXR)信号通路[27]、组成型雄甾烷受体(constitutive androstane receptor,CAR)[27-28]信号通路等。MDR1在缺氧状态下的表达并非受1种通路调节,李文斌等[3]报道了运用构建Caco-2细胞缺氧模型,并在实验室前期lncRNA高通量基因芯片筛选缺氧差异性lncRNAs基础上,研究缺氧条件下H19、药物转运体及相关转录因子、核受体表达变化,通过沉默lncRNA-H19,利用RT-PCR、Western blot技术考察干扰H19后对Caco-2细胞中转运体及相关转录因子、核受体表达的影响。综合文献[22-28],课题组提出以下两点结论:(1)lncRNA-H19转录因子与MDR1的基因启动子或增强子的结合;即缺氧上调HIF-1及NF-κB的表达,从而引起H19的上调,H19上调使其下游的PXR、CAR表达上调,二者与MDR增强子上核受体应答元件相结合,上调MDR1的转录。(2)沉默H19后,HIF-1及NF-κB的mRNA表达不发生改变,而蛋白水平发生改变,说明二者可能在其上游,基因表达不受H19的调控,可能是由于lncRNA H19与HIF-1、NF-κB结合,减少了二者的降解,使缺氧时二者的浓度升高,与MDR1的基因启动子的结合增加,同时H19使其下游的PXR、CAR表达上调,与MDR增强子上核受体应答元件相结合,上调MDR1的表达。lncRNA H19参与调控P-gp的机制见Fig 1。初步表明lncRNA-H19是缺氧条件下药物转运体表达变化机制调控中关键的分子,其可能是通过转录水平及转录后水平调控HIF1α、NF-κB、PXR、CAR的表达,最终形成对MDR1表达的一个调控网络。
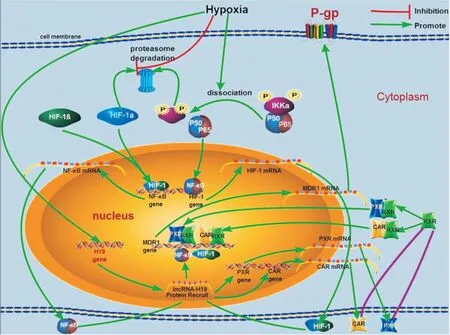
Fig 1 Mechanisms of P-gp regulation by lncRNA H19[3]
3.1.2缺氧条件下ABCC1/ MRP1的调控机制 缺氧条件下,调控MRP1机制研究最多的是HIF-1α和NF-κB机制[29-30]。研究者采用HepG2人肝癌细胞模型,发现缺氧可诱导肝癌细胞中MRP1等基因的高表达。同时,研究者也发现,MRP1基因的表达增高与HIF-1α表达的变化呈同步趋势,而且在HIF-1α/PCDNA3.0质粒稳定转染的HepG2细胞中,MRP1在基因和蛋白水平的表达均明显升高。这提示缺氧条件下,核转录因子HIF-1α可促进细胞内MRP1基因的表达。MRP1在肿瘤环境下的调控机制对于研究实质缺氧环境下MRP1的调控机制既有指导作用,却又不完全相同。
3.2缺氧条件下SLC族药物转运体的调控机制SLC族转运体种类多,作用底物较多,但是对缺氧条件下SLC族转运体的调控机制研究的鲜有报道。目前的研究中,关注最多的是肿瘤环境中PXR与SLC族药物转运体之间的多药耐药性关系。Wojtal等[18]报道,在体外细胞实验中,研究者认为PXR是核受体(nuclear receptor,NR)超家族成员之一,在药物的氧化、代谢和排泄过程及肿瘤多药耐药性的形成中起着重要作用。PXR能够调控多种药物代谢酶和药物转运体的表达,进而参与药物代谢及肿瘤多药耐药性的形成。现阶段的研究中发现,PXR主要的调控靶点包括尿苷二磷酸-葡萄糖醛酸转移酶(uridine diphosphate-glucuronosyl transferase,UGTs)、OCT1等多种SLC转运体。已有SLC研究报道中有关转运体OATP和MAT等的研究较少,同时,缺氧条件多指肿瘤缺氧的微环境,而相关高原缺氧对SLC族转运体调控机制的研究将是重点研究方向。
4 结语
由于分子生物学和基因工程技术的发展,关于缺氧条件下药物转运体表达变化的研究取得了很大的成果。但在高原缺氧研究中依然存在的很多问题,其一,对于不同组织在不同转运体缺氧条件下表达量变化的研究不够系统,目前还没有将一个转运体在其存在的各个组织中表达的变化研究系统化,且结论不一致;其二,上述所涉及的缺氧条件各不相同,无法获得比较准确的比较结果,建立一个统一的缺氧条件,对于获得可信的实验结果有一定的帮助;其三,实验设计中有涉及高原缺氧,均为模拟高原相对海拔,不能真实反映缺氧环境。模拟的缺氧结果与实地的缺氧结果是否一致,还需要进一步的实验验证;其四,涉及到的缺氧对药物转运体调控机制研究比较少。综上所述,现有的高原缺氧对药物转运体的研究较为分散,不成体系,故系统准确地研究该领域对填补高原药理学的空白具有重大意义。
[1] Chen L, Rao H, Zhang W, et al. Association of ATP-binding cassette transporter(ABC) gene polymorphisms with viral load in patients with genotype 1 hepatitis C virus infection[J].ClinLab, 2016,62(9):1643-9.
[2] Fleck R A. Low-temperature electron microscopy: techniques and protocols[J].MethodsMolBiol, 2015,1257:243-74.
[3] Li W, Li J, Wang R, et al. MDR1 will play a key role in pharmacokinetic changes under hypoxia at high altitude and its potential regulatory networks[J].DrugMetabRev, 2015,47(2):191-8.
[4] 邵 涛, 秦 一, 徐平湘, 等. 低氧与常氧状态下罗红霉素在大鼠体内的药代动力学比较[J].中国药理学通报, 2016,32(11):1596-601.
[4] Shao T, Qin Y, Xu P X, et al. Pharmacokinetics of roxithromycin in rats under hypoxia and normoxia[J].ChinPharmacolBull, 2016,32(11):1596-601.
[5] Chou C W, Wang C C, Wu C P, et al. Tumor cycling hypoxia induces chemoresistance in glioblastoma multiforme by upregulating the expression and function of ABCB1[J].NeuroOncol, 2012,14(10):1227-38.
[6] Estudante M, Morais J G, Soveral G, Benet L Z. Intestinal drug transporters: an overview[J].AdvDrugDelivRev, 2013,65(10):1340-56.
[7] 王 丽, 刘克辛. 常见肠、肝、肾疾病以及糖尿病状态下相关药物转运体的变化及其应用意义[J]. 药学学报, 2015,50(2):127-32.
[7] Wang L, Liu K X. Alteration of related transporters and its application significance in common intestinal disease, liver disease, renal disease and diabetes[J].ActaPharmSina, 2015,50(2): 127-32.
[8] Kathawala R J, Gupta P, Ashby C R Jr, et al. The modulation of ABC transporter-mediated multidrug resistance in cancer: a review of the past decade Rishil [J].DrugResistUpdat, 2015,18:1-17.
[9] 舒 焱. 有机阳离子转运体研究进展[J]. 中南大学学报(医学版), 2011,36(10):913-26.
[9] Shu Y. Research progress in the organic cation transporters [J].JCentSouthUniv(MedSci), 2011,36(10): 913-26.
[10] Maric P, Ahel M, Senta L, et al. Effect-directed analysis reveals inhibition of zebrafish uptake transporter Oatp1d1 by caulerpenyne, a major secondary metabolite from the invasive marine alga Caulerpa taxifolia[J].Chemosphere, 2017,174:643-54.
[11] Zhao L, Li H, Zhu Z, et al. Genomic sequencing of a strain of Acinetobacter baumannii and potential mechanisms to antibiotics resisitance[J].InfectGenetEvol, 2017,50:20-4.
[12] Dopp J M, Moran J J, Abel N J, et al. Influence of intermittent hypoxia on myocardial and hepatic P-glycoprotein expression [J].Pharmacotherapy, 2009,29(4): 365- 72.
[13] Tian J, Hu J, Chen M, et al. The use of MRP1-deficient(Danio rerio) zebrafish embryos to investigate the role of Mrp1 in the toxicity of cadmium chloride and benzo [a] pyrene[J].AquatToxicol, 2017,186:123-33.
[14] 雷 婷, 刘理礼, 韩 霜, 等. 缺氧诱导胃癌多药耐药的机制研究[J]. 胃肠病学和肝病学杂志, 2011,20(5):414-8.
[14] Lei T, Liu L L, Han S, et al. Hypoxia-induced gastric cancer multidrug resistance mechanism [J].JGastroenterolHepatol, 2011,20(5):414-8.
[15] 闻 镍, 张双庆, 朱 凌. P-糖蛋白最新研究进展[J]. 中国药事, 2011,25(7):718-23.
[15] Wen N, Zhang S Q, Zhu L. P-glycoprotein recent research progress [J].ChinPharm, 2011,25(7):718-23.
[16] 罗冰峰, 尹 强, 王 荣, 等. 缺氧对大鼠药物转运体MDR1、MRP2表达的影响[J]. 南方医科大学学报, 2016,36(9):1169-74.
[16] Luo B F, Yin Q, Wang R, et al. Effects of hypoxia on the expression of MDR1 and MRP2 in drug transporters in rats [J].JSouthernMedUniv, 2016,36(9):1169-74.
[17] Kadam R S, Ramamoorthy P, LaFlamme D J, et al. Hypoxia alters ocular drug transporter expression and activity in rat and calf models: implications for drug delivery[J].MolPharm, 2013,10(6):2350-61.
[18] Wojtal K A, Cee A, Lang S, et al. Down regulation of duodenal SLC transporters and activation of proinflammatory signaling constitute the early response to high altitude in humans[J].AmJPhysiolGastrointestLiverPhysiol, 2014,307:G673-88.
[19] Sun B W, Zhao X C, Wang G J, et al. Hormonal regulation of dipeptide transporter (PepT1) in Caco-2 cells with normal and anoxia_reoxygenation management[J].WorldJGastroenterol, 2003,9(4):808-12.
[20] Wang R, Sun Y, Yin Q, et al. The effects of metronidazole on cytochrome P450 activity and expression in rats after acute exposure to high altitude of 4300m [J].BiomedPharmacother, 2017,85:296-302.
[21] Ribeiro A L, Ribeiro V. Drug metabolism and transport under hypoxia[J].CurrDrugMetab, 2013,14(9):969-75.
[22] Xue G M, Xia Y Z, Wang Z M, et al. Neo-Clerodane diterpenoids from Scutellaria barbata mediated inhibition of P-glycoprotein in MCF-7/ADR cells [J].EurJMedChem, 2016,121: 238-49.
[23] Bentires-Alj M, Barbu V, Fillet M, et al. NF-kappa B transcription factor induces drug resistance through MDR1 expression in cancer cells[J].Oncogene, 2003,22:90-7.
[24] Roy K R, Arunasree K M, Dhoot A, et al. C-Phycocyanin inhibits 2-acetylaminofluorene- induced expression of MDR1 in mouse macrophage cells: ROS mediated pathway determined via combination of experimental and In silico analysis [J].ArchBiochemBiophys, 2007,459(2):169-77.
[25] Yu S T, Chen T M, Tseng S Y, et al. Tryptanthrin inhibits MDR1 and reverses doxorubicin resistance in breast cancer cells[J].BiochemBiophysResCommun, 2007,358(1):79-84.
[26] 李永金, 杨开勇, 张 谊, 等. 低氧诱导因子-1α在喹啉酸诱导的PC12细胞损伤中的作用[J]. 中国药理学通报, 2015,31(4) :493-9.
[26] Li Y J, Yang K Y, Zhang Y, et al. The role of hypoxia-inducible factor-1α in quinolinic acid-induced PC12 cell injury [J].ChinPharmacolBull, 2015,31(4): 493-9.
[27] Banerjee M, Robbins D, Chen T. Targeting xenobiotic receptors PXR and CAR in human diseases[J].DrugDiscovToday, 2015,20(5):618-28.
[28] Galardo M N, Gorga A, Merlo J P, et al. Participation of HIFs in the regulation of Sertoli cell lactate production [J].Biochimie, 2017,132:9-18.
[29] Choudhry H, Harris A L, McIntyre A. The tumour hypoxia induced non-coding transcriptome [J].MolAspectsMed, 2016,47-48:35-53.
[30] Lee J W, Bae S H, Jeong J W. Hypoxia-inducible factor (HIF-1) alpha: its protein stability and biological functions[J].ExpMolMed, 2004,36(1):1-12.