上皮性卵巢癌组织中 DLL4、Slit2表达相关性及意义
2018-03-15唐国珍佟秀琴
李 娅,唐国珍,佟秀琴
(1.成都医学院第一附属医院妇产科,四川 成都 610500; 2.包头市中心医院妇产科,内蒙古 包头 014040)
卵巢癌在女性恶性肿瘤中较常见,因患者症状不典型,早期诊断缺乏依据,多数病例确诊时已到晚期,致使死亡率居高不下。虽卵巢恶性肿瘤细胞对减灭术和化疗有效,但多重耐药特点,据统计上皮性卵巢癌五年生存率为25%~30%[1]。近年来研究表明 DLL4配体又称DSL(Delta like 4)蛋白,表达于血管发展网络中,参与血管生成、DLL4-Notch信号通道、组织细胞之间通讯传递、调控器官细胞发育方面高度保守[2]。研究证实DLL4配体在正常血管内皮中呈安静状态,在血管生长系统中呈活跃状态[3]。神经迁移因子Slit2(Slit Homogene 2)是分泌型细胞外基质蛋白的一种,在果蝇体内得到证实,分布于神经组织、血管内皮细胞、多种实体瘤组织中。有学者发现过度表达Slit2因子或是重组Slit2因子可显著控制肿瘤细胞袭击[4]。有关二者在卵巢恶性肿瘤中表达及相互作用,国内外报道罕见。本实验通过检测上皮性卵巢组织中两者表达情况,为提升上皮性卵巢癌妇女生存率提供参考。
1材料与方法
1.1材料
卵巢石蜡标本来源于2009年1月1日至2016年12月30日包头市中心医院病理科,共120例,其中30例正常卵巢组织、30例上皮性良性肿瘤组织、30例上皮性交界性肿瘤组织、30例上皮性恶性肿瘤组织。四组患者年龄45~55岁,平均50.24岁,四组年龄比较无统计学差异(P>0.05)。本实验纳入标准:采集标本均得到伦理委员会审批且患者均知情并签署同意书。所有病理切片均经两位病理专家核实,术前均未进行过放疗、化疗、激素类药物治疗等。
1.2实验试剂及方法
1.2.1 实验试剂
Rabbit Anti-DLL4/Delta 4、Rabbit Anti-Slit2/Slit3、过氧化物酶标记的链酶卵白素染色试剂盒(SP-0024免疫组化染色试剂盒)、DAB 染色剂均采购北京博奥森公司,包头市中心医院病理科提供柠檬酸盐修复液、PBS 缓冲液、苏木精液、不同浓度二甲苯液、不同浓度无水乙醇、蒸馏水、枸橼酸缓冲液、中性树胶封片、载玻片。
1.2.2 实验方法
本实验采用免疫组化(strept avidin-biotin complex,SABC)法,具体步骤如下:①术后取下标本置于10%中性福尔马林固定,石蜡包埋,做 4μm 厚度连续切片;② 60℃恒温医用烤箱烘烤后,依次放置二甲苯 Ⅰ、Ⅱ、Ⅲ 容器中脱蜡,递减浓度酒精中水化;③高温加热5 分钟后断电、自然冷却至室温,经0.1mmol/L PBS 缓冲液冲洗后, 0.3%H2O2消除内源性过氧化物酶活性,再次 0.1 mmol/L PBS 缓冲液冲洗;④参照SP-0024 免疫组化染色试剂盒说明书进行后,DAB显色5~8分钟,苏木精染色、在浓度递增的酒精中脱水、二甲苯透明、常规封片,最后两位高年资病理科医生显微镜下阅片;⑤以PBS缓冲液代替一抗作对比。
1.3评判标准
DLL4、Slit2表达细胞质中,呈现棕黄色颗粒,按照染色强度和阳性细胞比例评分:无着色为0分,淡黄色为1分,黄色为2分,棕褐色为3分,阳性细胞数分级:无阳性细胞为0分,阳性细胞数≤10%为1分,11%~50%为2分,51%~75%为3分,≥76%为4分,阳性表达为两项之和≥3。
1.4统计学方法

2结果
2.1 DLL4、Slit2 在上皮性卵巢组织学类型表达
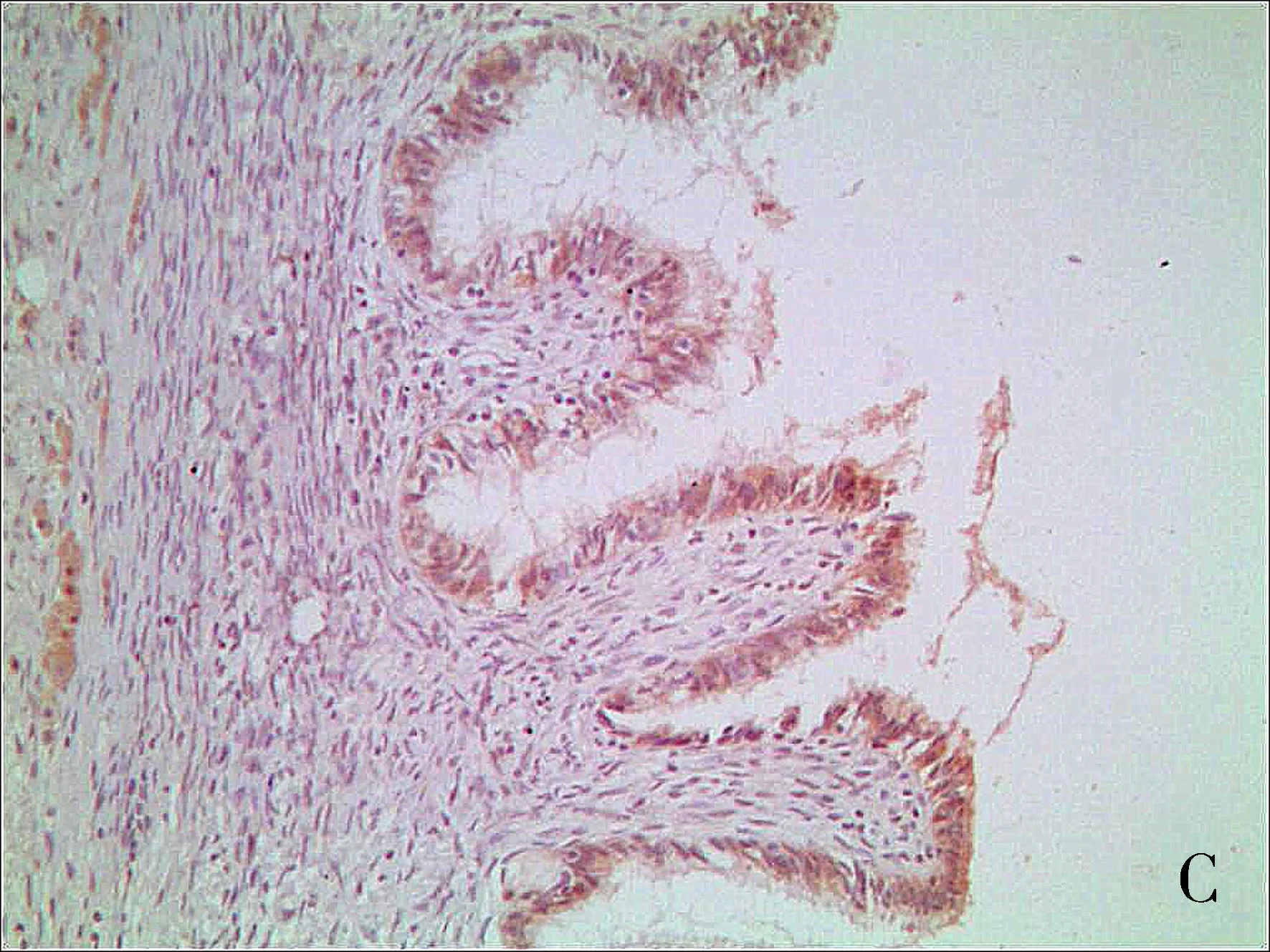
DLL4配体、Slit2在卵巢细胞胞质中呈现棕黄色颗粒(见图1、图2)。DLL4在恶性肿瘤组阳性表达率为83.33%,显著高于交界性肿瘤组、良性肿瘤组、正常卵巢组(均P<0.01)。除恶性肿瘤组,其余三组两两比较无显著性差异(均P>0.05)。Slit2阳性在恶性肿瘤组表达率为36.67%(11/30),显著低于交界性肿瘤组、良性肿瘤组表达、正常卵巢组阳性表达率(均P<0.05),卵巢上皮性恶性肿瘤组阳性表达率显著低于正常卵巢组、上皮性卵巢良性肿瘤组(均P<0.05)。正常卵巢组织、良性肿瘤组织、交界性肿瘤组三组两两比较无统计学意义(均P>0.05),见表1。
2.2上皮性卵巢恶性肿瘤中DLL4、Slit2相关性表达
上皮性卵巢恶性肿瘤组30例中有25例DLL4呈阳性表达,11例Slit2呈阳性表达,通过Spearman相关分析,DLL4与Slit2呈负相关(r=-0.365,P=0.047)。
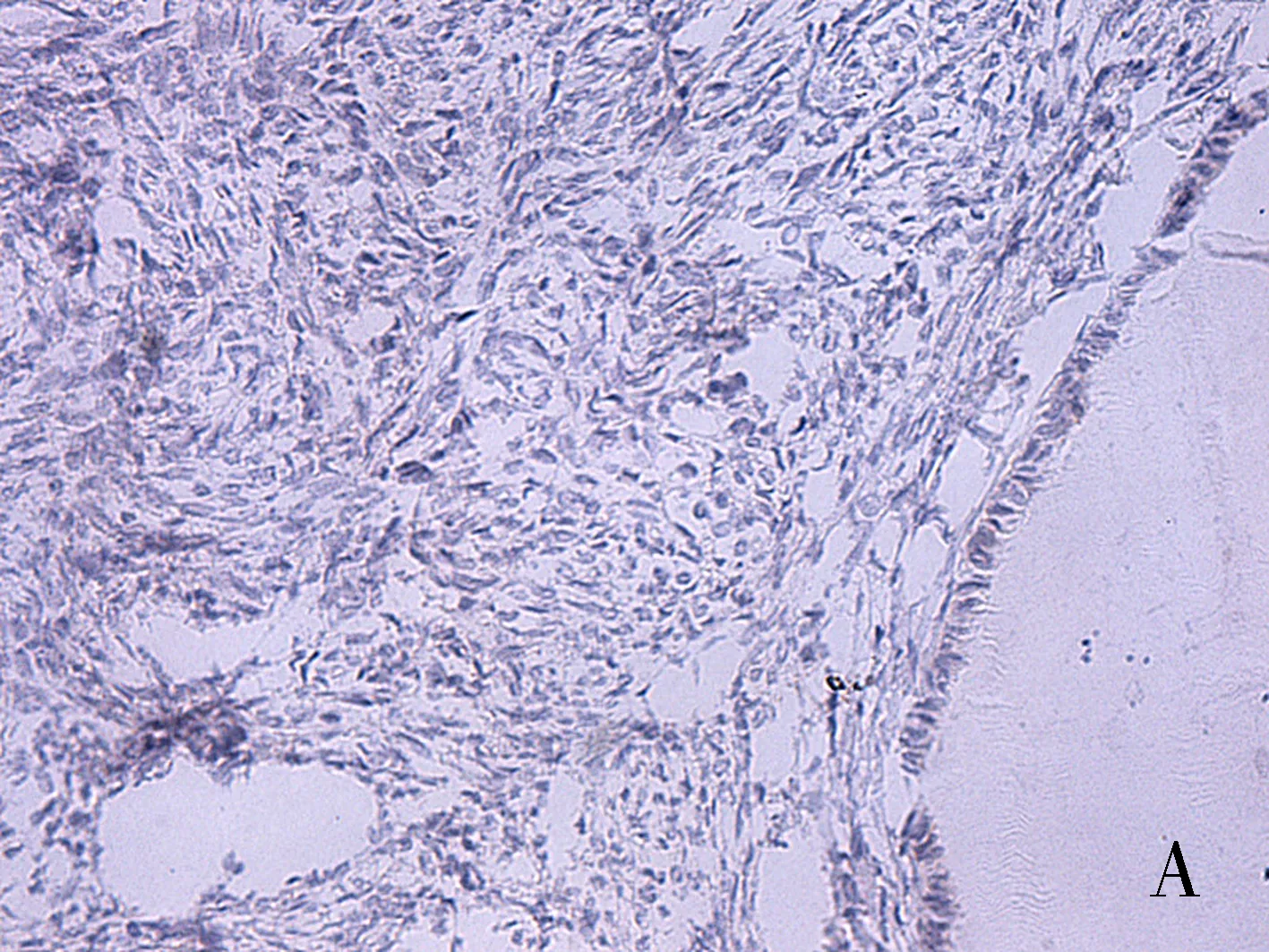
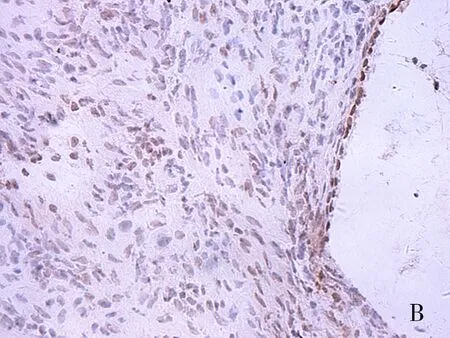
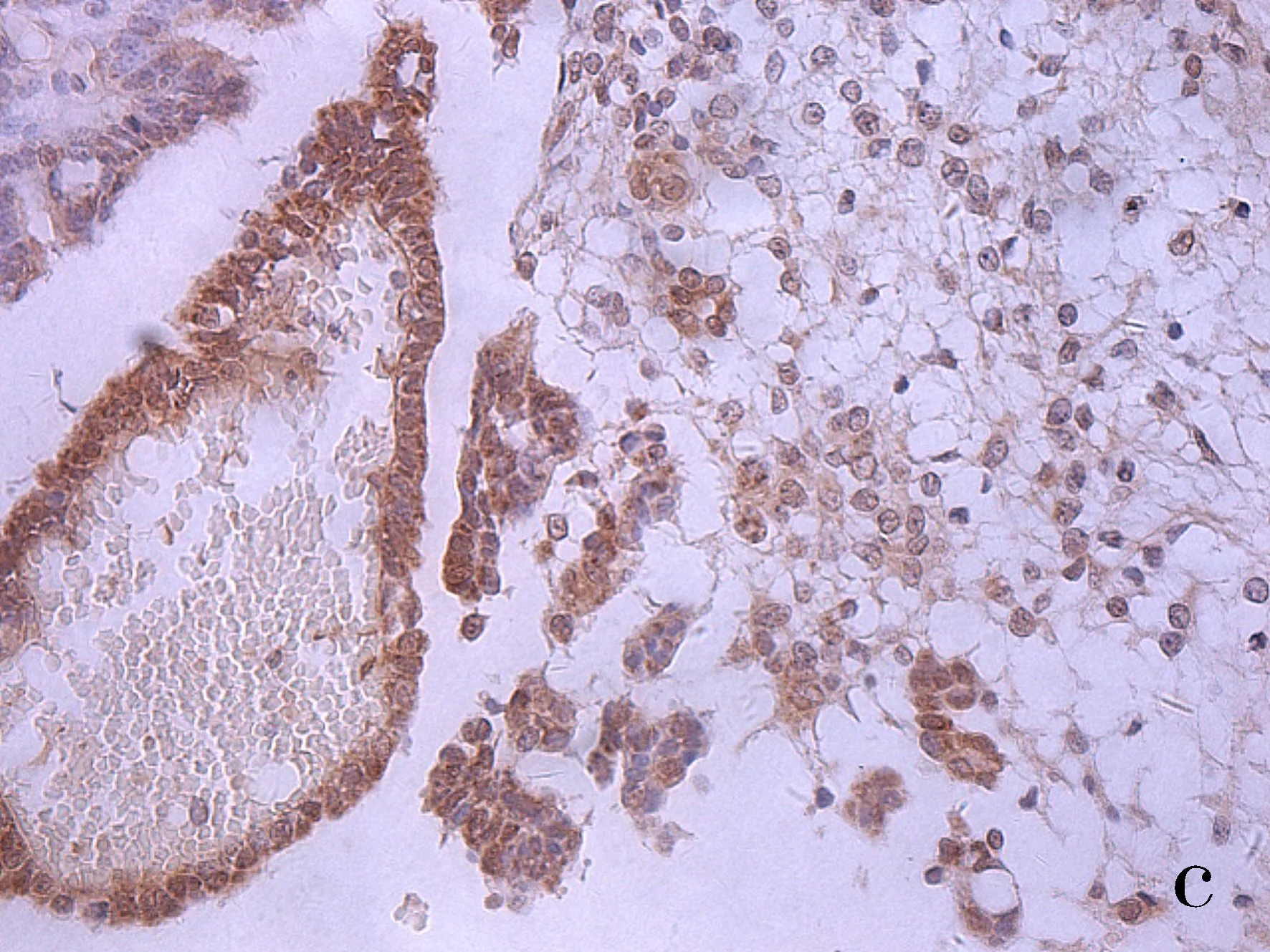

注:A为正常卵巢;B为良性卵巢肿瘤;C为交界性肿瘤;D为恶性肿瘤。
图1 DLL4在上皮性卵巢组织中表达(SP×400)
Fig.1 Expression of DLL4 in epithelial ovarian tissues (SP×400)
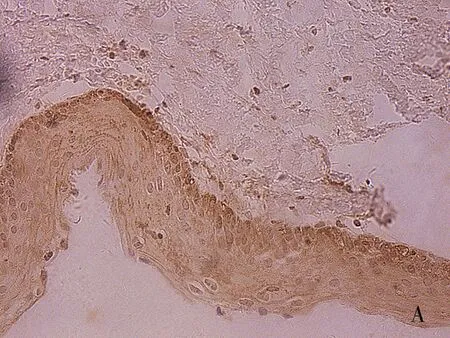


注:A为正常卵巢;B为良性卵巢肿瘤;C为交界性肿瘤;D为恶性肿瘤。
图2 Slit2在上皮性卵巢组织中表达(SP×400)
Fig. 2 Expression of Slit2 in epithelial ovarian tissues (SP×400)
表1 DLL4配体、Slit2蛋白在上皮性卵巢组织四种类型中表达[n(%)]
Table 1 Expressions of DLL4 and Slit2 in four types of epithelial ovarian tissues [n(%)]
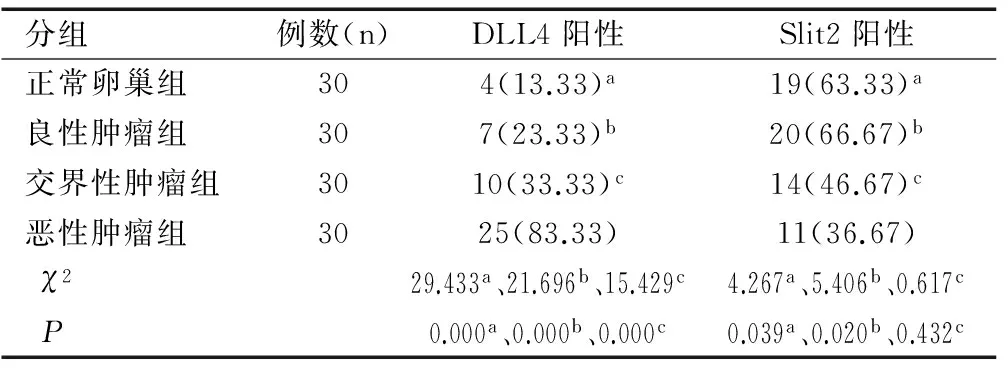
注:a、b、c分别为正常卵巢组织、卵巢上皮性良性肿瘤组织及卵巢上皮性交界性肿瘤组织与卵巢上皮性恶性肿瘤组织的比较。
3讨论
3.1 DLL4在上皮性卵巢癌组织中的表达及意义
DLL4是Notch配体,对组织邻近细胞之间信号传导、调控器官细胞发育发挥着举足轻重的作用。DLL4配体表达在胚胎发育动脉内皮细胞、血管发育形成的尖端细胞及动脉内皮细胞[5]。本研究结果表明,在上皮性卵巢恶性肿瘤组、上皮性卵巢交界性肿瘤组、上皮性卵巢良性肿瘤组织、正常卵巢组织中,DLL4阳性表达呈依次递减趋势,其中卵巢恶性肿瘤组阳性表达率均显著高于其余三组(P<0.05),而正常卵巢组织、良性肿瘤组织、交界性肿瘤组织之间两两比较无统计学意义(P>0.05),提示卵巢肿瘤细胞可能有促进血管新生,而DLL4的过度表达,与VEGF-A协同调节肿瘤血管萌发和分支,使得与侧支血管吻合明显减少,肿瘤组织血管微环境得以改善,这与俞岚等[6]观点一致。本研究阻断Notch1/DLL4 信号,通过产生非功能性血管,减少了组织灌注,造成肿瘤组织缺血、缺氧,从而抑制上皮性卵巢癌发展。就此观点,在其他器官疾病中得到证实,如肝癌[7]、 非小细胞肺癌[8]、糖尿病视网膜病变[9]中均呈高表达,这些研究进一步证实DLL4配体与肿瘤多种临床因素有关,如:临床分型、肿块大小、分化等级、转移程度密切相关,而与性别、年龄无关。本实验不足之处在于因卵巢肿瘤组织类型多种多样、收集标本数量有限、且上皮性卵巢恶性肿瘤手术均为不全根治手术,故未对上皮性卵巢恶性肿瘤浸润程度、淋巴结转移等相关临床因素分析。
3.2 Slit2在上皮性卵巢癌组织中的表达及意义
肿瘤细胞中Slit/Robo信号通路由Slit2蛋白、Robo1、Robo4受体主导,Slit2是新型抑癌基因[10]。Slit2 与不同Robo 受体协同调节神经元细胞、内皮细胞、白细胞及恶性肿瘤血管的生成[11]。本实验研究表明:Slit2阳性表达率在恶性肿瘤组织、交界性肿瘤组织、良性肿瘤组织、正常卵巢组织逐渐上升,这说明Sli2在上皮性卵巢恶性肿瘤中起到抑制作用,机制可能通过Slit2启动子甲基化,杂合性丢失,基因突变、缺失、过表达等原因导致基因低表达[12],诱发上皮性卵巢恶性肿瘤的发生。而Slit2在恶性肿瘤中的表达存在争议,有学者认为Slit2通过血管内皮细胞迁移促进肿瘤血管生成[13],推测通过切断Slit2 与Robo之间信号传递,VEGF下调,广泛有效地抑制血管生长[14]。
在卵巢上皮性恶性肿瘤中,DLL4配体呈高表达,推测肿瘤新血管发展受内皮细胞上尖端细胞、杆细胞比例调节,尖端细胞对新血管萌芽、分支占主导地位,杆细胞延伸新血管分支,DLL4-Notch 信号通路按比例调节尖端细胞、杆细胞,促进新血管萌芽和分支,通过协同VEGFR调控新生血管网的生成及完善血管功能,使卵巢恶性肿瘤血供增加,推动发展。Slit2在上皮性卵巢恶性肿瘤中呈低表达。推测通过灭活Src家族酶,Slit2结合Robo4受体,阻碍由VEGF参与的促血管生成,或阻碍VEGF-165诱导的内皮细胞迁移,具体机制有待探讨。由此推测DLL4、Slit2通过VEGF,在卵巢上皮性恶性肿瘤中起到相反的作用,此结果应增加样本含量,对卵巢组织学进行分型,从细胞学层面进一步探讨两者在上皮性卵巢癌组织中的表达关系。
[1]Schrepf A,Thaker P H,Goodheart M J,etal.Diurnal cortisol and survival in epithelial ovarian cancer[J].Psychoneuroendocrinology,2015,53:256-267.
[2]熊爱为,谢静燕. Notch 信号通路及其在卵巢癌细胞中的作用[J]. 中国妇幼健康研究,2015,26(5):1100-1102.
[3]Liu Z,Fan F,Wang A,etal.Dll4-Notch signaling in regulation of tumor angiogenesis[J].J Cancer Res Clin Oncol,2014,140(4):525-536.
[4]张明慧,周希瑗.腺病毒介导slit2基因转染人视网膜色素上皮细胞对RF/6A细胞迁移及管腔形成的影响[J].第三军医大学学报,2015,37(16):1619-1623.
[5]Yu S,Sun J H,Zhang J G,etal.Aberrant expression and association of VEGF and Dll4/Notch pathway molecules under hypoxia in patients with lung cancer[J].Histol Histopathol,2013, 28(2):277-284.
[6]俞岚,焦云杰,周蕾,等.上皮性卵巢癌中八聚体结合转录因子4、Notch1及DLL4的表达及其临床意义[J].南方医科大学学报,2017,37(4):444-450.
[7]刘航,汪伟民,张剑波,等.HIF-2α-VEGF-Notch信号通路在高强度聚焦超声不完全消融后肝癌中的作用[J].第三军医大学学报,2017,39(7):608-615.
[8]王维,李强,韩青松,等.HIF-α、VEGF 和 DLL4在非小细胞肺癌中的表达及临床意义[J].解放军医药杂志,2016,28(5):44-47,53.
[9]郭庆敏. Notch1、Dll4在糖尿病性视网膜病变新生血管形成中的作用研究[D].青岛:青岛大学,2016.
[10]Qi C,Lan H,Ye J,etal.Slit2 promotes tumor growth and invasion in chemically induced skin carcinogenesis[J].Lab Invest,2014,94(7):766-776.
[11]Li P,Peng H,Lu W H,etal.Role of Slit2/Robo1 in trophoblast invasion and vascular remodeling during ectopic tubal pregnancy[J].Placenta,2015,36(10):1087-1094.
[12] Dong R,Yu J,Pu H,etal.Frequent SLIT2 promoter methylation in the serum of patients with ovarian cancer[J].J Int Med Res,2012,40(2):681-686.
[13]Li S,Huang L,Sun Y,etal.Slit2 promotes angiogenic activity via the Robo1-VEGFR2-ERK1/2 pathway in both in vivo and in vitro studies[J].Invest Ophthalmol Vis Sci,2015,56(9):5210-5217.
[14] Tang W,Tang J,He J,etal.SLIT2/ROBO1-miR-218-1-RET/PLAG1:a new disease pathway involved in Hirschsprung's disease[J]. J Cell Mol Med,2015,19 (6): 1197-1207.
