间充质干细胞成骨分化过程中骨形态发生蛋白的作用研究
2018-03-14张斌斌高全文
张斌斌,高全文,李 冰,黄 沙
骨形态蛋白(bone morphogenetic proteins,BMP)是TGF-β超家族的成员,是一种分泌性多功能蛋白,这些信号蛋白有多种功能,在胚胎发生、器官形成、细胞增殖和干细胞分化方面发挥着重要作用[1-2]。迄今为止,人们所鉴定的BMP至少有20种,如BMP-7与肝脏、眼睛、四肢的发育有关;BMP-4、BMP-7及BMP-15对再生组织的发育很重要;BMP-2、BMP-3及BMP-7有助于软骨再生;BMP-12及BMP-13与肌腱愈合有关[3]。BMP在骨形成、骨发育和间充质干细胞分化中也发挥着重要的作用[4-5]。
间充质干细胞(mesenchymal stem cells,MSCs)最早在骨髓中发现,是一类具有自我复制和多分化能力的成体干细胞,它们可以分化为成骨细胞、成软骨细胞、成肌细胞、成脂细胞、心肌和皮肤等,这些多能干细胞向成骨细胞的分化取决于包括BMP信号转导在内的多条信号通路。研究者通过多种基因敲除模型证明BMP信号通路中断会造成骨及骨外组织发育的异常,并阐明了与此相关的机制[6-9]。目前已经证实MSCs在细胞因子(如BMP、bFGF等)、机械力学刺激、特定化学物质(地塞米松、维生素C、β-甘油磷酸钠)等体外环境刺激下具有明显的成骨细胞分化能力[10]。改变促进成骨细胞分化的体外环境能否缩短骨形成的时间(如BMP和机械力在促进骨形成方面是否具有协同作用)是目前研究的热点方向之一。笔者所在团队也在做相关研究工作。本文通过概括目前BMP调节成骨的研究进展,全面展现BMP在骨形成中的作用机制,为修复骨缺损及发育异常提供理论依据。
1 MSC成骨分化过程
骨重建过程主要是由成骨细胞所介导,间充质干细胞向成骨细胞谱系增值和分化的过程中需要经历几个阶段的成熟过程,包括:(1)MSC起初形成骨-软骨原细胞(osteochondral progenitor)[表达Runt相关转录因子2(runt-related transcription factor 2,Runx2)和胶原蛋白Ⅱ型];(2)骨-软骨原细胞定向为骨原细胞(osteoprogenitor)(表达osterix);(3)骨原细胞的扩增;(4)成骨细胞(osteoblasts)的成熟(表达骨钙素和胶原蛋白Ⅰ);(5)骨细胞的凋亡[11]。这个过程由生长因子、激素、细胞因子、机械负荷和年龄等因素调节。MSC向成骨细胞分化是一个多重步骤的过程,该过程需要谱系特异性的转录因子如Runx2和Osterix(Osx)以及普遍表达的转录因子Atf4和Dlx5等的参与。Runx2、Osterix/Sp7、β-catenin、转录激活因子4、核转录因子激活蛋白 1、Smads 等,它们彼此协同作用,共同参与调节成骨细胞分化及骨形成。其中,核心结合因子α1/Runx2(core binding factorα1/Runx2,Cbfα1/Runx2)及Osterix/Sp7作为成骨特异性转录因子,在成骨细胞分化及骨形成过程中起关键调控作用[12]。因而,Runx2及Osterix 也被认为是成骨分化调控网络的关键节点,参与组成该网络的各条信号通路都直接或间接作用于该节点, 并最终调控其下游靶基因的表达,从而调节成骨细胞分化及骨形成[13]。
分化后期,成骨细胞需要经历细胞增殖期(包括骨原细胞的增殖),可以增加细胞数量,从而形成多层细胞。成骨细胞的增殖过程受多种生长因子调控,包括BMP、TGFβ、Wnt、成纤维细胞生长因子(fibroblast growth factor,FGF)、血小板源性生长因子(platelet-derived growth factor, PDGF)以及胰岛素样生长因子(insulin-like growth factor,ILGF)[14];随后是细胞外基质成熟期,细胞开始分化而表达成骨细胞特异的指标蛋白,包括Osx、Ⅰ型胶原酶(TypeⅠCollagen ,Col1)、骨涎蛋白(bone sialoprotein,BSP)、骨钙蛋白(Osteocalcin,OCN)、碱性磷酸酶(alkaline phosphatase,ALP)、骨粘连蛋白(osteonectin,ON)和骨桥蛋白(osteopontin,OPN)。ALP是钙和磷形成沉淀的中心,是细胞外基质成熟的早期标志。在细胞外基质成熟期,成熟的骨细胞合成并分泌Ⅰ型胶原。在矿化期,ALP活性下降,与基质中经磷灰石沉积相关的基因表达增加,骨钙素等非胶原蛋白分泌至细胞外基质中,与钙、磷结合,然后沿胶原分子的长轴形成羟磷灰石结晶。最后成骨细胞开始凋亡。
2 BMP和骨形成
尽管BMP介导骨形成的具体分子机制尚有待明确,但已有研究均表明其在成骨分化中起着至关重要的作用。多数学者认为 BMPs是骨形态发生最早期的信号分子,对成骨细胞分化及骨形成具有特异性诱导作用[15-16]。动物研究发现腺病毒、逆转录酶病毒和重组体等介导BMP过表达可诱导骨形成。BMP转染间充质干细胞可使成骨细胞特异性标记物表达增加,包括早期成骨标记物碱性磷酸酶(ALP)、晚期成骨标记物骨钙素和骨调素、结缔组织生长因子(CTGF)、DNA结合物抑制剂(ID)和Cbfa1/Runx2[3]。在脊椎动物中,骨形成通过膜内成骨和软骨内成骨两种方式完成,这两种方式都由BMP直接介导完成,其中,BMP-2和BMP-4在骨形成过程中对间充质细胞的分化起着至关重要的作用[16]。
最早研究的BMP家族成员是BMP-2和BMP-7。腺病毒介导BMP-2体外转染间充质干细胞,使其成骨活性增加,表明BMP-2在成骨细胞分化方面有作用[17-18]。Ad-BMP-2在C3H10T1/2细胞中过表达后,ALP活性、矿化程度及骨特异性蛋白(Ⅰ型胶原、骨调素和骨钙素)mRNA的表达都增高[17]。Partridge等[18]将Ad-BMP-2转染的骨髓骨原细胞植入生物降解高分子支架中,通过检测发现ALP活性、Ⅰ型胶原形成及矿化程度均增加。Ishikawa等[19]体外培养BMSCs过程中给予rhBMP-2干预,细胞增殖能力增强,同时在传代过程中仍保持成骨分化能力。BMP-7也有诱导成骨的能力。Franceschi等[20]通过检测ALP活性和基质矿化程度发现Ad-BMP-7转染C2C12成肌细胞和肌源祖细胞可分化为成骨细胞,最终形成骨。
虽然BMP-2和BMP-7是最早被人鉴定出具有诱导成骨能力的骨形成蛋白,但它们的成骨能力在BMPs中是否最强尚未知晓。随后研究又发现了BMP-4、BMP-6及BMP-9等。Kang等[4]通过重组腺病毒AdEasy系统介导的方法,成功构建了Ad-BMP-2到Ad-BMP-15等14种腺病毒,转染C2C12细胞后结果显示出BMP-2、BMP-6、BMP-7及BMP-9均能在体内诱导骨形成。
研究发现BMP-6在体内外有成骨潜能。Zachos等[21]将Ad-BMP-6导入马BMSCs中发现成骨细胞的ALP活性、基质矿化能力及成骨标记物基因的表达增加。Valdes等[22]进行兔动物实验,发现重组人BMP-6蛋白质能促进兔骨髓骨原细胞的成骨能力。
Aslan等[23]利用电穿孔技术将BMP-9 转染到人骨髓间充质干细胞(hMSCs)中,4周后可观察到骨组织形成,可见BMP-9是一种强有力的骨形成诱导因子。Kimelman-Bleich等[24]通过建立小鼠的骨不连模型,明胶海绵填充骨缺损处,10d后利用BMP-9治疗,可在骨缺损处形成骨桥并修复骨不连。
笔者对面中部牵引的骨缝进行组织学研究,发现在牵引和固定过程中,骨缝宽度逐渐增大,骨缝中出现大量新生血管,骨缝重新进行改建,形成新的骨缝。同时发现,在牵张期,BMP-2表达明显增加,在固定期,BMP-2表达逐渐减少[25]。Liu等[26]将基因重组BMP-2与胶原膜复合后覆盖于受扩张力作用下的顶骨矢状缝上方,可以增强受扩张力作用后顶骨矢状缝组织的成骨作用。Yao等[27]应用缓释技术将BMP-2注射到骨缝牵引区域,骨缝新骨形成加快,骨密度增加。Ashinoff等[28]将携带BMP-2基因的腺病毒注射至切骨牵引骨痂中,经X线、组织学及骨组织量学分析,发现该方法可以加速切骨牵引骨痂新骨形成的速度和质量。笔者目前正在进行BMP-2与机械力是否可以协同促进骨缝成骨的相关研究。
3 经典的BMP信号通路
3.1BMP信号通路中的BMP配体、BMPⅠ型和Ⅱ型受体 TGF-β家族通常有两种不同的受体蛋白,称之为Ⅰ型和Ⅱ型受体。在哺乳动物中Ⅰ型受体包括7种:ALK1、ALK2/ACTRⅠA、ALK3/BMPRⅠA、ALK4/ACTRⅠB、ALK5/TβR1、ALK6/BMPRⅠB、ALK7,而Ⅱ型受体则包含5种:TβRⅡ、ACTRⅡA、ACTRⅡB、BMPRⅡ、AMHRⅡ。目前认为其中只有ALK1、ALK2/ACTRⅠA、ALK3/BMPRⅠA、ALK6/BMPRⅠB、ACTRⅡA、ACTRⅡB和BMPRⅡ可以作为BMP家族的受体[29]。
BMPⅠ型和Ⅱ型受体都是以异二聚体形式存在的跨膜苏氨酸-丝氨酸激酶受体。所有的受体都包括一个位于细胞膜外N末端的配体结合域、一个跨膜区域和一个位于细胞膜内的含丝/苏氨酸激酶的C末端三部分。细胞外配体-受体结合后,信号通路被启动。BMP首先与BMPⅡ型受体结合,Ⅱ型受体细胞内的活性激酶区通过磷酸化Ⅰ型受体的GS区域(Ⅰ型受体细胞内特征性的高度保守的TTSGSGSG序列[2]),随后磷酸化的BMPⅠ型受体再进一步磷酸化Smads蛋白,最终使细胞内Smad(Sma-Mad)等蛋白磷酸化来完成信号转导[30](图1),继而启动并激活成骨细胞特异性转录因子(如 Cbfα1/Runx2、Osterix/Sp7 等),从而诱导MSCs 向成骨细胞分化及骨形成。
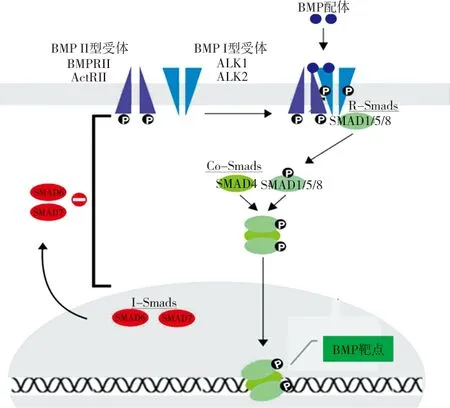
图1 BMP信号转导示意图。BMP配体与BMPⅡ型受体结合,导致BMPⅠ型受体磷酸化,后者趋化R-Smads (Smads 1/5/8)到BMPⅠ型受体周围,激活R-Smads。活化的R-Smads与Co-Smads (Smad 4)形成异聚复合体,进入细胞核,调节基因表达。抑制型Smads(Smads 6/7)从细胞核移出,通过抑制通路上的信号转导负性调节BMP信号通路
3.2BMP-Smad信号通路调节骨再生 BMP与受体结合后会激活Smad依赖型和Smad非依赖型两条信号通路中的一条。为了更好的地理解BMP在骨形成中的作用,笔者在此主要探讨Smad依赖型信号通路。Smads蛋白家族是细胞内的信号转导蛋白,由Mad以及Sma两个相关等位基因编码,目前发现有9个亚型,即Smad1-9[31]。包括3种类型:受体调节型Smad(R-Smad)、共同介质型Smad(Co-Smad)、抑制型Smad(I-Smad)。每一种Smad蛋白对BMP的信号转导都很重要。活化的I型受体直接与R-Smads作用,而Co-Smads与活化的R-Smads形成复合物共同转移至细胞核内调节靶基因转录。抑制型Smads(I-Smads)通过抑制信号通路的几个位点对信号通路发挥负调控作用。
R-Smad蛋白(Smad1、Smad2、Smad3、Smad5、Smad8、Smad9,其中Smad1、Smad5和Smad8与BMP-2信号转导有关)C端功能域末端含有丝氨酸-丝氨酸-任意氨基酸-丝氨酸(Ser-Ser-X-Ser,SSXS)保守序列,沿着该序列,R-Smads在氨基端(N端)和羧基端(C端)末尾有两个同源区域:MH1区和MH2区,这两个区对于信号转导都很重要[2]。MH1区直接与DNA序列结合,而MH2与BMPⅠ型受体结合。此外,MH2区也可以与其他的Smads结合形成聚合体,在转录激活方面发挥作用[3]。一经激活,磷酸化的R-Smad就会脱离BMPⅠ型受体,与Smad4形成复合体。Smad 4是哺乳动物中唯一的Co-Smad,存在于所有的BMP信号通路。R-Smad/Co-Smad异二聚体复合物在细胞核中与各种转录因子、共激活剂和共抑制剂共同调节基因表达。
I-Smads包括Smad6和Smad7,对BMP信号通路发挥负性调控作用。这些I-Smads通常位于细胞核内,经BMP活化后移向细胞质和细胞膜,在BMP信号通路的多个位点上抑制信号转导[1]。Smad7与活化的BMPⅠ型受体结合阻止R-Smads被活化。Smad7也可与E3泛素连接酶蛋白、Smurf1和Smurf2发生作用,促进BMP受体降解。Smad 6发挥作用不同于Smad7,主要与Smad4竞争结合R-Smads来阻止R-Smad/Co-Smad异二聚体复合物形成,从而产生负性调节作用[3]。
4 MSC成骨分化BMP信号通路的调控
分子遗传学研究表明,内源性或外源性BMPs通过结合细胞膜上特异性受体BMP 受体Ⅰ及BMPR-Ⅱ,使 BMPR-Ⅰ磷酸化,再与BMPs特异作用的Smads蛋白(如 Smad1、5、8)结合并使其也发生磷酸化,然后进入细胞核,Smad蛋白的磷酸化导致Runx2和Osterix的上调,这两个转录因子是控制成骨发生过程的关键因子,从而诱导MSCs向成骨细胞分化及骨形成[32]。BMP信号通路受到广泛的多层次调控,以确保其和一些特定的下游反应在适当的时空被激活。BMP基因调控已受到越来越多的关注,主要有细胞外调控、膜调控、细胞内调控。细胞外可以受到BMP蛋白受体激动剂、BMP蛋白拮抗剂以及细胞外基质成分的调节;细胞膜上可以受到仿真受体或BMP共受体(如RGMs)的调控;而在细胞内的调控就相对复杂,可以受DNA结合蛋白、R-Smad/Co-Smad转录的共激活剂和共抑制剂、抑制性Smads(Smad6和Smad7)和其他调控配体蛋白、MicroRNAs调控以及与其他信号通路的交叉调控[33]。
5 MSC成骨分化其他通路的调控
5.1Wnts信号通路 Wnt蛋白通过自分泌或旁分泌方式与位于细胞膜上的Frizzled蛋白和共同受体(LRP5/ LRP5)相结合,将信号传导至细胞质中,细胞质中的β-Catenin转运到细胞核,和转录因子LEF/TCF蛋白通过经典的Wnt/β-Catenin信号通路调节靶基因的表达,进而促进骨的形成[34-35],与BMP-Smads信号通路类似,经典Wnt信号通路在调节成骨细胞分化及骨形成方面最终也是通过作用于Runx2 起作用,但其分子机制还不是很明确。
5.2FGFs信号通路 在成骨细胞中,FGFs信号通过一组高亲和力的有内在酪氨酸激酶活性的跨膜受体(FGFR1、FGFR4)激活MAPK信号通路。这些生长因子信号转导的结果会引起Runx2和/或Osterix的激活。在成骨细胞中,FGFR2和其受体之间的相互作用使受体发生二聚化和自身磷酸化,反过来又激活p42/43 MAPK和蛋白激酶C(PKC)。PKC的激活促进Runx2转录的增加,而磷酸化和激活的p42/43 MAPK则促进Runx2蛋白的磷酸化和激活进而引起成骨细胞特异性基因,如碱性磷酸化和骨钙蛋白表达的增加,引起骨形成的增加[36-37]。
5.3IGF1/ET1信号通路 胰岛素样生长因子(insulin-like growth factors 1,IGF1)和内皮素-1(endothelin 1,ET1)分别结合到受体酪氨酸激酶受体IGF1R和G-蛋白偶联受体ETA上,激活MAPK信号通路进而调节成骨细胞的分化。
5.4Notch信号通路 Notch信号通路主要成员包括Notch受体、配体、CSL蛋白以及Notch信号的效应分子。当Notch受体与相邻细胞表面的配体结合后,Notch信号通路即被激活,此时Notch受体分别在TACE及γ-分泌酶的作用下相继发生两次蛋白水解,释放出Notch受体胞内活性片段 (Notch intracellular domain,NICD),并转移至细胞核内与CSL蛋白(一种DNA 结合蛋白)及其共活化因子MAML结合,从而启动并激活其下游靶基因(如 HES、HEY等)的表达[38]。 目前,Notch 信号通路在调节MSCs 向成骨细胞分化过程中的重要作用,已在多种体内外模型中得到印证[39-40]。此外Notch信号通路还参与调节BMP及Wnt信号诱导的成骨细胞分化及骨形成。Notch信号通路可通过多种途径直接或间接地参与调控成骨细胞分化及骨形成。
5.5Hedgehog信号通路 Hedgehog蛋白是一类分泌型信号蛋白,主要包括3种同源蛋白,即Indian hedgehog(Ihh)、Sonic hedgehog(Shh)及 Desert hedgehog(Dhh)。与其他信号通路类似,Hedgehog 信号通路也是由Hedgehog相应配体(Ihh、Shh、 Dhh)、受体(Patched/Ptc、Smoothened/Smo)及细胞内信号分子(Cos2/Kif7、Fu、Ci/Gli)等组成[41]。当Hedgehog蛋白在细胞膜上与特殊受体Ptc结合时,Smo得以活化,活化的Smo与Cos2、Fu结合形成复合物,从而启动下游靶基因(如 Cyclin D/ E、HIP、Myc 等)的表达。相关研究发现[42],Hedgehog信号通路在调节细胞增殖、分化过程中亦具有十分重要作用。Hedgehog信号通路也可通过间接调控Runx2的表达来调节成骨细胞分化及骨形成等,因而也被视作调控成骨细胞分化及骨形成关键信号通路之一,但其具体调节机制目前还未完全阐明,仍需进一步研究。
以上信号通路之间存在着一定的联系,共同作用从而调节成骨的分化,但是大多数信号通路的确切机制还不明了,各通路之间的相互联系研究较少,还需要进一步深入探讨。
6 展望
近年来,研究者们运用BMP或者相关载体介导BMP基因转导MSCs从而诱导其向成骨分化都取得了进步,但也存在一些问题。首先,无论通过生物材料运载BMP或者载体介导BMP基因转染MSCs植入缺损区域或骨缝区必然会带来一系列宿主免疫反应,目前并未发现完全不产生免疫反应的载体,因此在诱导成骨时应该充分考虑载体选择问题。其次,各种BMP基因和相关协助基因转染进入宿主体内,其造成局部BMP或其他因子蓄积过高,存在基因组序列突变的风险。现有研究证明BMP诱导成骨存在多条信号传导通路,但相关机制尚不清楚,是否能通过直接激活相关通路上的某些信号分子激活并调控成骨,或能否从转录因子调控水平寻找诱导成骨基因治疗可能是未来的研究方向。
综上所述,BMP在诱导MSCs成骨分化方面作用显著,但仍存在着许多未知问题,需要更深入的探讨使其在治疗骨缺损及骨发育异常方面有望展现更好的临床应用前景。
[1] Attisano L,Wrana JL.Signal transduction by the TGF-beta superfamily[J].Science,2002,296(5573):1646-1647.
[2] Shi Y,Massague J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus[J].Cell,2003,113(6):685-700.
[3] Beederman M,Lamplot JD,Guoxin Nan,et al.BMP signaling in mesenchymal stem cell differentiation and bone formation[J].J Biomed Sci Engineering,2013,6(8):32-52.
[4] Kang Q,Sun MH,Cheng H,et al.Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery[J].Gene Ther,2004,11(17):1312-1320.
[5] Luther G,Wagner ER,Zhu G,et al.BMP-9 induced osteogenic differentiation of mesenchymal stem cells: molecular mechanism and therapeutic potential[J].Curr Gene Ther,2011,11(3):229-240.
[6] Shu B,Zhang M,Xie R,et al.BMP2,but not BMP4,is crucial for chondrocyte proliferation and maturation during endochondral bone development[J].J Cell Sci,2011,124(Pt 20):3428-3440.
[7] Estrada KD,Retting KN,Chin AM,et al.Smad6 is essential to limit BMP signaling during cartilage development[J].J Bone Miner Res,2011,26(10):2498-2510.
[8] Wang M,Jin H,Tang D,et al.Smad1 plays an essential role in bone development and postnatal bone formation[J].Osteoarthritis Cartilage,2011,19(6):751-762.
[9] Canalis E,Brunet LJ,Parker K,et al.Conditional inactivation of noggin in the postnatal skeleton causes osteopenia[J].Endocrinology,2012,153(4):1616-1626.
[10] Abdallah BM,Haack-Sorensen M,Burns JS,et al.Maintenance of differentiation potential of human bone marrow mesenchymal stem cells immortalized by human telomerase reverse transcriptase gene despite[corrected]extensive proliferation [J].Biochem Biophys Res Commun,2005,326(3):527-538.
[11] Harada S,Rodan GA.Control of osteoblast function and regulation of bone mass[J].Nature,2003,423(6937):349-355.
[12] Komori T.Regulation of osteoblast differentiation by transcription factors[J].J Cell Biochem,2006,99(5):1233-1239.
[13] Soltanoff CS,Yang S,Chen W,et al.Signaling networks that control the lineage commitment and diff erentiation of bone cells[J].Crit Rev Eukaryot Gene Expr,2009,19(1):1-46.
[14] Bonewald LF,Johnson ML.Osteocytes,mechanosensing and Wnt signaling[J].Bone,2008,42(4):606-615.
[15] Chen GQ,Deng CX,Li YP.TGF-β and BMP signaling in osteoblast diff erentiation and bone formation[J].Int J Biol Sci,2012,8(2):272-288.
[16] Walsh DW,Godson C,Brazil DP,et al.Extracellular BMP antagonist regulation in development and disease:tied up in knots[J].Trends Cell Biol,2010,20(5):244-256.
[17] Cheng SL,Lou J,Wright NM,et al.In vitro and in vivo induction of bone formation using a recombinant adenoviral vector carrying the human BMP-2 gene[J].Calcif Tissue Int,2001,68(2):87-94.
[18] Partridge K,Yang X,Clarke NM,et al.Adenoviral BMP-2 gene transfer in mesenchymal stem cells: in vitro and in vivo bone formation on biodegradable polymer scaffolds[J].Biochem Biophys Res Commun,2002,292(1):144-152.
[19] Ishikawa H,Kitoh H,Sugiura F,et al.The effect of recombinant human bone morphogenetic protein-2 on the osteogenic potential of rat mesenchymal stem cells after several passages[J].Acta Orthop,2007,78(2):285-292.
[20] Franceschi RT,Wang D,Krebsbach PH,et al.Gene therapy for bone formation: in vitro and in vivo osteogenic activity of an adenovirus expressing BMP7[J].J Cell Biochem,2000,78(3):476-486.
[21] Zachos TA,Shields KM,Bertone AL.Gene-mediated osteogenic differentiation of stem cells by bone morphogenetic proteins-2 or -6[J].J Orthop Res,2006,24(6):1279-1291.
[22] Valdes M,Moore DC,Palumbo M,et al.rhBMP-6 stimulated osteoprogenitor cells enhance posterolateral spinal fusion in the New Zealand white rabbit[J].Spine J,2007,7(3):318-325.
[23] Aslan H,Zilberman Y,Arbeli V,et al.Nucleofection-based ex vivo nonviral gene delivery to human stem cells as a platform for tissue regeneration[J].Tissue Eng,2006,12( 4):877 -889.
[24] Kimelman-Bleich N,Pelled G,Zilberman Y,et al.Targeted gene and host progenitor cell therapy for nonunion bone fracture repair[J].Mol Ther,2011,19(1):53-59.
[25] 金增强,马骁,柳春明.犬面中份缝牵引成骨过程中骨形成蛋白-2的表达[J].第二军医大学学报,2007,28(12):1356-1359.
[26] Liu SS,Opperman LA,Buschang PH.Effects of recombinant human bone morphogenetic protein-2 on midsagittal sutural bone formation during expansion[J].Am J Orthod Dentofacial Orthop,2009,136(6):768.e1-8;discussion 768-769.
[27] Yao Y,Wang G,Wang Z,et al.Synergistic enhancement of new bone formation by recombinant human bone morphogenetic protein-2 and osteoprotegerin in trans-sutural distraction osteogenesis: a pilot study in dogs[J].J Oral Maxillofac Surg,2011,69(11):e446-455.
[28] Ashinoff RL,Cetrulo CL Jr,Galiano RD,et al.Bone morphogenic protein-2 gene therapy for mandibular distraction osteogenesis[J].Ann Plast Surg,2004,52(6):585-590; discussion 591.
[29] 赵志伟,赵志杰.BMP及其共受体RGM家族信号通路的研究进展[J].四川解剖学杂志,2012,20(3):38-45.
[30] Hill CS.Nucleocytoplasmic shuttling of Smad proteins[J].Cell Res,2009,19(1):36-46.
[31] 於绍龙,刘丹平.成骨因子BMP-2/Smads/Runx2信号转导通路[J].辽宁医学报学报,2014,35(5):94-96.
[32] Tachi K,Takami M,Sato H,et al.Enhancement of bone morphogenetic protein-2-induced ectopic bone formation by transforming growth factor-β1[J].Tissue Eng Part A,2010,17(5-6):597-606.
[33] 吴礼杨,贝抗胜.骨形成蛋白信号转导及调控中国组织工程研究[J].2012 ,16(2):331-335
[34] Monroe DG,McGee-Lawrence ME,Oursler MJ,et al.Update on Wnt signaling in bone cell biology and bone disease[J].Gene,2012,492(1):1-18.
[35] Liu W,Konermann A,Guo T,et al.Canonical Wnt signaling differently modulates osteogenic differentiation of mesenchymal stem cells derived from bone marrow and from periodontal ligament under inflammatory conditions[J].Biochim Biophys Acta,2014,1840(3):1125-1134.
[36] Marie PJ,Miraoui H,Sévère N.FGF/FGFR signaling in bone formation:progress and perspectives[J].Growth Factors,2012,30(2):117-123.
[37] Fei Y,Xiao L,Doetschman T,et al.Fibroblast growth factor 2 stimulation of osteoblast differentiation and bone formation is mediated by modulation of the Wnt signaling pathway[J].J Biol Chem,2011,286(47):40575-40583.
[38] Mead TJ,Yutzey KE.Notch signaling and the developing skeleton//Notch Signaling in Embryology and Cancer[M].New York:Springer Verlag New York Inc,2012:114-130.
[39] Ugarte F,Ryser M,Thieme S,et al.Notch signaling enhances osteogenic diff erentiation while inhibiting adipogenesis in primary human bone marrow stromal cells[J].Exp Hematol,2009,37(7):867-875.
[40] Zanotti S,Smerdel-Ramoya A,Stadmeyer L,et al.Notch inhibits osteoblast diff erentiation and causes osteopenia[J].Endocrinology,2008,149(8):3890-3899.
[41] Beachy PA,Hymowitz SG,Lazarus RA,et al.Interactions between Hedgehog proteins and their binding partners come into view[J].Genes Dev,2010,24(18):2001-2012.
[42] Fontaine C,Cousin W,Plaisant M,et al.Hedgehog signaling alters adipocyte maturation of human mesenchymal stem cells[J].Stem Cells,2008,26(4):1037-1046.
