五福饮对大鼠退变椎间盘聚蛋白聚糖与Ⅱ型胶原表达的影响*
2018-03-14夏炳江侯明生胡松峰
夏炳江 侯明生 张 磊 胡松峰 王 宁
(1.浙江省绍兴市中医院,浙江 绍兴 312000;2.浙江中医药大学,浙江 杭州 310053)
椎间盘退变(IDD)被认为是引起下腰痛的主要原因[1],严重影响人们的生活与工作。椎间盘作为人体最大的无血管组织,营养供应和物质代谢有其独有的特点,加上所要承受的特殊生物力学作用,使其成为人体内最早发生退变的组织之一[2]。传统中医药治疗椎间盘退变性疾病多从肾虚、血瘀及风寒湿外袭等立论,采用滋补肝肾、祛风散寒、活血化瘀、蠲痹通络等方法[3-4],但总体疗效有待于进一步提高。课题组前期通过对中医理论、文献、临床等方面进行研究,认为椎间盘退变性疾病的主要病机为“本虚标实,五脏气血虚损为本,痰浊瘀血为标”,治疗当以“五脏气血同补”为主。五福饮源于明代名医张景岳,由人参、熟地黄、当归、白术、炙甘草组成,为“五脏气血同补”的经典代表方[5]。课题组应用五福饮加减治疗椎间盘退变性疾病,包括颈椎病、盘源性腰痛等,其疗效在临床实践中已得到了初步肯定,但其现代医学作用机制尚不明确。故本实验拟利用SD大鼠椎间盘退变模型,研究五福饮对椎间盘退变的防治作用及其对椎间盘聚蛋白聚糖与Ⅱ型胶原表达影响,以期阐明其防治椎间盘退变的可能作用机制,为临床应用提供实验室依据。现报告如下。
1 材料与方法
1.1 实验动物
选取48只12周龄的清洁级Sprague-Dawley(SD)大鼠作为实验动物,体质量(220±20)g,浙江中医药大学实验动物中心提供 (实验动物号:SYXK-浙-2008-0115)。所有大鼠均饲养在屏障环境内,每笼饲养6只,饲养室室温控制在(20±2)℃,自由进食进水。
1.2 主要仪器与试剂
DEPC水 (由北京康为世纪生物科技提供),Trizol提取液 (由上海生工提供),反转录试剂盒 (由大连TAKARA提供),定量试剂盒(由大连TAKARA提供),PCR所需引物合成(由上海生工提供),荧光定量PCR仪(由美国ABI提供),核酸分光光度计(NanoDrop2000C,由Thermo scientific公司提供),Micro-CT成像 (Bruker Microct NV)。
1.3 分组与造模方法
SD大鼠适应性喂养1周后,按随机分组设计原则,将48只大鼠随机分成3组,即空白对照组、退变模型组、五福饮干预组,每组16只。退变模型组与五福饮干预组SD大鼠行尾椎间盘退变造模,造模方法参照文献[6],即通过针刺损伤尾 5/6椎间盘(Co5/6)纤维环结合椎间盘内注射肿瘤坏死因子-α(TNF-α)诱发炎症的方法构建尾椎间盘退变模型。造模后4周,每组随机选取8只大鼠,通过造模椎间盘进行影像学、组织病理学及分子生物学检测,以明确造模是否成功。试验中所有SD大鼠在造模前均不存在先天性尾椎畸形及椎间盘退变等病理改变(影像学证实)。在试验过程中,无大鼠意外死亡。造模后4周,退变模型组与五福饮干预组大鼠Co5/6椎间隙相对高度下降,HE染色显示退变椎间盘表现,聚蛋白聚糖及Ⅱ型胶原mRNA表达水平降低,表明造模成功。
1.4 干预方法
五福饮组成:人参、熟地黄、当归、白术、炙甘草。制备方法:本研究中的五福饮药液采用水提法制备,将以上 5 味中药饮片按 2∶3∶3∶2∶1 的比例混合,蒸馏水浸泡1 h,加入12倍量的水回流提取3次,每次1.5 h。水提物减压浓缩至相对密度为1.05,再加入95%乙醇至含醇量为60%,醇沉24 h,回收含药乙醇,减压浓缩至2 g/mL,-20℃保存备用。造模成功后各组开始进行药物干预。五福饮干预组大鼠采用灌胃方式给药(2 mL/100 g),空白对照组及退变模型组大鼠予以相应体积生理盐水灌胃,每日1次,共8周。
1.5 标本采集及检测
1.5.1 Micro-CT扫描及椎间盘相对高度测量 应用Micro-CT 扫描(扫描电压:55 kV;扫描电流:455 μA;扫描曝光时间:250 ms)大鼠Co5/6椎间盘及其两侧椎体,扫描完成后,收集数据,应用相应配套图像处理软件进行三维重建及结果分析。参考文献[7]方法测量Co5/6椎间盘相对高度:取前后位3D重建图像,测量椎间盘宽度四等分位点两侧相邻椎体及椎间盘高度,取其平均值。计算椎间盘高度指数(DHI)=椎间盘高度平均值/椎体高度平均值。平均椎间盘高度的变化表示为DHI百分比的变化。
1.5.2 椎间盘组织病理学 完整切取大鼠Co5/6椎间盘及其两侧部分椎体,4%多聚甲醛固定,48 h后利用14%EDTA脱钙液脱钙4周,常规脱水、石蜡包埋、连续切片,HE染色。光镜下观察椎间盘组织形态学改变。
1.5.3 椎间盘聚蛋白聚糖及Ⅱ型胶原mRNA表达水平检测 将大鼠Co5/6椎间盘完整取下,加入液氮冷冻后,迅速将其研磨成粉。加入Trizol液,采用一步法提取总RNA,检测提取mRNA的浓度。根据反转录试剂盒及相关引物使用说明书,加入相应剂量试剂进行PCR扩增。试验所需引物序列见表1。每个样本均重复测量2次,取其平均值。

表1 RT-PCR引物序列
1.6 统计学处理
2 结 果
2.1 各组大鼠Co5/6椎间盘DHI比较
见表2。Micro-CT扫描显示,造模后,大鼠Co5/6椎间隙高度降低,同时伴有两侧椎体不同程度骨赘增生。治疗后,五福饮干预组大鼠Co5/6椎间盘相对高度与空白对照组比较,仍有下降(P<0.05),但较退变模型组大鼠升高(P<0.05)。
2.2 各组大鼠Co5/6椎间盘形态学比较
见图1。空白对照组显示大致正常的椎间盘组织。退变模型组显示明显退变的椎间盘组织。五福饮干预组显示轻度退变的椎间盘组织。造模4周后,大鼠Co5/6椎间盘HE染色显示明显退变特征,包括髓核细胞排列紊乱、数量减少,外周纤维环排列紊乱、有裂隙。灌服五福饮8周后,大鼠Co5/6椎间盘HE染色虽亦表现出退变特征,但较退变模型组大鼠有所改善,可见较多排列尚均匀的髓核细胞,外周纤维环排列尚规律,裂隙少见。退变模型组大鼠在造模后12周时,表现出更明显的椎间盘退变特征,即髓核细胞明显减少,外周纤维环出现明显的裂隙及断裂。
表2 各组大鼠Co5/6椎间盘DHI比较(%,±s)
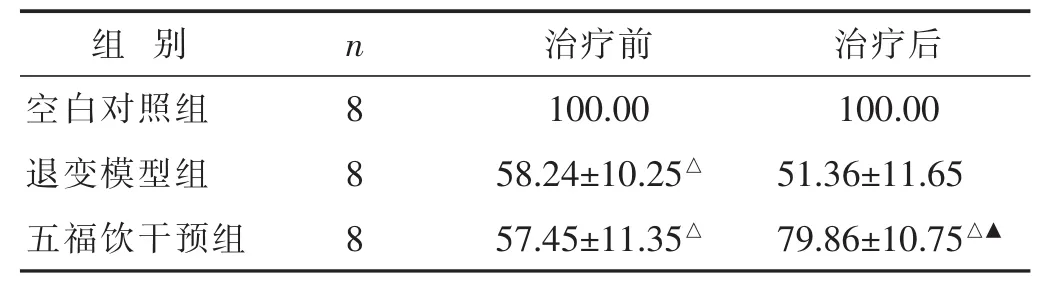
表2 各组大鼠Co5/6椎间盘DHI比较(%,±s)
与空白对照组同时期比较,△P<0.05;与退变模型组同时期比较,▲P<0.05。 下同。
空白对照组 8100.00 100.00退变模型组 858.24±10.25△ 51.36±11.65五福饮干预组 8 57.45±11.35△ 79.86±10.75△▲
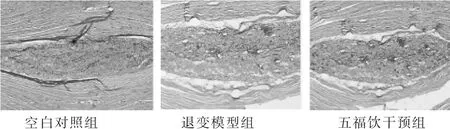
图1 各组大鼠造模4周后椎间盘结果(HE染色,50倍)
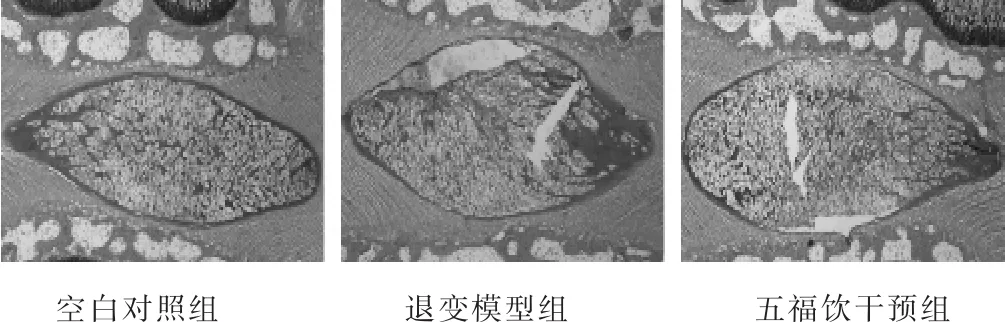
图2 各组大鼠给药8周后椎间盘结果(HE染色,50倍)
2.3 各组大鼠Co5/6椎间盘聚蛋白聚糖及Ⅱ型胶原mRNA表达水平比较
见表3。治疗前退变模型组及五福饮干预组大鼠Co5/6椎间盘聚蛋白聚糖及Ⅱ型胶原mRNA较空白对照组大鼠均有明显下降P<0.05)。治疗后,五福饮干预组大鼠Co5/6椎间盘聚蛋白聚糖及Ⅱ型胶原mRNA,与退变模型组比较,均有明显提高(P<0.05)。
表3 各组大鼠Co5/6椎间盘蛋白聚糖及Ⅱ型胶原mRNA表达比较(±s)

表3 各组大鼠Co5/6椎间盘蛋白聚糖及Ⅱ型胶原mRNA表达比较(±s)
组 别 时 间 聚蛋白聚糖 Ⅱ型胶原空白对照组 治疗前 1.12±0.27 1.20±0.10(n=8) 治疗后 1.30±0.34 1.18±0.08退变模型组 治疗前 0.70±0.04△ 0.71±0.06△(n=8) 治疗后 0.63±0.06△ 0.52±0.08△五福饮干预组 治疗前 0.67±0.05△ 0.64±0.06△(n=8) 治疗后 1.06±0.09△▲ 0.90±0.08△▲
3 讨 论
在治疗椎间盘退变及其相关疾病过程中,中医学积累了丰富的经验。课题组前期通过对中医理论、文献、临床等方面进行研究,认为五脏气血亏虚为其内在病理基础,五脏气血亏虚,气化无力,津液与血运行失常,聚而成痰、成瘀;而痰瘀内停,可使经脉痹阻,因虚致实,因实致虚,虚实夹杂构成椎间盘退变性疾病本虚标实的病理过程。根据上述病因病机,课题组认为椎间盘退变性疾病治则当以“五脏气血同补”为主。
五福饮处方来源于 《景岳全书·卷五十》,由人参(入心)、熟地黄(入肾)、当归(入肝)、白术(入肺)、炙甘草(入脾)组成,主治五脏气血亏损,是张景岳治疗“五脏气血虚损”的经典代表方[8]。目前为止,关于五福饮研究的现代文献报道较少,少量文献表明其具有免疫调节、抗肿瘤及抗衰老等作用[5,8]。 目前,尚末见有报道五福饮抗椎间盘退变的文献,但通过文献分析,笔者可以发现组成该方的5味中药对细胞外基质均有一定的调控作用[9-13],因此笔者推测五福饮复方可能通过调控椎间盘细胞外基质起到预防椎间盘退变的作用。
本实验研究结果表明,五福饮灌服8周后,大鼠造模椎间隙相对高度及组织学退变均有明显改善,五福饮组大鼠与灌服生理盐水组大鼠相比较,椎间盘聚蛋白聚糖与Ⅱ型胶原mRNA表达均有明显提高,故笔者认为提高聚蛋白聚糖和Ⅱ型胶原表达可能是五福饮防治椎间盘退变的作用机制。
椎间盘的细胞外基质中富含蛋白多糖和胶原蛋白[14-16],其对维持椎间盘组织的水含量、渗透压及张应力等起重要作用[17-18]。已有研究证实,椎间盘退变与细胞外基质合成及分解代谢失去平衡有关,而分解代谢亢进在椎间盘退变病理过程中发挥更为关键的作用[19-20]。聚蛋白聚糖是椎间盘蛋白多糖中最主要的一种[21]。聚蛋白聚糖主要分布在髓核组织中,其能吸附水分子而维持组织的水含量及静水压,以利于发挥分散负荷,缓冲震荡的生理功能。当髓核组织中聚蛋白聚糖减少时,以髓核为主的椎间盘基质吸附水分子能力下降,基质黏弹性下降,力学性能逐渐丧失,最终导致椎间盘退变发生[22]。Ⅱ型胶原蛋白亦是椎间盘发挥其功能的主要成分[18],Ⅱ型胶原富含羟赖氨酸残基,能使蛋白多糖和水分子聚集并联接成网,抵抗蛋白多糖及水分子所产生的张力[23]。随着椎间盘退变,胶原类型与数量发生转变,Ⅱ型胶原的含量逐渐减少,该变化与椎间盘退变程度呈正相关[24]。
综上所述,在“五脏气血同补”基本治则的指导下,应用五福饮可有效防治大鼠椎间盘退变,提高聚蛋白聚糖与Ⅱ型胶原表达可能是其作用机制。
[1]Freemont AJ.The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain[J].Rheumatology,2009,48(1):5-10.
[2]黄吉军,邵增务,熊蠡茗.细胞老化与椎间盘退变[J].国际骨科学杂志,2009,30(4):226-228.
[3]莫伟,许金海,叶洁,等.腰椎间盘突出症中医治疗方法的研究进展[J].中国中医急症,2016,25(3):474-476.
[4]王小平.论《内经》确立五脏概念的文化基础[J].中华中医药学刊,2013,31(6):1227-1229.
[5]张红玉,杨锋,王波波,等.五福饮增强化疗药抗肿瘤作用及保护骨髓造血功能的实验研究[J].浙江中医药大学学报,2014,38(6):682-685.
[6]夏炳江,张磊,胡松峰,等.纤维环穿刺结合TNF-α注射构建大鼠尾椎间盘退变模型的实验研究[J].中国中医急症,2017,26(7):1150-1154.
[7]Keorochana G,Johnson JS,Taghavi CE,et al.The effect of needle size inducing degeneration in the rat caudal disc:evaluation using radiograph,magnetic resonance imaging,histology, and immunohistochemistry[J].Spine J,2010,10(11):1014-1023.
[8]庞浩,刘祥准.五福饮对柔道运动员抗疲劳效果的研究[J].中医临床研究,2014,6(34):1-3,6.
[9]谢席胜,刘衡川,樊均明,等.人参皂甙Rbl对转化生长因子-β1诱导的肾小管上皮细胞p47phox的表达及细胞外基质的影响[J].四川大学学报:医学版,2009,40(1):106-110.
[10]李广波,秦娜,林瑞霞,等.地黄提取物对多柔比星肾病大鼠肾脏的保护作用机制[J].实用儿科临床杂志,2010,25(23):1815-1818.
[11]王艳琴.当归多糖对肺纤维化大鼠肺功能、细胞外基质及病理形态学的影响[D].兰州:兰州大学,2010.
[12]王郁金,苏衍进,郑广娟.白术挥发油对小鼠H22肝癌淋巴道转移模型的影响[J].现代中医药,2009,29(4):74-75.
[13]宁士龙.RECK蛋白在异甘草素抑制乳腺癌细胞侵袭转移中的作用[D].南京:南京医科大学,2016.
[14]Marchand F,Ahmed AM.Investigation of the laminate structure of lumbar disc anulus fibrosus[J].Spine,1990,15(5):402-410.
[15]Lotz JC.Mechanobiology of the intervertebral disc[J].Biochem Soc Trans,2002,30(6):853-858.
[16]Ahsan R.Biochemical and morphological changes in herniated human intervertebral disc[J].J Orthop Sci,2001,6(6):510-508.
[17]Watanabe,H,Y.Yamada,and K.Kimata, Roles of aggrecan,a large chondroitin sulfate proteoglycan,in cartilage structure and function[J].J Biochem,1998,124(4):687-693.
[18]Scott JE.Proteoglycan: collagen interactions and subfibrillar structure in collagen fibrils.Implications in the development and ageing of connective tissues [J].J Anat,1990,169:23-35.
[19]Urban MR.Intervertebral disc composition in neuromuscular scoliosis:changes in cell density and glycosaminoglycan concentration at the curve apex[J].Spine,2001, 26(6):610-617.
[20]Roberts S.1991 Volvo Award in basic sciences.Collagen types around the cells of the intervertebral disc and cartilage end plate: an immunolocalization study[J].Spine,1991,16(9):1030-1038.
[21]Luo W,Guo C,zheng J,et a1.Aggrecan from start to finish[J].J Bone Miner Metab,2000,18(2):51-56.
[22]熊晓芊,邵增务,杨述华.聚集蛋白聚糖与椎间盘退变的研究进展[J].中国脊柱脊髓杂志,2005,15(1):54-57.
[23]Bradford DS,CooperKM,Oegema TR.Chymopapain,chemonucleolysis, and nucleus pulposus regeneration[J].J Bone Joint Surg Am,1983,65(9):1220-1231.
[24]Takegami K,An HS,Kumano F,et al.Osteogenic protein-1 is most effective in stimulating nucleus pulposus an annulus fibrosus cells to repair their matrix after chondroitinase ABC-induced in vitro chemonucleolysis[J].Spine J,2005,5(3):231-238.
