哮喘模型大鼠肺组织中IL-4、IFN-γ的变化及防哮方的干预作用*
2018-03-14杨晨羲宣桂琪阮晓琳周星星
杨晨羲 宣桂琪 阮晓琳 周星星 陈 健△
(1.浙江中医药大学,浙江 杭州 310053;2.浙江中医药大学附属第一医院,浙江 杭州310006)
第3次中国城市儿童哮喘流行病学调查显示2010年全国城市14岁以下儿童哮喘的累积患病率为3.02%,严重影响我国青少年的身心健康,防治儿童哮喘是儿科疾病的重点和难点[1-2]。前期临床实践证明临床经验方防哮方治疗缓解期哮喘儿童有良好疗效,相关实验研究证实防哮方可改善哮喘大鼠气道重塑,抑制ERKl/2 mRNA及P-ERKl/2蛋白的表达[3]。本实验以细胞因子白细胞介素-4(IL-4)、干扰素-γ(IFN-γ)为切入点,观察防哮方对哮喘大鼠Th1/Th2型细胞因子水平的影响,探讨其能否在改善Th1/Th2失衡方面发挥作用。现报告如下。
1 材料与方法
1.1 实验动物 清洁级6周龄SD大鼠,雄性,48只,体质量180~200 g。由中科院上海斯莱克实验动物有限公司提供,许可证号:SCXK(沪)2012-0002。饲养于浙江中医药大学动物实验研究中心屏障环境中,许可证号:SYXK(浙)2008-0116。
1.2 试药与仪器 中药复方防哮方(南沙参6 g,北沙参 6 g,麦冬 9 g,地骨皮 3 g,生石决明 10 g,生白芍6 g,党参 6 g,茯苓 10 g,白术 6 g,姜半夏 6 g,陈皮 5 g)购于浙江中医药大学第一附属医院中药房。中药制剂煎煮浓缩至生药质量浓度0.5 g/mL(低)、1 g/mL(中)、2 g/mL(高)3个质量浓度的药汁。醋酸地塞米松片(7.5 mg/片,购自浙江仙琚制药股份有限公司,批号:1410202)。 卵白蛋白(OVA):美国 Sigma公司。超纯RNA提取试剂、RT-PCR试剂盒、反转录试剂盒、5x RNA Loading Buffe: 大连 TaKaRa 公司。 IL-4、IFN-γ mRNA引物及β-actin引物由上海生工生物工程有限公司合成,详见表1。PTC-200型PCR仪、iQ5型实时荧光定量PCR仪:美国Bio-Rad公司。
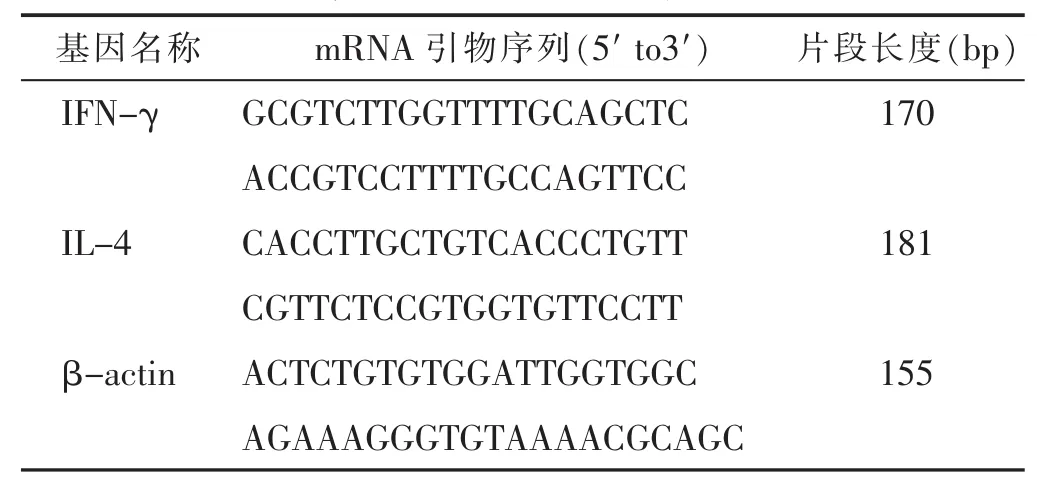
表1 大鼠相关引物序列
1.3 造模与分组 按照随机数字表法将实验动物分为正常组、模型组及中药低、中、高剂量组及地塞米松组共6组,每组8只。参照文献调整改进,制备哮喘大鼠模型,致敏、激发阶段:除正常组外,其余各组大鼠分别于实验的第1、8日在腹腔、前后腿内侧4点各注射0.2 mL OVA致敏。第15日开始,于自制的简易雾化箱中用泵雾化器以一定浓度的OVA 0.9%氯化钠注射液雾化激发,每次30 min,隔日1次,共持续8周。激发浓度第1、2周按1%,第3、4周按1.5%,第5、6周按2%,第7、8周按2.5%。正常组予等量的0.9%氯化钠注射液雾化吸入。以呼吸急促、呛咳烦躁、四肢搔抓及轻度紫绀等哮喘症状出现为激发成功[4]。第9周起给药,参考体表面积法[5],大鼠等效给药量(g/kg)=6.25×成人给药量(g/kg)。中药低、中、高剂量组给药剂量按等效给药量的 0.5 倍、1 倍、2 倍,具体为 4 g/(kg·d)、8 g/(kg·d)、16 g/(kg·d);正常组及模型组以等量0.9%氯化钠注射液代替中药灌胃;地塞米松组则予地塞米松0.75 mg/(kg·d)灌胃,上述灌胃均每日1次,连续2周。
1.4 标本采集及检测 标本留取:末次给药后24 h予10%水合氯醛8 mL/kg腹腔麻醉处死大鼠,开胸暴露左、右肺脏。左肺用磷酸缓冲溶液(PBS)灌洗支气管肺泡,参照文献[6]收集肺泡灌洗液(BALF),离心后-4℃冰箱保存。右肺剪取部分组织,用PBS洗净,润干,冻存备用,用于RT-PCR检测。BALF分类计数及指标检测:BALF中加1 mL PBS液重悬,混匀,取50 μL回收液,并用2%白细胞(WBC)稀释液进行60倍稀释。取10 μL稀释液在显微镜下观察并用血球计数板对WBC总数进行计数。取适量回收液制备细胞涂片,采用吉姆萨染色,高倍显微镜下计数,并计算嗜酸粒细胞(EOS)百分比。RT-PCR 法检测 IL-4、IFN-γ mRNA 表达,严格按TaKaRa逆转录试剂盒操作方法进行反转录。按照2-△△CT相对定量计算公式,计算出各样品的目的基因相对定量结果。
1.5 统计学处理 应用SPSS19.0统计软件。数据均以(±s)表示,采用方差分析(ANOVA),方差齐性则采用LSD法,方差不齐则采用Tamhane′s T2法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠BALF中WBC总数及EOS百分率比较见表2。与正常组比较,模型组WBC总数、EOS百分率均明显升高(P<0.05);与模型组比,各中药组及地塞米松组WBC总数、EOS百分率明显减少(P<0.05);与地塞米松组相比较,中药低、中剂量组WBC总数、EOS百分率较高(P<0.05),但中药高剂量组差别不明显(P >0.05)。
表2 各组大鼠BALF中WBC总数和EOS百分率比较(±s)
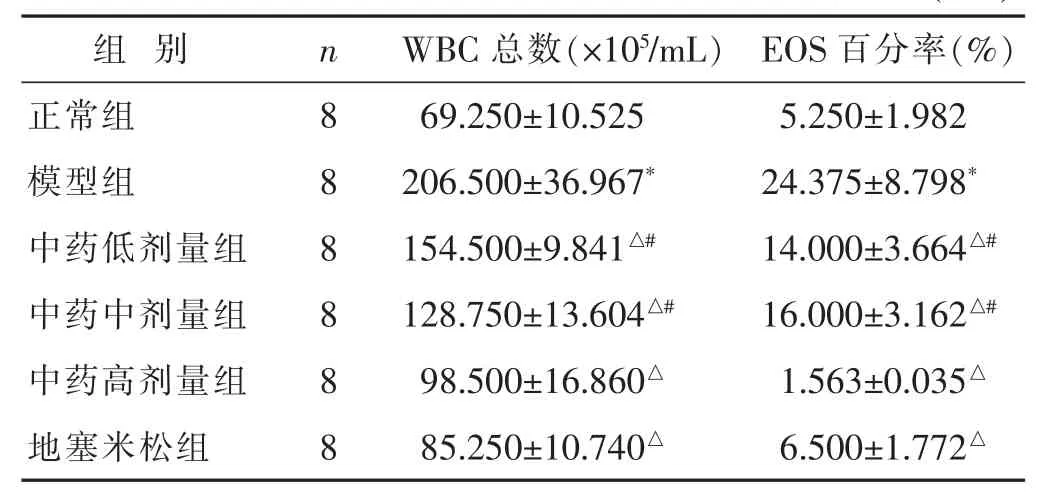
表2 各组大鼠BALF中WBC总数和EOS百分率比较(±s)
与正常组比较,*P<0.05;与模型组比较,△P<0.05;与地塞米松组比较,#P<0.05。 下同。
组 别 n WBC总数(×105/mL) EOS百分率(%)正常组 8 69.250±10.525 5.250±1.982模型组 8 206.500±36.967* 24.375±8.798*中药低剂量组 8 154.500±9.841△# 14.000±3.664△#中药中剂量组 8 128.750±13.604△# 16.000±3.162△#中药高剂量组 8 98.500±16.860△ 1.563±0.035△地塞米松组 8 85.250±10.740△ 6.500±1.772△
2.2 各组大鼠肺组织IL-4、IFN-γ水平表达比较 见表3。与正常组相比,模型组IL-4水平升高、IFN-γ水平降低(均P<0.05);与模型组相比,各中药组及地塞米松组IL-4水平明显降低、IFN-γ水平明显升高 (均P<0.05),中药低、中、高剂量组与地塞米松组变化趋近;中药高剂量组与地塞米松组相比,IL-4水平较高(P<0.05),IFN-γ 水平变化不明显(P>0.05)。
表3 各组大鼠肺组织中IL-4及IFN-γ mRNA的相对表达量比较(±s)

表3 各组大鼠肺组织中IL-4及IFN-γ mRNA的相对表达量比较(±s)
组 别 n IL-4 mRNA(2-△△CT) IFN-γ mRNA(2-△△CT)正常组 8 1.027±0.039 1.028±0.032模型组 8 2.316±0.086* 0.626±0.027中药低剂量组 8 2.107±0.044△# 0.730±0.013△#中药中剂量组 8 1.929±0.043△# 0.834±0.018△#中药高剂量组 8 1.563±0.035△# 0.945±0.026△地塞米松组 8 1.217±0.022△ 0.946±0.088△
3 讨 论
防哮方是全国老中医药专家、浙江省名中医、本文第二作者宣桂琪教授治疗儿童哮喘缓解期的经验方。他认为小儿“阳常有余、阴常不足”,结合小儿“肺、脾、肾常不足,肝常有余”的生理特点,哮喘患儿以体虚肝旺的体质较多,哮喘缓解期多以气阴两虚分型[7-8]。本方由生脉散和六君子汤划裁而成,方中南、北沙参养阴清肺,润燥生津,麦冬养胃阴以生肺阴;合六君子汤,益气健脾,燥湿化痰,乃培土生金之法;白芍配石决明养肝阴平肝柔肝,佐以地骨皮滋阴清热,防木火刑金而肺热难清[9-10]。全方肺脾肝三脏同调,以益气健脾,养阴止咳为主,并佐以平肝柔肝之品,以图调整患儿脾虚肝旺的体质,宣教授临床多用此方辨证加减,可明显减少哮喘发作次数,改善患儿体质。
气道慢性炎症和气道重塑是支气管哮喘的主要病理特征,研究表明免疫功能紊乱在哮喘发病机制中起着重要作用,其中Th1、Th2比例及功能失衡,具体表现为Th1细胞功能下降,Th2细胞功能亢进,是哮喘形成和发展的重要环节和始动因素[11-12]。Th1细胞主要介导细胞免疫,IFN-γ被认为是其特征性的主要细胞因子。IFN-γ具有调节EOS活化、分化和募集的作用,可以下调EOS趋化因子受体的表达,抑制EOS浸润作用[13]。IFN-γ还能抑制IL-4对B细胞的走向调节,从而抑制IgE生成。Th2主要参与B细胞增殖、抗体产生及速发型的超敏反应,其分泌的IL-4在Th细胞分化过程中能调控单核细胞释放细胞因子,从而促进Th2的发育分化,刺激B细胞产生及释放IgE,促进肥大细胞活化,募集与活化EOS,从而导致气道炎症、气道高反应及气道重塑[14-15]。高志刚相关临床研究提示哮喘患儿血清中高水平的IL-4可以促进小儿哮喘气道高反应性形成[16]。在哮喘的发病过程中,Th1/Th2平衡被打破,免疫反应倾向Th2,使Th1型细胞因子(IFN-γ)分泌减少,Th2 型细胞因子(IL-4)分泌增多。
本实验研究发现,模型组IL-4水平、WBC总数及EOS百分率较正常组明显升高,说明哮喘模型大鼠激活Th2细胞,促进IL-4及炎症细胞释放增多。模型组IFN-γ水平较正常组明显减少,说明哮喘模型大鼠Th1细胞功能下降,IFN-γ分泌减少。与模型组比,各中药组及地塞米松组IL-4水平、WBC总数及EOS百分率明显下降,说明各治疗组均能下调IL-4及炎症细胞的表达,抑制Th2细胞功能。与模型组比,各中药组及地塞米松组IFN-γ水平明显升高,说明各治疗组均能促进Th1细胞功能,上调IFN-γ表达。其中中药高剂量组WBC总数、EOS百分率及IFN-γ水平与地塞米松组相比无明显差异,说明中药高剂量组与地塞米松组在调节Th1/Th2细胞因子,改善气道炎症方面作用相当。综上所述,防哮方通过对IFN-γ/IL-4细胞因子的调节,上调IFN-γ水平,下调IL-4水平,从而调节Th1/Th2免疫紊乱,有利于改善气道炎症,其在防治哮喘方面发挥的作用可能与此有关。但其具体机制仍不明确,需要进一步深入研究。
[1]全国儿科哮喘防治协作组.第3次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51(10):729-735.
[2]陈强,代佳佳.儿童支气管哮喘诊断和治疗的热点问题[J].中国当代儿科杂志,2013,15(8):601-603.
[3]周星星,徐贤达,阮晓琳,等.中药气阴双补对缓解期哮喘模型大鼠气道重塑及ERK信号分子表达的影响[J].浙江中西医结合杂志,2016,26(4):317-321.
[4]刘中成,张艳芬.一种大鼠慢性哮喘模型的建立与评价[J].药学学报,2010,45(6):718-723.
[5]魏伟,吴希美,李元建.药理实验方法学[M].4版.北京:人民卫生出版社,2010:1698.
[6]史菲,邱晨.大鼠支气管肺泡灌洗术标准化操作的探讨[J].中国现代医学杂志,2011,29(3):473-474.
[7]李岚,陈华,陈健,等.太子健Ⅱ方对儿童哮喘慢性持续期免疫功能及气道慢性炎症的影响[J].中医杂志,2012,53(23):2011-2013.
[8]王晓鸣,罗荣泉.儿科心悟[M].杭州:浙江科学技术出版社,2011:16-18.
[9]王瑞萍,唐方.唐方治疗小儿咳嗽临证经验[J].辽宁中医杂志,2010(7):1227-1228.
[10]阮晓琳,周星星,彭来君,等.气阴双补中药对哮喘大鼠肺组织TGF-β1及Smad2/3表达的影响[J].中华中医药杂志,2017(3):1271-1275.
[11]Nader MA.Inhibition of airway inflammation and remodeling by sitagliptin in murine chronic asthma[J].International Immunopharmacology,2015,29(2):761-769.
[12]Carneiro ER,Xavier RAN,Castro MAPD,et al.Electroacupuncture promotes a decrease in inflammatory response associated with Th1/Th2 cytokines,nitric oxide and leukotriene B4 modulation in experimental asthma[J].Cytokine,2010,50(3):335-340.
[13]Kim CK,Choi J,Callaway Z,et al.Increases in airway eosinophilia and a Th1 cytokine during the chronic asymptomatic phase of asthma [J].Respiratory Medicine,2010,104(10):1436-1443.
[14]May RD,Fung M.Strategies targeting the IL-4/IL-13 axes in disease[J].Cytokine,2015,75(1):89-116.
[15]Moldaver DM,Larché M,Rudulier CD.An update on lymphocyte subtypes in asthma and airway disease[J].Chest,2017,151(5):1122-1130.
[16]高志刚,袁永红,詹建华.沙丁胺醇气雾剂联合硫酸镁对小儿哮喘 IL-2、IL-4、IL-5、IFN-γ 及 T淋巴细胞亚群的影响[J].中国生化药物杂志,2015,35(8):110-113.
