国产与进口紫杉醇抗肿瘤疗效和安全性的系统评价Δ
2018-03-14林志强蔡文杰林燕芳洪珊珊
周 虹,林志强,蔡文杰,林燕芳,洪珊珊
(1.福建医科大学附属泉州第一医院药剂科,福建 泉州362000; 2.福建医科大学附属泉州第一医院放疗科,福建 泉州 362000)
紫杉醇属于植物类抗肿瘤药,作用机制是通过促进细胞微管蛋白聚合和防止其解聚,进而抑制肿瘤细胞的快速分裂导致其死亡[1],在临床上被用于卵巢癌[2-3]、宫颈癌[4]、乳腺癌[5]、非小细胞肺癌[6]和胃癌[7]等肿瘤的治疗。紫杉醇注射剂型有国产与进口之分,两者价格相差巨大。目前,国产与进口紫杉醇在不同肿瘤中的疗效已有大量报道,其临床疗效及不良反应的研究结果不尽相同。为了进一步明确国产与进口紫杉醇注射剂型抗肿瘤的有效性和安全性,本研究采用文献荟萃(Meta)分析方法对其进行系统评价,以期为紫杉醇的临床应用提供循证医学证据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型:已发表的随机对照试验(randomized controlled trial,RCT),语种仅限英文和中文。
1.1.2 研究对象:临床诊断为恶性肿瘤的患者;年龄不限;Karnofsky评分≥70分;有可评价的病灶;无化疗禁忌证;肝肾功能、血尿常规及心电图等基本正常。
1.1.3 干预措施:观察组采用国产紫杉醇(药品来源为国产,厂家不限),对照组采用进口紫杉醇(药品来源为进口,厂家不限);紫杉醇剂型为注射剂。
1.1.4 结局指标:总有效率和药品不良反应。总有效率=完全缓解率+部分缓解率;疗效评定按照世界卫生组织《实体瘤疗效评定标准》;药品不良反应分级参考国际肿瘤化疗药物不良反应评价系统所使用的《通用不良反应术语标准4.0版》[8]。
1.1.5 排除标准:非RCT;重复报道的研究;会议摘要、病例报道及期刊目录等非研究性文献;数据不全且无法获取最终数据的研究。
1.2 文献检索策略
检索Pubmed、Cochrane Library、Embase、中国生物医学文献数据库、万方数据库、中国期刊全文数据库及中文科技期刊全文数据库等数据库,检索年限均为建库至2016年12月。中文检索词包括“紫杉醇”“泰素”“安素泰”“国产”和“进口”等;英文检索词包括“Paclitaxel”“domestic”和“imported”等。
1.3 资料提取与方法学质量评价
由2名研究者独立按照纳入与排除标准筛选文献和提取数据,并进行方法学质量评价,如遇到分歧,通过讨论或由第3名研究者协助裁定。质量评价工具参照Cochrane协作网推荐的RCT的偏倚风险评估,包括随机方法、分配隐藏、盲法、结果数据的完整性、选择性报告研究结果和其他偏倚来源[9]。
1.4 统计学方法
采用RevMan 5.2软件进行Meta分析。各研究结果间的异质性采用χ2检验结合I2定量分析,当各研究间无统计学异质性(P>0.10,I2<50%),采用固定效应模型;反之,则采用随机效应模型。分类变量采用RR表示效应量。采用倒漏斗图评估发表偏倚。
2 结果
2.1 文献检索结果及纳入文献的基本特征
根据中英文检索词查找出相关文献184篇;剔重及阅读文献摘要进行初筛,排除不相关内容等,剩余62篇;根据纳入与排除标准,阅读全文后复筛,最终纳入11篇文献[10-20]。共665例患者,其中观察组359例,对照组306例。纳入文献的基本特征见表1。

表 1 纳入文献的基本特征Tab 1 Basic characteristics of involved studies
2.2 纳入文献的方法学质量评价
纳入分析的11篇文献中,仅3篇[12,15,18]提及了随机分组,但未对随机方法作具体说明;所有文献的分配隐藏、盲法及其他偏倚来源均不清楚;所有研究结果数据均完整,见表2。

表2 纳入文献的方法学质量评价Tab 2 Methodological quality evaluation on involved literatures
2.3 Meta分析结果
2.3.1 总有效率:10篇文献[10-19]报告了总有效率,共569例患者。各研究间无统计学异质性(P=0.93,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组患者总有效率的差异无统计学意义(RR=1,95%CI=0.9~1.10,P=0.96),见图1。其中,5篇文献[10,12,14,17-18]报告了治疗卵巢癌的总有效率,共223例患者。各研究间无统计学异质性(P=0.72,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组卵巢癌患者总有效率的差异无统计学意义(RR=0.96,95%CI=0.85~1.10,P=0.59),见图2。2篇文献[16,19]报告了治疗非小细胞肺癌的总有效率,共70例患者。各研究间无统计学异质性(P=0.50,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组非小细胞肺癌患者总有效率的差异无统计学意义(RR=1,95%CI=0.56~1.78,P=1.00),见图2。

图1 两组患者总有效率比较的Meta分析森林图Fig 1 Forest plot of Meta analysis on the comparison of total effective rate between two groups

图2 两组卵巢癌、非小细胞肺癌患者总有效率比较的Meta分析森林图Fig 2 Forest plot of Meta analysis on the comparison of total effective rate in ovarian cancer and non-small cell lung cancer between two groups
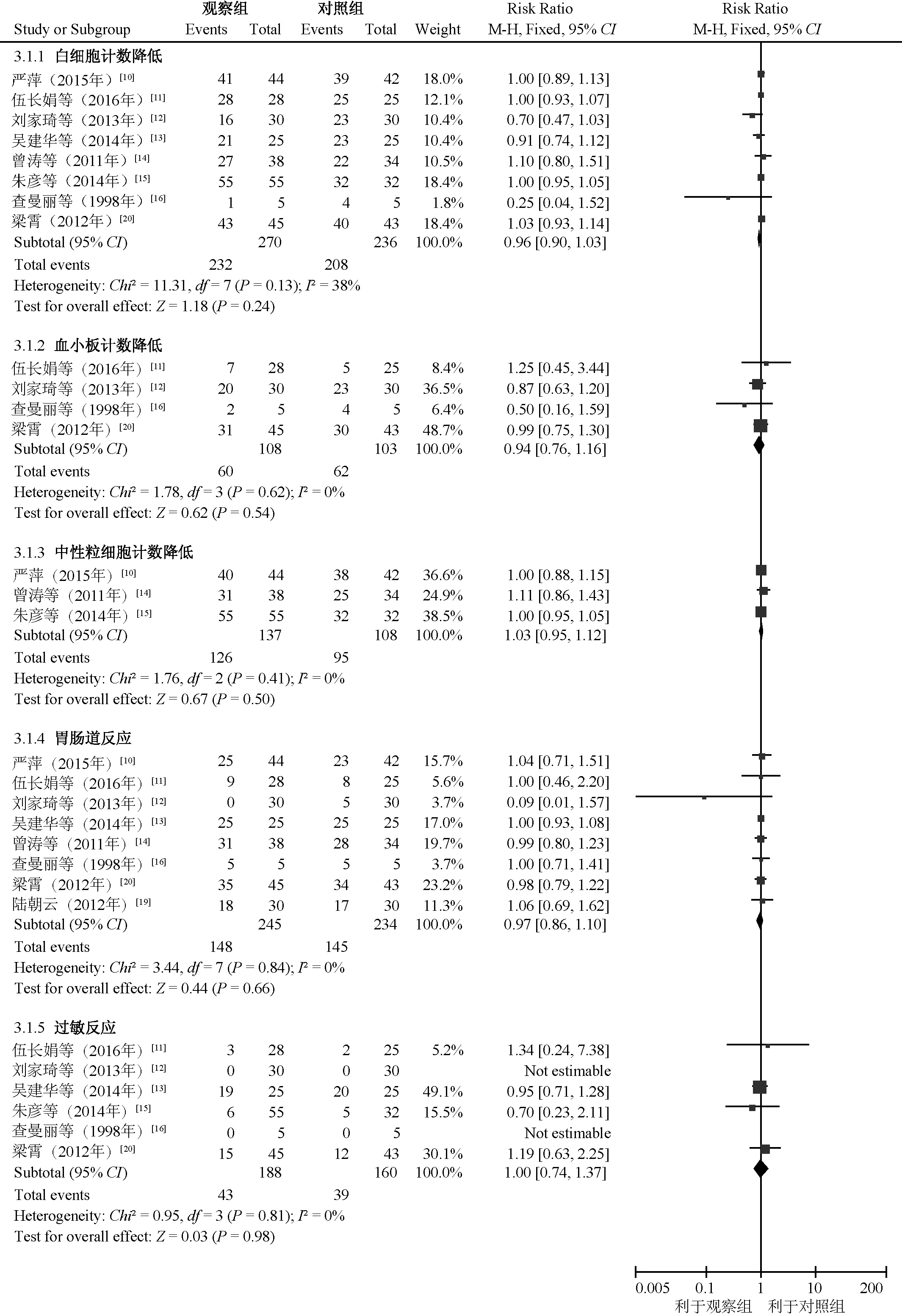
图3 两组患者不良反应发生率比较的Meta分析森林图Fig 3 Forest plot of Meta analysis on the comparison of incidence of adverse drug reactions between two groups
2.3.2 不良反应:11篇文献[10-20]均报告了不良反应,主要包括血液系统(白细胞计数降低、血小板计数降低及中性粒细胞计数降低等)、胃肠道反应(恶心、呕吐)、过敏反应、肌肉或关节疼痛和脱发等。根据不良反应类型对白细胞计数降低、血小板计数降低、中性粒细胞计数降低、胃肠道反应和过敏反应进行亚组分析,结果显示,两组患者上述不良反应发生率的差异均无统计学意义,见图3。
2.4 发表偏倚评估
针对总有效率绘制倒漏斗图,结果显示,图形左右两边基本对称,且大部分集中在倒漏斗的顶端,说明所纳入研究存在发表偏倚的可能性较低,见图4。

图4 总有效率的倒漏斗图Fig 4 Inverted funnel plot of total effective rate
3 讨论
临床使用的紫杉醇剂型有注射剂、脂质体和白蛋白紫杉醇。紫杉醇注射剂型品种繁多,进口药品有紫杉醇注射液(安素泰)、紫杉醇注射液(泰素),国产药品有几十种,不同厂家的药品价格相差多达几十倍。但临床医师对国产药品的疗效和安全性存在疑虑,故本研究选取紫杉醇注射剂型为研究对象,对国产药品与进口药品抗肿瘤疗效和不良反应进行系统评价。
对于妇科肿瘤特别是卵巢癌,紫杉醇与卡铂的联合应用为1类推荐方案[2-3],故相关研究报道较多;紫杉醇联合顺铂是晚期非小细胞肺癌一线化疗的可选方案之一[6]。本系统评价中,国产紫杉醇组、进口紫杉醇组患者总有效率的差异无统计学意义;对卵巢癌和非小细胞肺癌进行亚组分析,也未见两组患者的总有效率存在统计学差异。紫杉醇常见的不良反应为骨髓抑制、胃肠道反应、过敏反应和脱发等,本研究中,两组患者上述不良反应发生率的差异无统计学意义。
本系统评价的局限性:共纳入11个研究,仅3个研究提及随机分组,但均未描述具体的随机方法;所有研究的分配隐藏和盲法未不清楚,也可能产生选择性偏倚和实施偏倚;且纳入的研究均来自中文文献,可能与国产药物疗效多发表在中文期刊有关,故可能存在发表偏倚;纳入研究的方法学质量均较低,尚需高质量的研究证据进一步证实。
[1]Symmans WF,Volm MD,Shapiro RL,et al.Paclitaxel-induced apop-tosis and mitotic arrest assessed by serial fine-needle aspiration: im-plications for early prediction of breast cancer response to neo-adjuvant treatment[J].Clin Cancer Res,2000,6(12):4610-4617.
[2]Parmar MK,Ledermann JA,Colombo N,et al.Paclitaxel plus plati-num-based chemotherapy versus conventional platinum-based chem-otherapy in women with relapsed ovarian cancer:the ICON4/AGO-OVAR-2.2 trial[J].Lancet,2003,361(9375):2099-2106.
[3]Katsumata N,Yasuda M,Takahashi F,et al.Dose-dense paclitaxel once a week in combination with carboplatin every 3 weeks for adva-nced ovarian cancer:a phase 3,open-label,randomised controlled trial[J].Lancet,2009,374(9698):1331-1338.
[4]Kitagawa R,Katsumata N,Shibata T,et al.Paclitaxel Plus Carboplatin Versus Paclitaxel Plus Cisplatin in Metastatic or Recu-rrent Cervical Cancer:The Open-Label Randomized Phase Ⅲ Trial JCOG0505[J].J Clin Oncol,2015,33(19):2129-2135.
[5]Aksoy S,Dizdar O,Altundag K.Weekly paclitaxel in the adjuvant treatment of breast cancer[J].N Engl J Med,2008,359(3):310;author reply 310-311.
[6]Ohe Y,Ohashi Y,Kubota K,et al.Randomized phase Ⅲ study of cisp-latin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer: Four-Arm Cooperative Study in Japan[J].Ann Oncol,2007,18(2):317-323.
[7]Hironaka S,Ueda S,Yasui H,et al.Randomized,open-label,phase Ⅲ study comparing irinotecan with paclitaxel in patients with adv-anced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus plat-inum:WJOG 4007 trial[J].J Clin Oncol,2013,31(35):4438-4444.
[8]皋文君,刘砚燕,袁长蓉.国际肿瘤化疗药物不良反应评价系统——通用不良反应术语标准4.0版[J].肿瘤,2012,32(2):142-144.
[9]Higgins JP,Green S.Cochrane Handbook For Systematic Reviews of Interventions Version 5.0.0[J].Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie,2008,5(2):S38.
[10] 严萍.国产和进口紫杉醇在卵巢癌患者化疗中的疗效对比[J].医药前沿,2015,5(34):37.
[11] 伍长娟,汤天生,卢今.国产与进口紫杉醇治疗晚期乳腺癌疗效和药物经济学分析[J].承德医学院学报,2016,33(1):14-16.
[12] 刘家琦,韩晟.国产与进口TC方案抗肿瘤药在卵巢癌化疗中的成本效果分析[J].中国药物经济学,2013(2):16-18.
[13] 吴建华,梁国华,凌志琴,等.国产与进口紫杉醇注射液的抗肿瘤疗效及安全性比较研究[J].中国当代医药,2014,21(22):84-86.
[14] 曾涛,杨振宇,章蕴毅.进口与国产紫杉醇治疗卵巢恶性肿瘤的疗效和药物经济学评价[J].中国临床药学杂志,2011,20(5):266-270.
[15] 朱彦,李从铸,周莉,等.进口紫杉醇和国产紫杉醇联合顺铂治疗早期宫颈癌的疗效和药物经济学评价[J].肿瘤学杂志,2014,20(11):962-964.
[16] 查曼丽,施毅,夏锡荣,等.紫杉醇加顺铂治疗非小细胞肺癌临床观察[J].医师进修杂志,1998,21(1):28-29.
[17] 种轶文,韩劲松.进口紫杉醇与国产紫杉醇治疗上皮性卵巢癌的临床疗效分析[J].中国医药,2013,8(6):829-831.
[18] 耿京,崔恒,魏丽惠,等.TP、PTP及CAP化疗方案治疗上皮性卵巢癌的比较[J].中国妇产科临床杂志,2001,2(5):283-285.
[19] 陆朝云.国产与进口紫杉醇治疗晚期非小细胞肺癌的疗效对比[J].中国药业,2012,21(19):101-102.
[20] 梁霄.国产与进口紫杉醇不良反应的分析比效[J].中国现代药物应用,2012,6(22):82-83.
