不同形貌二氧化锰活化过一硫酸盐降解水中罗丹明B的研究
2018-03-13吴光锐侯亚璐王帅军赵朝成
吴光锐,侯亚璐,王帅军,董 培,赵朝成
(1.中国石油大学(华东)化学工程学院,山东 青岛 266580; 2.石油石化污染物控制与处理国家重点实验室)
罗丹明B(Rh B)广泛用于染料行业,是环境中的一种重要污染物。通常认为Rh B具有致癌性,而且在环境中难降解、存在时间长和毒性大[1-2]。降解环境中的Rh B具有重要的环保意义。传统的生物处理难以高效地降解水中的Rh B,因此目前包括光催化[3-5]、臭氧化技术[6]、芬顿[7-9]、类芬顿[10-11]、电芬顿[12-13]等的高级氧化技术广泛用于Rh B的降解。
近年来基于活化过一硫酸盐(PMS)产生硫酸根自由基的高级氧化技术已经广泛用于水中有机污染物的降解[14-15]。与羟基自由基相类似,硫酸根自由基也是一种具有高氧化-还原电位(E0=2.5~3.1 V)的氧化剂。硫酸根自由基一般通过加热、紫外光照射、超声和过渡金属离子活化PMS或者过硫酸盐(PS)产生。其中过渡金属离子活化是较为有效的一种活化方式,也是研究较多的一种。过渡金属钴[16-18]一般被认为可以高效地活化PMS产生硫酸根自由基,但是钴离子在活化PMS的过程中易浸出,钴离子排放到环境中容易造成二次污染,因此,寻找能高效活化PMS的过渡金属是新型高级氧化技术的一个重要课题。
锰氧化物在地壳中储量十分丰富,且具有多种氧化物的形式,如MnO,MnO2,Mn2O3,Mn3O4。锰的价态从+2价到+4价,锰氧化物在氧化晶格方面具有很好的氧化移动性,因此可以引发许多氧化-还原反应。目前锰氧化物已经广泛用于催化[19]、能量储存电极[20-21]和超级电容器[22-23]。锰氧化物与钴氧化物相比具有低毒性的优点,且活性高。根据这些特性,锰氧化物可以替代钴氧化物活化PMS产生硫酸根自由基氧化降解水中的有机污染物。目前,锰氧化物活化PMS产生硫酸根自由基的机理尚不明确,需要进一步探究。
近年来,一维(1D)纳米材料由于其独特的物理和化学性能,已引起广泛的关注,形貌有纳米棒状、纳米管状、纳米线状和纳米纤维状。Cetinkaya等[24]利用Mn2O3和β-MnO2在微波水热条件下合成了1Dα-MnO2。1D纳米材料由于其形貌和结构,相比无特定形貌的材料在某方面具有更好的性能,Su等[25]利用水热合成方法制备了纳米棒状的α-MnO2和β-MnO2,并考察了其作为钠离子电池正电极的性能,发现β-MnO2作为电极材料具有更高的电容,因为β-MnO2相比α-MnO2具有更为紧凑的坑道结构。
目前活化PMS降解Rh B的文献报道较多,而关于金属氧化物直接活化PMS降解水中有机污染物的文献较少。在本研究中,利用简单方法合成纳米棒状MnO2、纳米线状MnO2和一种无特定形貌的α-MnO2,对3种催化剂活化PMS降解水中Rh B的效果进行对比,并探究其降解过程的机理。
1 实 验
1.1 材 料
高锰酸钾(99.8%)、盐酸(37.0%)、一水合硫酸锰、过硫酸铵、甲醇、叔丁醇、硫酸、氢氧化钠、Rh B(99.0%),购于国药集团化学试剂有限公司;PMS(2KHSO5·KHSO4·K2SO4),购于上海阿拉丁生化科技股份有限公司(中国上海);去离子水。所有试剂在应用时没有进一步净化。
1.2 催化剂制备
1.2.1纳米棒状MnO2的制备将2.8 mmol高锰酸钾溶于80 mL的去离子水中,搅拌10 min,然后将0.027 mmol盐酸(HCl质量分数为37.0%)慢慢滴入,形成前躯体溶液,再搅拌20 min,形成均质溶液,转移到反应釜中,密封,在140 ℃下烘烤12 h,冷却至室温,真空过滤,用去离子水清洗3次,在60 ℃下干燥12 h。
1.2.2纳米线状MnO2的制备将1.2 mmol一水合硫酸锰和3.2 mmol高锰酸钾溶于80 mL去离子水中,在室温条件下磁力搅拌20 min,形成均质溶液,转移到反应釜中,密封,在140 ℃下烘烤12 h,冷却至室温,真空过滤,用去离子水清洗3次,在60 ℃下干燥12 h。
1.2.3无特定形貌α-MnO2的制备将0.008 mmol一水合硫酸锰和0.008 mmol过硫酸铵在室温下溶于60 mL去离子水中,形成均质溶液,转移到反应釜中,密封,在120 ℃下烘烤12 h,冷却至室温,反应完成后生成黑色固体,真空过滤,用去离子水清洗3次,在120 ℃下干燥8 h。
1.3 催化剂表征
样品的物相分析采用荷兰X’Pert Pro Holland 型多晶粉末 X-射线衍射仪,测试条件为 Cu Kα靶(40 kV,40 mA);样品的孔结构分析采用美国麦克公司生产的 ASAP2010吸附分析仪,N2吸附-脱附法测定;样品的形貌表征采用透射电镜(TEM 2010,JEOL,Japan)和扫描电镜(SEM,JSM 6700F,JEOL Japan);样品的BET比表面积和孔径分布利用微粒学三星3000吸附分析仪测定;样品的组成及其表面的化学状态采用英国Kratos公司生产的PHI 5000型X 射线光电子能谱仪测定。
1.4 PMS活化和Rh B催化氧化
Rh B的降解试验在150 mL的暗反应器中进行。将100 mL浓度为10 mgL的Rh B溶液加入到150 mL的暗反应器中,伴有连续的机械搅拌,搅拌速率为400 rmin,暗反应器连接水浴锅,保持试验温度为25 ℃;向Rh B溶液中加入0.2 gL的催化剂,机械搅拌30 min,达到吸附解吸平衡;再向溶液中加入0.3 gL的PMS,每隔一定时间使用0.45 μm孔径的针头过滤器取样,利用分光光度计测定Rh B的浓度。每次用针头过滤器取样时,取2 mL的溶液,再吸入1 mL的甲醇溶液,用于熄灭硫酸根自由基和羟基自由基,避免实验误差。Rh B吸光度测定采用北京普析通用仪器有限公司生产的 TU-1901双光束紫外-可见分光光度计,在波长552 nm的条件下测定,得到表征Rh B溶液浓度的标准曲线。本研究使用溶液中Rh B的残留值与原浓度的比值(C/C0)作为分析指标。其中,C为取样测定时Rh B浓度,C0为Rh B初始浓度。
为了催化剂的循环利用,反应结束后,过滤出催化剂,用去离子水清洗催化剂,去除有机污染物和降解过程中生成的中间产物。在70 ℃下用真空干燥箱干燥12 h,备用。
2 结果与讨论
2.1 催化剂表征
图1为3种纳米结构MnO2的XRD图谱。2θ为12.8°,18.1°,28.8°,37.5°,49.9°,60.3°处分别对应(110),(200),(310),(211),(411),(521)晶面的衍射峰。从图1可以看出:利用水热合成法合成的3种MnO2具有很好的结晶度;此外,谱图中没有杂峰出现,表明合成的MnO2较为纯净。合成 MnO2的具体反应如下[26-27]:

(1)

(2)

图1 3种纳米结构MnO2的XRD图谱 —α-MnO2; —线状MnO2; —棒状MnO2
通过扫描电镜和透射电镜可以看出样品的形貌特征和晶格间距。图2为3种MnO2的SEM和TEM照片。图2(a)中的MnO2呈统一的棒状,长度为1~2 μm;图2(b)中的MnO2呈线状,长度为5~6 μm,直径为40~50 nm,线状MnO2的长径比比棒状MnO2大得多;图2(c)为无特定形貌的α-MnO2,通过扫描电镜和透射电镜均看不出特殊的形貌结构。

图2 3种MnO2的(左侧)和TEM(右侧)照片
通过N2吸附-脱附分析样品的孔径分布、比表面积和孔道性质,图3为棒状和线状MnO2的N2吸附-脱附等温线。从图3可以看出,棒状和线状MnO2有着Ⅳ类等温线,带有H3磁滞回线,表明这两种催化剂是介孔结构[28]。两种MnO2的比表面积分别为32.57 m2/g和17.79 m2/g,线状MnO2的比表面积比棒状MnO2的大。表明尽管这两种1D催化剂有相似的结晶结构,但由于前躯体不同,两者具有不同的比表面积;棒状和线状MnO2在相对压力0.80~0.95的范围内有较窄的磁滞回线,二者的比表面积均较小。

图3 棒状和线状MnO2的N2吸附-脱附等温线■—线状MnO2吸附; ●—线状MnO2脱附; ▲—棒状MnO2吸附; 棒状MnO2脱附
2.2 Rh B的氧化降解
在Rh B浓度为10 mg/L、PMS浓度为0.3 g/L、催化剂浓度为0.2 g/L、反应温度为25 ℃的条件下,Rh B在不同催化剂作用下的降解情况见图4。从图4可以看出:单独的线状MnO2、棒状MnO2和无特定形貌α-MnO2的吸附能力均较弱,这与催化剂的比表面积较小有关;在反应20 min时,线状MnO2、棒状MnO2和α-MnO2分别与PMS的组合降解Rh B的降解率分别为91%,84%,73%,线状MnO2的催化活性高于棒状MnO2和无特定形貌α-MnO2,这是因为线状MnO2催化剂的比表面积较大,能在更短的时间内接触并活化更多的PMS分子,产生更多的硫酸根自由基,对Rh B的降解速率相对峰快;单独的PMS降解Rh B的降解率只有38%,这是因为没有活化物质活化的结果;3种催化剂中无特定形貌α-MnO2的活化效率最低,可能与α-MnO2没有特殊的结构,没有较大的比表面积有关。

图4 Rh B在不同催化剂作用下的降解情况■—线状MnO2; ●—棒状MnO2; ▲—α-MnO2; 线状MnO2+PMS; ◆—棒状MnO2+PMS; ;
2.3 不同因素对Rh B氧化降解的影响
2.3.1RhB浓度在PMS浓度为0.3 gL、催化剂浓度为0.2 gL、反应温度为25 ℃的条件下,Rh B质量分数(10,20,30,40 μgg)对线状MnO2活化PMS降解水中Rh B的影响见图5。从图5可以看出:随Rh B浓度的升高,Rh B降解完全的时间会延长;在Rh B质量分数分别为10,20,30 μgg的条件下,线状MnO2对Rh B的降解率高于90%的完成时间分别为20,30,50 min;当Rh B质量分数为40 μgg时,水中Rh B降解率达到90%时需要的时间大于60 min。随Rh B质量分数的升高,需要更多的硫酸根自由基氧化降解Rh B,也就需要催化剂花费更长的时间来活化PMS分子。

图5 不同Rh B浓度下的Rh B降解情况Rh B质量分数, μgg:■—10; ●—20; ▲—30;
2.3.2PMS浓度在Rh B浓度为10 mgL、催化剂浓度为0.2 gL、反应温度为25 ℃的条件下,考察PMS浓度(0.1,0.2,0.3,0.5 gL)对线状MnO2降解水中Rh B的影响,结果见图6。从图6可以看出,在PMS浓度0.1~0.5 gL范围内PMS浓度越高,水中Rh B降解完全的时间越短,基本降解完全需要的时间分别为10,20,35,60 min。PMS的浓度越高,在水中就能存在更多的PMS分子与催化剂接触,就能产生更高浓度的硫酸根自由基,水中的Rh B降解越快。PMS本身作为能产生高氧化还原电位的硫酸根自由基的氧化物,在没有催化剂的条件下,自身就能使溶液中的有机污染物褪色。催化剂的添加大大增加了产生硫酸根自由基的速率。
2.3.3催化剂浓度在Rh B浓度为10 mgL、PMS浓度为0.3 gL、反应温度为25 ℃的条件下,考察线状MnO2催化剂不同浓度下的Rh B降解情况,结果见图7。从图7可以看出,催化剂浓度对Rh B降解的影响较大。催化剂的浓度越高,水中Rh B降解完全的时间就越短,因为催化剂的浓度高,与水中PMS接触的表面积就越大,能把溶液中的PMS分子迅速活化,在较短的时间内产生更多的硫酸根自由基。在不同催化剂浓度条件下Rh B基本降解完全所需的时间分别为20,25,40,60 min。较佳的催化剂浓度为0.3 gL。

图7 不同催化剂浓度下的Rh B降解情况催化剂浓度,gL:■—0.05; ●—0.1; ▲—0.2;
2.3.4温度在一定范围内较高的温度能使PMS产生更多的硫酸根自由基。加温一般作为催化剂活化PMS的辅助手段。在Rh B浓度为10 mgL、PMS浓度为0.3 gL、催化剂浓度为0.2 gL的条件下,考察温度对线状MnO2降解水中Rh B的影响,结果见图8。从图8可以看出,在25,30,35 ℃下反应20 min,水中Rh B的降解率分别为91%,93%,95%。PMS中的O—O键吸收足够的热量,就会断裂产生硫酸根自由基。温度越高,O—O键断裂所需的时间就越短,此试验证实了催化剂活化PMS降解水中有机污染物是吸热的过程。

图8 不同温度下的Rh B降解情况温度,℃:■—25; ●—30; ▲—35
2.3.5pH金属氧化物表面电荷的正负性依赖于溶液pH与金属氧化物零点电荷(pHpzc)之间的关系[29],当pH小于pHpzc时,金属氧化物的表面为正电荷;反之,为负电荷。在Rh B浓度为10 mgL、PMS浓度为0.3 gL、催化剂浓度为0.2 gL、温度为25 ℃的条件下,考察溶液pH对线状MnO2活化PMS降解水中Rh B的影响,结果见图9。从图9可以看出:在溶液pH分别为12和2 时,Rh B的降解率分别只有22%和39%;在pH分别为10和4 时,Rh B的降解率分别为74%和65%。在强酸和强碱条件下,水中Rh B的降解速率小于在中性、弱碱性和弱酸性的水环境中,所以线状的MnO2可用于中性的染料废水,不需要添加强碱或者强酸来调节溶液的pH。PMS在酸性和中性的条件下以的形式存在,在pH大于9.5时以的形式存在于水溶液中。pHpzc一般为7.6,当溶液的pH为9.5时,金属氧化物表面电荷为负,与溶液中间的作用由于排斥力而减弱,这一原因导致了Rh B的降解率在pH从8到12范围内的降低,此外PMS的不稳定性和分解的原因也导致了Rh B降解率的降低。在MnO2PMS体系内,在溶液pH从8到2的范围内,Rh B的降解率也在降低,这主要是静电因素起作用。此外在酸性环境中,H+与中O—O间的氢键作用使中的正电荷减少[30],阻碍了与催化剂表面的联系,这也是在酸性条件下Rh B降解率低的原因。
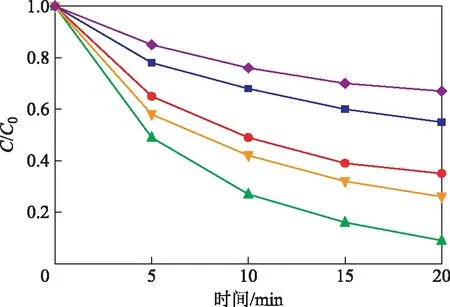
图9 不同溶液pH下的Rh B降解情况pH:■—2; ●—4; ▲—8; ; ◆—12
2.4 催化剂的循环利用
为了进一步研究线状MnO2的性质,进行了重复性试验,每次使用后,过滤出催化剂,用去离子水清洗干净,在真空干燥箱中干燥,使催化剂恢复活性[31]。反应条件为:Rh B浓度10 mgL,PMS浓度0.3 gL,催化剂浓度0.2 gL,温度25 ℃。从图10可以看出:随催化剂使用次数的增加,降解效率下降,在重复利用1、2次时,水中Rh B完全降解所需的时间大约为30 min,降解效率下降不明显;在重复利用第3次时,Rh B降解率明显下降。可能是因为催化剂在活化PMS产生硫酸根自由基降解水中Rh B的过程中,锰离子会浸出并流失。随着锰离子的浸出,催化剂的活性下降,也可能是水中Rh B的降解中间产物吸附在线状MnO2的表面,用去离子水过滤的方式无法洗净,阻碍了水中PMS分子与线状MnO2的进一步接触。重复利用试验表明线状MnO2有较好的可重复利用性。
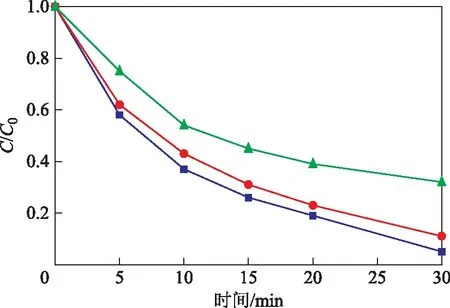
图10 线状MnO2的重复利用性重复利用次数:■—1; ●—2; ▲—3
2.5 机理探究
为了研究线状MnO2活化PMS降解水中Rh B的机理,采用叔丁醇作为水中羟基自由基的消除剂,甲醇作为硫酸根自由基和羟基自由基的消除剂。文献[32]报道甲醇与硫酸根自由基和羟基自由基的反应速率常数分别为(1.6~7.7)×107mol(L·s)和(1.2~2.8)×109mol(L·s)。叔丁醇可以快速地消除水中的羟基自由基,叔丁醇与羟基自由基和硫酸根自由基的反应速率常数分别为(3.8~7.6)×108mol(L·s)和(4.0~9.1)×105mol(L·s)。图11为自由基消除试验结果,反应条件为:Rh B浓度10 mgL,PMS浓度0.3 gL,催化剂浓度0.2 gL,叔丁醇浓度0.2 molL,甲醇浓度0.2 molL,温度25 ℃。

图11 自由基消除试验结果自由基消除剂:■—无; ●—叔丁醇; ▲—甲醇
从图11可以看出:加入一定量的甲醇时,水中Rh B的降解率在22%以内;而加入一定量的叔丁醇时,水中Rh B的降解率超过77%。说明主要氧化水中Rh B的自由基是硫酸根自由基。结合文献[33]提出降解机理如下所示:

(3)

(4)

(5)
(6)

(7)

(8)
(9)
(10)

4 结 论
经过水热合成法合成的线状MnO2和棒状MnO2具有特殊形貌,与无特定形貌的α-MnO2相比,在同样的条件下具有特殊形貌的MnO2表现出较高的催化活性,表明具有特殊形貌和结构的催化剂具有独特的性质。对比3种催化剂的活性,线状MnO2的催化活性最高。水中Rh B降解的最佳条件为:Rh B浓度10 μgg,PMS 浓度0.5 gL,线状MnO2浓度0.3 gL,温度35 ℃,pH=8。线状MnO2重复利用试验结果表明,线状MnO2具有很好的重复利用性,锰离子浸出度不高。机理试验结果表明,起到氧化降解水中RhB的自由基既有羟基自由基也有硫酸根自由基,但起主要作用的是硫酸根自由基。
[1] Luo Lei,Zhang Anfeng,Janik M J,et al. Inorganic salt-assisted fabrication of graphitic carbon nitride with enhanced photocatalytic degradation of Rhodamine B[J]. Materials Letters,2017,188:130-133
[2] Feng Weihua,Fang Jianzhang,Zhang Lanxin,et al. Plasmonic metallic Bi deposited Bi12SiO20crystals with rich oxygen vacancies for enhanced photocatalytic degradation of RhB and 2,4-DCP[J]. Materials Research Bulletin,2017,94:45-53
[3] Feng Yangshi,Niu Chenggang,Huang Dawei,et al. SrTiO3nanocubes decorated with AgAgCl nanoparticles as photocatalysts with enhanced visible-light photocatalytic activity towards the degradation of dyes,phenol and bisphenol A[J]. Environmental Science:Nano,2017,4(3):585-595
[4] Li Tingting,Zhao Leihong,He Yiming,et al. Synthesis of g-C3N4SmVO4composite photocatalyst with improved visible light photocatalytic activities in Rh B degradation[J]. Applied Catalysis B:Environmental,2013,129:255-263
[5] Hong Yuanzhi,Jiang Yinhua,Li Changsheng,et al. In-situ synthesis of direct solid-state Z-scheme V2O5g-C3N4heterojunctions with enhanced visible light efficiency in photocatalytic degradation of pollutants[J]. Applied Catalysis B:Environmental,2016,180:663-673
[6] Li Xinyang,Liu Guicheng,Shi Mei,et al. A novel electro-catalytic ozonation process for treating Rhodamine B using mesoflower-structured TiO2-coated porous titanium gas diffuser anode [J]. Separation and Purification Technology,2016,165:154-159
[7] Guo Sheng,Yuan Na,Zhang Gaoke,et al. Graphene modified iron sludge derived from homogeneous Fenton process as an efficient heterogeneous Fenton catalyst for degradation of organic pollutants[J]. Microporous and Mesoporous Materials,2017,238:62-68
[8] Guo Sheng,Zhang Gaoke,Jimmy C Y. Enhanced photo-Fenton degradation of Rhodamine B using graphene oxide-amorphous FePO4as effective and stable heterogeneous catalyst [J]. Journal of Colloid and Interface science,2015,448:460-466
[9] Li Xuning,Wang Junhu,Rykov A I,et al. Prussian blueTiO2nanocomposites as a heterogeneous photo-Fenton catalyst for degradation of organic pollutants in water[J]. Catalysis Science & Technology,2015,5(1):504-514
[10] Rusevova K,Köferstein R,Rosell M,et al. LaFeO3and BiFeO3perovskites as nanocatalysts for contaminant degradation in heterogeneous Fenton-like reactions[J]. Chemical Engineering Journal,2014,239:322-331
[11] Chen Fengxi,Xie Shenglong,Huang Xuanlin,et al. Ionothermal synthesis of Fe3O4magnetic nanoparticles as efficient heterogeneous Fenton-like catalysts for degradation of organic pollutants with H2O2[J]. Journal of Hazardous Materials,2017,322:152-162
[12] Zhao Xiaorong,Liu Shuan,Huang Yingping. Removing organic contaminants by an electro-Fenton system constructed with graphemecathode [J]. Toxicological & Environmental Chemistry,2016,98(34):530-539
[13] Tian Jiangnan,Zhao Jixiang,Olajuyin A M,et al. Effective degradation of Rhodamine B by electro-Fenton process,using ferromagnetic nanoparticles loaded on modified graphite felt electrode as reusable catalyst:In neutral pH condition and without external aeration[J]. Environmental Science and Pollution Research,2016,23(15):15471-15482
[14] Zhou Haiyan,Hu Li,Wan Jinzhong,et al. Microwave-enhanced catalytic degradation ofp-nitrophenolin soil using MgFe2O4[J]. Chemical Engineering Journal,2016,284:54-60
[15] Pang Yixiong,Lei Hengyi. Degradation ofp-nitrophenol through microwave-assisted heterogeneous activation of peroxymonosulfate by manganese ferrite[J]. Chemical Engineering Journal,2016,287:585-592
[16] Han Changcun,Ge Lei. Novel visible light induced Co3O4-gC3N4heterojunction photocatalysts for efficient degradation of methyl orange [J]. Applied Catalysis B:Environmental,2014,147:546-553
[17] Wang Chengxiang,Shi Penghui,Cai Xiaodong,et al. Synergistic effect of Co3O4nanoparticles and graphene as catalysts for peroxymonosulfate-based orange II degradation with high oxidant utilization efficiency[J]. The Journal of Physical Chemistry C,2015,120(1):336-344
[18] GuoWeilin,Su Shengnan,Yi Chunliang,et al. Degradation of antibiotics amoxicillin by Co3O4-catalyzed peroxymonosulfate system [J]. Environmental Progress & Sustainable Energy,2013,32(2):193-197
[19] Li Yang,Liu Lindong,Liu Lu,et al. Efficient oxidation of phenol by persulfate using manganite as a catalyst[J]. Journal of Molecular Catalysis A:Chemical,2016,411:264-271
[20] Cui Bin,Song Cheng,Wang Guangyue,et al. Reversible ferromagnetic phase transition in electrode-gated manganites [J].Advanced Functional Materials,2014,24(46):7233-7240
[21] Strandwitz N C,Comstock D J,Grimm R L,et al. Photoelectrochemical behavior of n-type Si(100) electrodes coated with thin films of manganese oxide grown by atomic layer deposition [J]. The Journal of Physical Chemistry C,2013,117(10):4931-4936
[22] Hatzell K B,Fan Lei,Beidaghi M,et al. Composite manganese oxide percolating networks as a suspension electrode for an asymmetric flow capacitor [J]. ACS Applied Materials & Interfaces,2014,6(11):8886-8893
[23] Xiao Junwu,Yang Shengxiong,Wan Lian,et al. Electrodeposition of manganese oxide nanosheets on a continuous three-dimensional nickel porous scaffold for high performance electrochemical capacitors[J]. Journal of Power Sources,2014,245:1027-1034
[24] Cetinkaya T,Tocoglu U,Uysal M,et al. A parametric study on the rapid synthesis of one dimensional(1D)α-MnO2nanowires [J].Microelectron Eng,2014,126:54-59
[25] Su Dawei,Ahn H J,Wang Guoxiu. Hydrothermal synthesis of α-MnO2and β-MnO2nanorods as high capacity cathode materials for sodium ion batteries[J]. J Mater Chem A,2013,15:4845-4850
[26] Cheng Fangyi,Zhao Jianzhi,Song Wen,et al. Facile controlled synthesis of MnO2nanostructures of novel shapes and their application in batteries[J]. Inorganic Chemistry,2006,45(5):2038-2044
[27] Shen Xiongfei,Ding Yunshuang,Liu Jia,et al. Control of nanometer-scale tunnel sizes of porous manganese oxide octahedral molecular sieve nanomaterials [J]. Advanced Materials,2005,17(7):805-809
[28] Shao Jiajia,Li Wenyao,Zhou Xiying,et al. Magnetic-field-assisted hydrothermal synthesis of 2×2 tunnels of MnO2nanostructures with enhanced supercapacitor performance [J]. Cryst Eng Comm,2014,16(43):9987-9991
[29] Chandra V,Park J,Chun Young,et al. Water-dispersible magnetite-reduced graphene oxide composites for arsenic removal [J]. ACS Nano,2010,4(7):3979-3986.
[30] Guan Yinghong,Ma Jun,Li Xuchun,et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UVperoxymonosulfate system [J]. Environmental Science & Technology,2011,45:9308-9314.
[31] Wang Yuxian,Sun Hongqi,Ang Haming,et al. Magnetic Fe3O4carbon spherecobalt composites for catalytic oxidation of phenol solutions with sulfate radicals [J]. Chemical Engineering Journal,2014,245:1-9
[32] Neta P,Huie R E,Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data,1988,17(3):1027-1284
[33] Wang Yuxian,Indrawirawan S,Duan Xiaoguang,et al. New insights into heterogeneous generation and evolution processes of sulfate radicals for phenol degradation over one-dimensional α-MnO2nanostructures [J]. Chemical Engineering Journal,2015,266:12-20
