乳酸菌R8高密度培养的发酵工艺研究
2018-03-13吴军林柏建玲莫树平张菊梅
吴军林,柏建玲,莫树平,张菊梅
(1.广东环凯微生物科技有限公司,广东广州 510663)(2.广东省微生物研究所,广东广州 510070)
传统的菌体培养方式仅能解决菌体生长的营养需求而无法解除代谢产物的抑制,很难从跟不上解决菌体的高密度培养核心技术问题。高密度培养是近几年来发酵工艺的重要目标与方向之一。乳酸菌要通过高密度培养技术达到理想的高浓度产量,需要优化一系列相关的工艺参数来对发酵过程进行严格的控制。通过解决这些问题,设计出合适的培养途径达到理想的菌体浓度[1]。
研究报道表明,影响乳酸菌增殖的因素有很多,如菌种的活力、培养代数、培养周期、培养液的初始pH值、培养温度、培养时间、接种量和增殖因子等,其中培养基的物理性质及成分会严重影响到乳酸菌菌体的收集工作,所以培养基的选择多选用粘度小、蛋白质含量低的透明液。微生物需从外界吸收营养物质以获得能量完成自身代谢过程并合成新物质,培养基是试验室中用来培养微生物的营养液,配制出能够满足菌体生长所需各种营养的培养基是研究菌体高密度培养的前提条件。高细胞密度发酵(High cell density fermentation,HCDF)是指在一定的培养条件和体系内,在不影响胞内产物积累的基础上,尽可能多的积累生物量[2]。
工业化发酵生产就是要以最低的生产成本获取最高的细胞或代谢产物收益,因此确定低成本、高效率的高密度培养工艺是本研究关注的焦点。本文以一株已经证实具有耐酸、耐胆汁的乳杆菌R8菌株为材料,对其高密度发酵培养工艺进行了研究。以菌体密度(OD600)及碳源(葡萄糖)的利用情况为主要参考指标,研究了中和剂、pH、接种量、初始糖含量、通气方式以及补料工艺等对菌体在7.5 L搅拌发酵罐内生长的影响,并经过对试验菌进行250 L中试放大工艺的优化。最终确定一条低成本、高效率的高密度培养工艺。
1 材料与方法
1.1 菌株来源
乳杆菌R8由本项目课题组广东省微生物研究所筛选驯化提供[3]。
1.2 培养基
1.2.1 MRS培养基(g/L)
葡萄糖20.0 g,胰蛋白胨10.0 g,牛肉膏8.0 g,酵母粉 4.0 g,Tween80 1.0 mL,K2HPO42.0 g,MgSO4·7H2O 0.2 g,MnSO4·4H2O 0.05 g,柠檬酸铵 2.0 g,CH3COONa·3H2O 5.0 g,蒸馏水 1000 mL,pH 6.2。
1.2.2 液体种子及发酵培养基-改良MRS培养基(g/L)
葡萄糖 20.0 g,酵母粉 30.0 g,MgSO4·7H2O 2.0 g,KH2PO42.5 g,柠檬酸三铵 2.5 g,CH3COONa·3H2O 6.25 g,Tween80 1.0 mL,pH 6.2。
1.2.3 平板计数用培养基
改良MRS液体培养基加1.5%~2%琼脂。
1.3 试验仪器
台式冷冻离心机SIGMA 3K15,德国;生化培养箱LRH-250,上海;全波长扫描分光光度计,岛津;UV-1800,日本;30 L发酵罐,镇江东方生物工程设备技术有限责任公司GUJS-30;250 L发酵罐,镇江东方生物工程设备技术有限责任公司GUJS-250。
1.4 试验方法
1.4.1 培养方法
1.4.1.1 菌种保存
菌株R8于甘油管中-20 ℃保存。
1.4.1.2 液体种子培养
接种于改良MRS培养基,接种量2%,37 ℃培养16~18 h。
1.4.2 检测方法
1.4.2.1 发酵液菌体干重测定
取一定体积的发酵液,离心后用无菌水洗涤两次,再将菌体干燥后称重即可算得菌体干重,以g/L表示。
1.4.2.2 发酵液浓度测定
取一定体积培养液8000 r/min离心10 min,弃上清液,用等体积的无菌生理盐水洗涤两次后将菌体悬浮,测定600 nm下的吸光度值。
1.4.2.3 菌液活菌数测定
菌液用梯度稀释法稀释到一定倍数后涂平板,37 ℃培养48 h后计数,结果以CFU/mL表示[4]。
1.4.3 小试初始发酵工艺
用于小试工艺研究的是一台搅拌型生物反应器(瑞士INFORS LabforsⅢ),带有基本的温控、补料和通气装置,总容积 7.5 L,温度自控,可在线监控pH值(梅特勒pH电极),并可根据需要自动流加中和剂控制pH。与其它生物反应器相比,搅拌型生物反应器更易实现工业化,也是迄今为止使用最为广泛的生物反应器。
小试初始发酵工艺:将种子液以2%(V/V)接种于装液量为70%的7.5 L小罐,搅拌转速100 r/min,不通气,恒定pH 6.2,37 ℃恒温培养至发酵结束。
1.4.4 分批发酵条件优化
在小试初始发酵工艺的基础上,分别研究以下各因素对菌体生长的影响,每一步优化的结果都用于下一步的发酵过程中,根据不同条件下菌体的生长情况逐步确定最佳的小试发酵工艺。
1.4.4.1 不同中和剂
12.5%氨水,6 mol/L NaOH。
1.4.4.2 不同pH
pH 5.4~6.6之间每0.4个pH单位为一个梯度的不同pH值。
1.4.4.3 不同接种量
2%,5%,8%。
1.4.4.4 不同初始碳源含量
初始葡萄糖浓度分别为20 g/L,30 g/L,40 g/L,50 g/L。
1.4.4.5 不同通气方式
持续通氮气0.02 vvm不保压,间歇通氮气不保压(每2 h,以0.2 vvm的速率通氮气5 min),通氮气保压0.02 Mpa。
1.4.5 补料分批发酵模式的研究
在分批培养最佳条件的基础上,以初糖20 g/L开始发酵至对数生长期时(约4 h后)开始间歇流加葡萄糖液,使发酵液中的糖浓度维持在15 g/L左右,直至发酵结束,以分批培养作为对照,比较分析后确定合适的培养模式。
1.4.6 中试发酵工艺的确定
由30 L发酵罐到250 L发酵罐逐级扩大中试规模。初始的发酵工艺条件参考小试发酵工艺,根据中试情况调整工艺条件,从而确定250 L中试规模的发酵工艺。初始发酵工艺:经活化后的种子液以 8%接种于装液量为70%的30 L发酵罐,搅拌转速60 r/min,通过自动流加氨水控制pH 5.8,间歇通氮气不保压(每2 h,以0.2 vvm的速率通氮气5 min),37 ℃恒温发酵至结束。发酵液离心分离收集菌体,添加保护剂后冷冻干燥制成冻干菌粉。
2 结果与讨论
2.1 分批发酵条件优化
本研究以菌体密度(OD600nm)及碳源(葡萄糖)的利用情况为主要参考指标,研究了中和剂、pH值、接种量、初始糖含量、通气方式以及补料工艺等对菌体在7.5 L搅拌发酵罐内生长的影响,逐步优化菌体的小试发酵工艺。
2.1.1 中和剂的选择
菌体代谢产物(乳酸和乙酸等)对菌体生长的反馈抑制是影响乳酸菌高密度培养的主要原因,通过流加中和剂使培养液的pH值维持在菌体最适生长pH范围内可以有效缓解这种抑制作用,从而提高菌体的生长密度。
NaOH、KOH、NH3·H2O 和 Na2CO3等都是发酵工业中常用的中和剂。针对不同的微生物或不同培养基质,不同的中和剂所能达到的效果也不尽相同,本试验主要比较NaOH和NH3·H2O这两种中和剂对试验菌种生长的影响,结果见图1。
从图1可看出,使用不同的中和剂,菌体的生长过程相似,随着菌体浓度升高,碳源(葡萄糖)逐渐被消耗。从菌体浓度看,以氨水为中和剂更利于菌体的生长,稳定期时的OD值在5以上,碳源在发酵12 h时已基本耗尽;以NaOH为中和剂,稳定期时菌体浓度稍逊于氨水,OD值约4.52左右,碳源在发酵12 h时仍有少量剩余。以氨水作为中和剂,既可以调节培养液的pH值,也可作为氮源被菌体利用,促进菌体的生长。后续试验都采用12.5%的氨水作为中和剂。

图1 不同中和剂对菌体生长的影响Fig.1 The effects of different neutralizers on bacterial growth
2.1.2 不同pH对菌体生长的影响
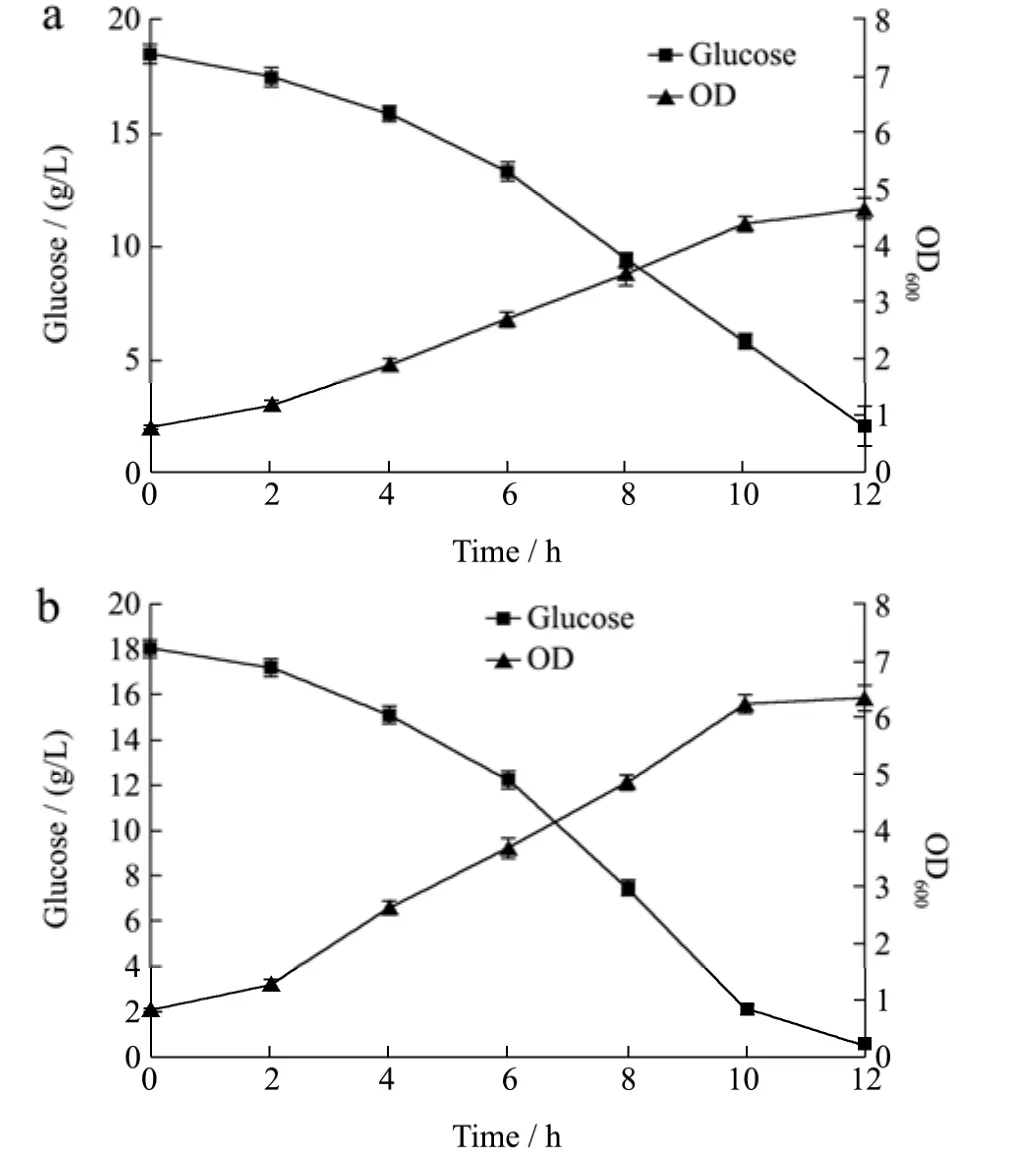

图2 不同pH对菌体生长的影响Fig.2 The effects of different pH on the bacterial growth
微生物都有其最适生长pH值,本试验研究了试验菌在pH 5.4~6.6范围内的生长情况,结果见图2。
如图2所示,菌体在不同pH条件下的生长过程相似,随着碳源的消耗,菌体浓度不断提高,pH维持5.8发酵12 h后的菌体浓度最大,OD值6.5左右,pH维持5.4发酵12 h后的菌体浓度最低,OD值不到5,pH值为6.2和6.6的情况基本相同,最终OD值都在5~6之间。从碳源利用情况来看,pH值在5.8~6.6之间时,12 h内糖基本耗尽,在较低pH值(5.4)发酵时,12 h后仍有少量糖剩余,说明微酸性的环境较适合菌体生长。后续试验中pH均控制在5.8。
2.1.3 接种量对菌体生长的影响
接种量一般可以影响到菌体的增值速度,缩短延滞期,本试验比较了2%~8%不同的接种量对菌体生长的影响,结果见图3。
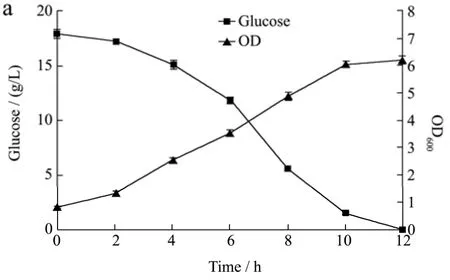

图3 不同接种量对菌体生长的影响Fig.3 the effects of different inoculum concentration on bacterial growth
如图3所示,5%与8%接种量的发酵过程相近,10 h时碳源均已耗尽,菌体达最大浓度,最终菌浓与2%接种量发酵12 h时基本相同,说明提高接种量的确加快了菌体的生长速度。
菌体浓度没有明显提高,很可能是因为培养基中的碳源较早耗尽,使得菌体不能充分生长,因此将接种量定为8%,继续培养基初糖浓度的优化试验。
2.1.4 初始糖浓度对菌体小试发酵的影响
在2.1.3接种量的研究中发现初始糖含量20 g/L很可能无法满足菌体生长的实际需要,因此在小试条件下对培养基的初始糖浓度做进一步的优化,以确定适宜的初始糖浓度。
试验中将初始糖浓度从20 g/L逐渐增至50 g/L,发酵结果见图4。

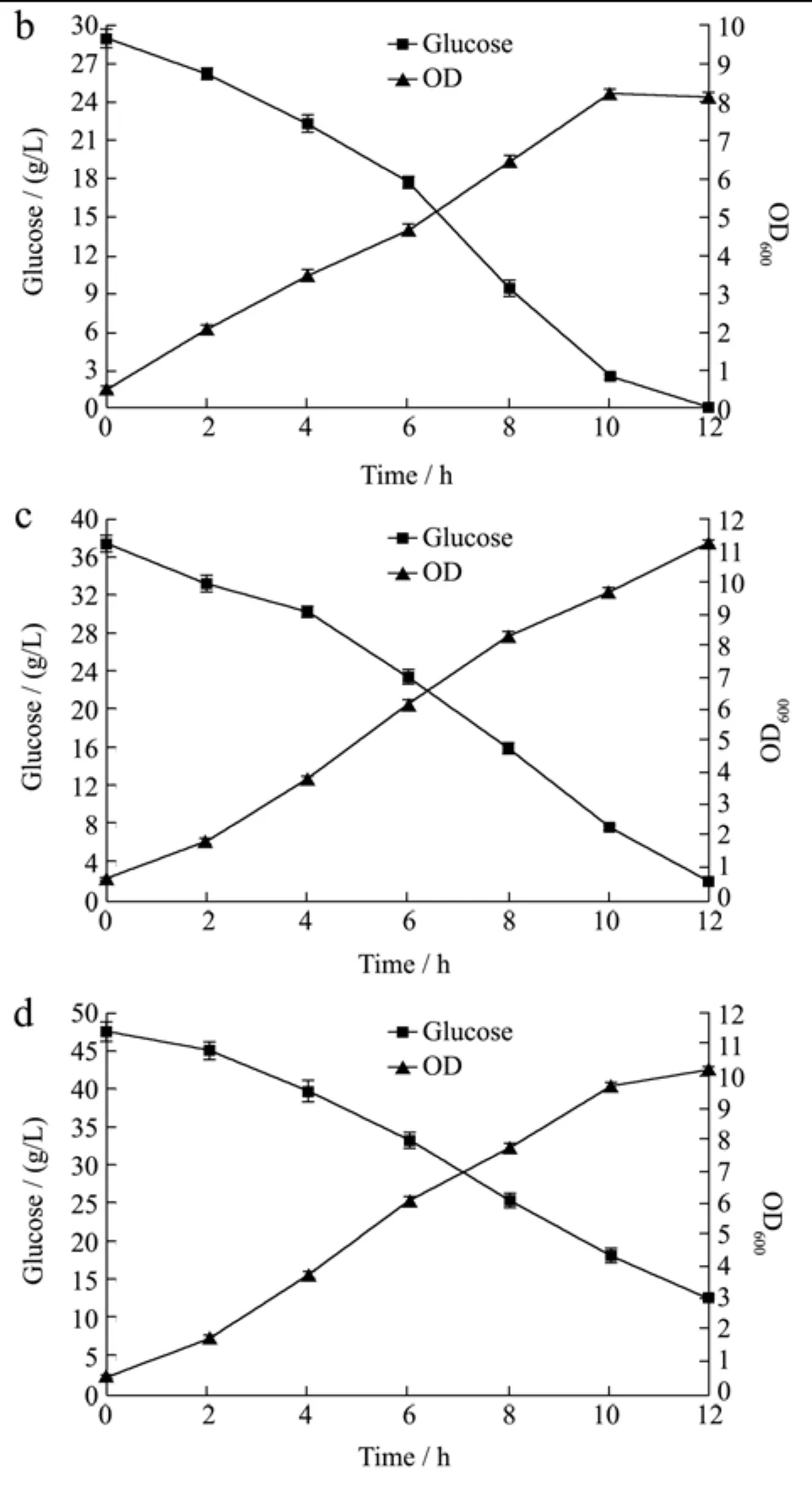
图4 不同初始糖浓度对小试条件下菌体生长的影响Fig.4 The effects of different initial glucose concentrations on the bacterial growth in the bench-scale test
结果表明原优化培养基中的葡萄糖浓度确实无法满足菌体在小试管培养条件下的生长需求,提高初始葡萄糖浓度后,菌体的终浓度有显著提升,当初始葡萄糖浓度为40 g/L,菌体的终浓度最高,OD值为11.5左右,糖在12 h的发酵过程中也基本耗尽,当初始糖浓度提高到50 g/L时,菌体终浓度OD值在10以上,但发酵至稳定期时残糖浓度仍大于10 g/L,说明50 g/L的初糖浓度并不能更好的促进菌体的生长。因此后续试验中将培养基初始葡萄糖浓度调为40 g/L。
2.1.5 不同通气方式对菌体生长的影响
大多数乳酸菌都为厌氧或兼性厌氧菌,在发酵过程中为菌体提供适宜的厌氧环境很可能会促进菌体生长,因此本试验研究不同的通气条件[a.持续通氮气0.02 vvm不保压,b.间歇通氮气不保压(每2 h,以0.2 vvm的速率通氮气5 min),c.氮气保压(0.02 Mpa)]对菌体生长的影响,不通气作对照,试验结果见图5。
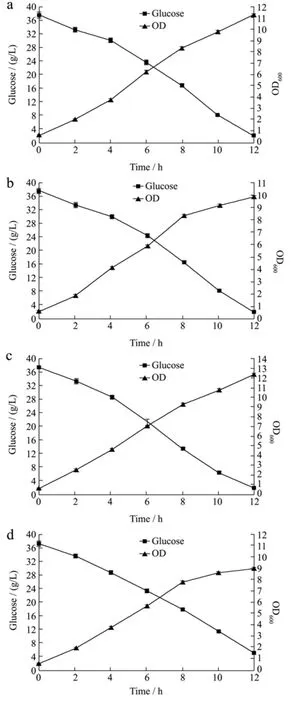
图5 不同的通气方式对小试条件下菌体生长的影响Fig.5 The effects of different ventilation conditions on the bacterial growth in the bench-scale test
结果表明不同的通气条件对菌体的生长确有影响,从图5可看出,与不通气相比,间歇通氮气的条件下,菌体的终浓度最高,OD值达到12以上,在持续通氮气或用氮气保压的条件下,菌体终浓度比不通气时还低,说明充足的氮气环境或有压力的环境均不适合菌体的生长。因此确定采用间歇通氮气不保压的方式进行发酵。
2.2 分批补料发酵对菌体生长的影响

图6 补料发酵模式对菌体生长的影响Fig.6 The effects of fed batch fermentation modes on the bacterial growth
本研究目的是确定补料发酵模式是否更适于菌体的高密度培养,试验中补料采用的是一种低糖流加的方式,即在低初糖浓度的条件下开始发酵,在菌体进入对数生长期时,通过间歇流加新鲜糖液使发酵液内葡萄糖浓度维持在一个较低的水平,这种发酵方式既可以减少高浓度底物对菌体生长产生的抑制效应,也可在发酵过程中对发酵液产生一定的稀释效应以减少某些代谢产物对菌体生长的抑制作用。
试验方法见1.3,以不补料的前期优化后的小试工艺作对照(前期优化后的小试工艺为:将种子液以8%(V/V)的接种量接种于装液量70%的小罐,初糖浓度40 g/L,搅拌转速100 r/min,间歇通氮气维持一定的厌氧环境,自动流加12.5%的氨水控制pH值恒定在5.8,37 ℃恒温发酵),试验结果见图6。
从图6可看出,补料发酵的条件下,菌体的快速增殖期延长至16 h,菌体最终浓度的OD值在12以上,这与无补料批式发酵12 h所达到的最终菌浓相当,说明低糖流加的补料发酵方式并不比批发酵方式更优,反而在工艺上更加复杂。因此采用简单易控的批发酵方式进行菌体的高密度培养更为合适。
2.3 中试发酵实验结果
为实现菌体的规模化生产,经过试验室小试研究后,采用30 L和250 L的发酵罐进行逐级放大的中试发酵工艺研究。
初始发酵工艺参数参考小试,因30 L及250 L罐采用的是一档6斜叶,两档6平叶的三档搅拌浆,相比小罐的两档6平叶搅拌桨混匀效果更好,所以搅拌转速降为60 r/min。
30 L罐发酵试验结果见图7,从菌体的生长情况及碳源的利用情况看与小试培养基本一致,菌体的终浓度也与小试相当,OD值12左右。说明由小试到30 L罐的放大过程是可行的。
250 L罐的种子液需由30 L罐发酵制备,种子液的制备过程主要分为控制pH值与不控制pH值两种情况,因此分别用两种方式得到的对数期中期(发酵7 h)的种子液接种250 L发酵罐进行发酵,发酵控制工艺同30 L罐,结果见图7、8。

图7 30 L罐发酵过程曲线Fig.7 The fermentation progress curve of 30 L tank

图8 不同种子液对250 L中试发酵的影响Fig.8 The effects of different seed solutions on 250 L pilot-scale fermentation
由图7,8可看出,不控制pH的种子液在对数生长期时的菌体浓度要比控制pH的种子液低,同时因发酵液的pH值不同,菌体的生理状态也不同,作为种子接入250 L发酵罐后的生长情况也会有所不同。通过比较a、b两图,可看出控制pH的种子液转接发酵后生长速度相对较快,发酵10 h菌体已经达最大浓度,OD值12左右,与小试培养的结果无差异,说明30 L到250 L的中试放大过程可行。经过对试验菌中试放大工艺的优化,最终250 L规模所得发酵液的活菌浓度约为3.8×109CFU/mL,经真空冷冻干燥所得的菌粉活菌浓度约为7.4×1010CFU/g。最后确定250 L中试发酵工艺为:将控制pH 5.8,37 ℃恒温发酵7 h左右的种子液以 8%接种量接种于装液量为 70%的250 L发酵罐,搅拌转速60 r/min,自动流加氨水控制pH 5.8,间歇通氮气不保压(每2 h以0.2 vvm的速率通氮气5 min),37 ℃恒温发酵10 h左右结束。
3 结论
3.1 乳酸菌在培养过程中能分解培养基中的糖类而产生以乳酸为主的有机酸。由于代谢产物的积累会抑制菌体的生长,采用常规方法培养时,其培养液中的活菌数只能达到107~108CFU/mL。现有的乳酸菌高密度培养方法主要有缓冲盐法、化学中和法和渗析法[5],可以使培养液中活菌数达到109CFU/mL;另外还有细胞循环培养法、透析培养法、补料分批培养法和微囊化培养法等[6],可使培养液中活菌数最高达到 1011CFU/mL。但是细胞循环培养存在膜容易污染,不能实现长时间的连续操作等问题;透析培养法存在设备投资大,对操作技术要求高等问题。本实验综合化学中和法和补料分批培养法等方法以菌体密度(OD600)及碳源(葡萄糖)的利用情况为主要参考指标,研究了中和剂、pH值、接种量、初始糖含量、通气方式以及补料工艺等对菌体在7.5 L搅拌发酵罐内生长的影响,逐步优化菌体的小试发酵工艺为:将种子液以8%(V/V)的接种量接种于装液量 70%的小罐,初糖浓度40 g/L,搅拌转速100 r/min,间歇通氮气维持一定的厌氧环境,自动流加12.5%的氨水控制pH值恒定在5.8,37 ℃恒温发酵。
3.2 经过对试验菌中试放大工艺的优化,最终250 L规模所得发酵液的活菌浓度约为 8×109CFU/mL,经真空冷冻干燥所得的菌粉活菌浓度约为 1.2×1011CFU/g。最后确定250 L中试发酵工艺为:将控制pH 5.8,37 ℃恒温发酵7 h左右的种子液以8%接种量接种于装液量为 70%的 250 L发酵罐,搅拌转速 60 r/min,自动流加氨水控制pH 5.8,间歇通氮气不保压(每2 h以0.2 vvm的速率通氮气5 min),37 ℃恒温发酵10 h左右结束。
[1]卢新军,陶永胜,张振文.乳酸菌高密度培养影响因子的研究[J]. 粮食流通技术,2017,2:89-91 LU Xin-jun, TAO Yong-sheng, ZHANG Zhen-wen. Research on the influencing factors of high density culture of Lactic acid bacteria [J]. Grain Distribution Technology, 2017, 2:89-91
[2]郑双凤,谭石勇,谭武贵,等.生防芽孢杆菌高密度发酵技术研究进展[J].湖南农业科学,2017,3:120-124 ZHENG Shuang-feng, TAN Shi-yong, TAN Wu-gui, et al.Research progress of high cell density fermentation technology in biocontrol of Bacillus spp [J]. Hunan Agriculture Sciences, 2017, 3: 120-240
[3]柏建玲,吴清平,张菊梅,等.耐胃液乳酸菌的筛选、鉴定与驯化[J].食品工业科技,2010,11:190-192,195 BAI Jian-ling, WU Qing-ping, ZHANG Ju-mei, et al.Screening, identification and domestication of the tolerable gastric Lactic acid bacteria [J]. Science and Technology of Food Industry, 2010, 11: 190-192,195
[4]柏建玲,莫树平,郑婉玲,等.乳酸菌增菌培养基的营养因子优化[J].食品与发酵工业,2007,33(2):79-81 BAI Jian-ling, MO Shu-ping, ZHENG Wan-ling, et al.Optimization of the nutrient factors for lactic acid bacteria enrichment medium [J]. Food and Fermentation Industries,2007, 33(2): 79-81
[5]熊涛,徐立荣,范镭,等.蔬菜发酵专用乳酸菌的菌体高密度培养[J].食品科学,2007,28(12):345-350 XIONG Tao, XU Li-rong, FAN Lei, et al. Investigation on dense cultivation of Lactobacillus specific for vegetable fermentation [J]. Food Science, 2007, 28(12): 345-350
[6]刘辉,季海峰,王四新,等.饲用乳酸菌高密度培养的研究进展[J].中国饲料,2016,4:11-14 LIU Hui, JI Hai-feng, WANG Si-xin, et al. The research progress of the high density culture of lactic acid bacteria preparation in feed [J].Chinese Feed, 2016, 4: 11-14
