猪链球菌通用型和2型双重荧光定量PCR快速检测技术的建立和应用
2018-03-13吴静波南文金黄健强胡鸿惠彭国良董小英
吴静波,南文金,黄健强,胡鸿惠,彭国良,彭 凌,董小英
(韶关学院粤北生猪生产及疫病防控协同创新发展中心,韶关 512005)
猪链球菌是造成生猪养殖业重大经济损失的主要病原之一,全球几乎100%规模化猪场均有猪链球菌存在[1]。该菌可通过呼吸道相互传播,主要引起败血症、脑膜炎、关节炎、肺炎、心内膜炎等。同时猪链球菌也是一种人兽共患病病原,可通过接触带菌猪或猪肉产品感染人,引起败血症、脑膜炎,甚至休克样综合征,导致死亡[1]。尽管50年来人感染猪链球菌大多为职业接触性的散发病例,比如养殖户、兽医、屠夫、食品加工者等职业人群[2];但最近几年人感染猪链球菌病例的数量不断增加,并趋向于常规人群。在中国有过两次猪链球菌2型的区域大流行,分别为1998年江苏25人感染14人死亡和2005年四川215人感染38人死亡,严重威胁公共卫生安全[2-4]。
猪链球菌为革兰阳性球菌,是猪的正常寄生菌,主要定植在猪的上呼吸道中,尤其是在扁桃体和鼻腔,也可定植于生殖器和消化道内[5-6]。根据荚膜多糖的抗原性,将猪链球菌分为35个血清型(1~34型及1/2型),在所有血清型中1、2、1/2、7、9、14型为猪群中的主要致病血清型[7],2、14型为人群中的主要致病血清型[1]。调查显示不管是在人群还是猪群中,2型都是最为主要的致病菌,致病力和流行率都是最高的,占全球病例数的74.7%和27.9%,是疫情监控和病原鉴定的首要检测对象[1,3,8]。
目前细菌分离培养与血清学分型结合仍然是诊断猪链球菌的金标准[1,9],但此方法耗时,灵敏度低,操作要求高,不利于推广和疫情监测[10-11],另外血清学方法也无法检测出无荚膜菌株和自凝菌株[12-15]。对此研究者建立了单个或多重PCR、MLST、荧光PCR等方法对猪链球菌保守基因或不同血清型特异的荚膜多糖基因进行扩增与测序[10,13,16-24],在基因水平上实现对猪链球菌的鉴定与分型,弥补了血清学分型的不足,提高了检测的准确性和灵敏度。其中就包括多个猪链球菌通用型或2型的TaqMan荧光PCR方法,但这些方法都为单荧光PCR,无法实现单管内同时检测猪链球菌和猪链球菌2型,增加了疫情监测的工作量和成本。本研究采用TaqMan多重荧光PCR技术,以猪链球菌的保守基因gdh和2型特异性基因cps2J为靶基因设计两个不同荧光基团标记的探针,建立了SS通用型和2型特异性的双重荧光定量PCR检测方法,并对该方法的灵敏度、特异性、重复性进行检测;同时与常规PCR对比,检验其实际应用价值,力求建立一个快速、稳定、准确的双重检测方法。
1 材料与方法
1.1 细菌菌株
所使用菌株均为本实验室保存,包括9株经标准血清和血清型特异性PCR确定的猪链球菌1、1/2、2、3、4、7、9、14、16型;11株阴性对照菌,分别为大肠埃希菌(ATCC 25922)、金黄色葡萄球菌(ATCC 25923)、肺炎链球菌(ATCC 49619)、化脓性链球菌(ATCC 19615)、粪肠球菌(ATCC 29212)、乙型溶血性链球菌(ATCC 21059)、副猪嗜血杆菌、胸膜肺炎放线杆菌、败血波氏杆菌、猪鼻支原体(CVCC 361)、马链球菌兽疫亚种(CVCC 573)。
1.2 引物探针设计
gdh基因是猪链球菌的保守基因[25-26],在不同血清型中的一致性达到96%;cps2J是猪链球菌2型的型特异性基因[27],在血清型内较为保守,一致性达到99%。我们以猪链球菌2型参考株P1/2的基因组为参考序列(GenBank登录号:AM946016),根据gdh和cps2J基因的保守区域分别设计引物和探针,要求两靶基因的引物及探针之间无非特异性反应,序列如表1所示。使用FAM荧光素标记gdh检测探针,用于猪链球菌通用型的检测;使用HEX荧光素标记cps2J探针,用于猪链球菌2型的检测。使用MAGA 5.1和Oligo 7进行多重比对和引物探针设计,由宝生物工程(大连)有限公司合成。
1.3 优化双重荧光定量PCR反应条件
试验使用ABI 7500荧光定量PCR系统(ABI公司,美国)进行扩增和分析,以Premix ExTaqTM(Probe qPCR)(RR390,TaKaRa,中国)作为反应缓冲液。首先在缓冲液推荐的反应体系下进行退火温度的优化,设置6个退火温度,分别为50、52、54、56、58、60 ℃,反应条件为95 ℃ 5 min进行预变性及启动Taq酶,然后95 ℃ 15 s变性,50~60 ℃退火延伸30 s并收集荧光,共40个循环。在确定退火温度后则对引物和探针反应浓度进行优化,设计3×3矩阵表(如表2)分9个组,包括3个引物浓度(200、300、400 nmol·L-1)和3个探针浓度(100、150、200 nmol·L-1)。反应使用25 μL反应体系,包括12.5 μL Premix ExTaqbuffer(2×),0.5 μL的引物(10 μmol·L-1)和探针(5 μmol·L-1),1 μL的猪链球菌2型基因组DNA样品,0.25 μL ROX Reference Dye(50×),无RNA酶水补至25 μL。
表1 引物和探针序列
Table 1 Sequences of primes and probes

名称Name序列(5'-3')aSequence(5'-3')a基因组中位置bGenomepositionb产物大小/bpAmpliconsizeGDH-FGAGCTCTTCTCTACACTTGAGCC240807—240829114GDH-R/SRcCCATGGAACACGGAAGCTG240716—240734GDH-PFAM-TTGAAGCACACCCAGAATACATCGAAGAA-TAMRA240773—240801214GDH-SFcGGAATTCCATATGTCAAATGCC240908—240919CPS2J-FGATAGATGACGGTTCTTCAGATTCAT563492—56351793CPS2J-RCCATTTGGTAACCGGAAAAGTT563563—563584CPS2J-PdHEX-TCTACCATCTTGCTCTGCGTATTCCA-TAMRA563533—563558CPS2J-SFcAGGAATTCCATATGGAAAAAGTCAGCATTATTG563385—5634061019CPS2J-SRcCCGCTCGAGTTAATCATTATTTTTTTCTTCCC564361—564383SS2-FeGATTTGTCGGGAGGGTTACTTG450SS2-ReTAAATAATATGCCACTGTAGCGTCTCSSall-FeTTCTGCAGCGTATTCTGTCAAACG695SSall-ReTGTTCCATGGACAGATAAAGATGG
a. 下划线标记的为限制性酶切位点;b. 引物探针所在的基因组位置是参照猪链球菌2型P1/7株的序列,其中gdh的引物探针序列为基因组的反向序列;c. SF和SR为质粒标准品的普通PCR引物,其中GDH-R/SR同时应用于双重荧光定量PCR和普通PCR中;d. CPS2J-P为下游探针;e. 引物序列参考文献[17]
a. The underscores is the restriction site;b. Genome positions were numbered according to reference sequence AM946016.1 (Serotype 2),gdhsequence is a reverse sequence;c. SF and SR were primers of conventional PCR for standard DNA, GDH-R/SR was used to duplex Real-Time PCR and conventional PCR;d. CPS2J-P is a reverse probe;e. Reference from relative reference[17]
表2 引物及探针浓度的矩阵分组情况
Table 2 The groups of difference concentration of primer and probe
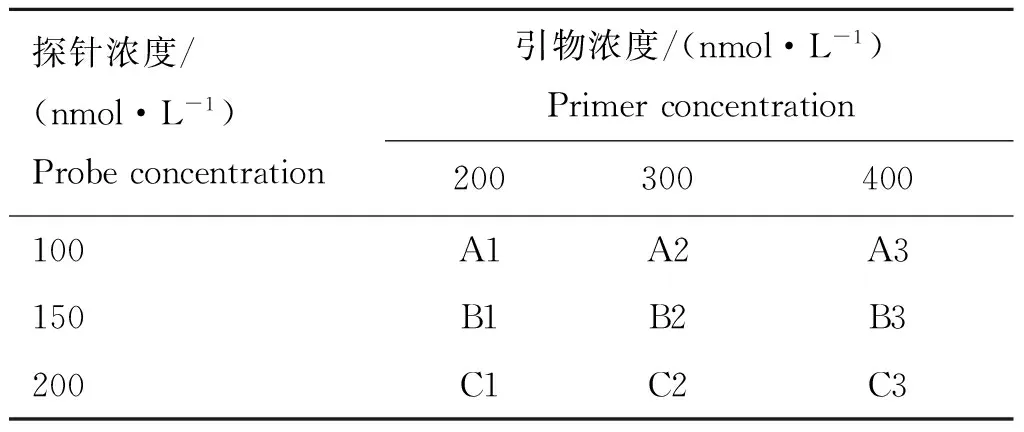
探针浓度/(nmol·L-1)Probeconcentration引物浓度/(nmol·L-1)Primerconcentration200300400100A1A2A3150B1B2B3200C1C2C3
1.4 质粒标准品制备
为绘制双重荧光定量PCR的标准曲线,我们在荧光定量PCR引物两侧又设计了一对引物用于构建标准品DNA,序列为表1所示的GDH-SF、GDH-SR(与荧光定量PCR引物相同)、CPS2J-SF、CPS2J-SR,扩增产物长度分别为214和1 019 bp。产物经1%琼脂糖电泳分离后用凝胶回收试剂盒(cat#9762,TaKaRa,中国)回收,与pMD-18T(TaKaRa,中国)载体连接后转入DH5α感受态(TaKaRa,中国)培养过夜,使用质粒提取试剂盒纯化pMD-18T-GDH和pMD-18T-CPS2J质粒,经NanoDrop ND-2000C(Thermo,美国)测得浓度后计算质粒原始拷贝数,然后用标准品稀释液(TaKaRa,中国)将两质粒标准品连续10倍稀释为4×108~4×101copies·μL-18个梯度,每个梯度3个复孔进行扩增,绘制标准曲线,计算相关系数和扩增效率。
1.5 特异性、灵敏度、重复性
用我们建立的方法对“1.1”所述的9株猪链球菌和11株阴性菌株的基因组DNA进行检测,验证方法能否在准确鉴定出猪链球菌的同时不对阴性对照菌产生非特异性反应;并验证猪链球菌2型的特异性引物和探针是否对其他血清型的猪链球菌不产生非特异反应。
对两个质粒标准品分别稀释至40、20、10、5、2.5 copies·μL-15个梯度,每个梯度3个复孔,然后用我们最优扩增体系和条件进行检测,测定最低检出极限。
使用“1.4”稀释的质粒标准品4×107~4×103copies·μL-15个梯度进行重复检测,每个梯度3个复孔,在不同时间点进行3次检测;计算检测结果的批内和批间的变异系数,以测定双重荧光定量PCR的重复性。
1.6 临床样品检测
用基因组DNA提取试剂盒(cat#9765,TaKaRa,中国)对实验室收集的67份呼吸道疾病和关节炎的临床病料(包括鼻拭子、关节液、扁桃体、肺等)进行细菌基因组DNA提取;用我们建立的双重荧光定量PCR和已公布的常规PCR方法[17]平行检测获得的DNA模板。两方法结果判定标准如下:荧光定量PCR以出现典型扩增曲线为阳性,并根据Ct值和标准曲线计算样品模板拷贝数;普通PCR以电泳检测时出现目的片段为阳性。根据试验结果,使用SPSS软件分析两种PCR方法的符合率和一致性(kappa系数);以普通PCR结果为参照,绘
制ROC曲线,计算双重荧光定量PCR检测的最佳阳性阈值。
2 结 果
2.1 双重荧光定量PCR最优反应条件
在对同一个样品的重复检测中,6个退火温度的Ct值、扩增曲线斜率和线型均没有明显的差异,但56 ℃下的结果稍好于其他退火温度(数据未显示);9个引物和探针浓度组合的双重荧光定量PCR扩增结果如图1示,结合两个靶基因的扩增曲线,可以看出C组的扩增曲线比其他两组具有更大的斜率和更小的Ct值,而C1又稍优于C2和C3组。所以双重荧光定量PCR的最优退火温度为56 ℃,最优引物和探针浓度为200 nmol·L-1。
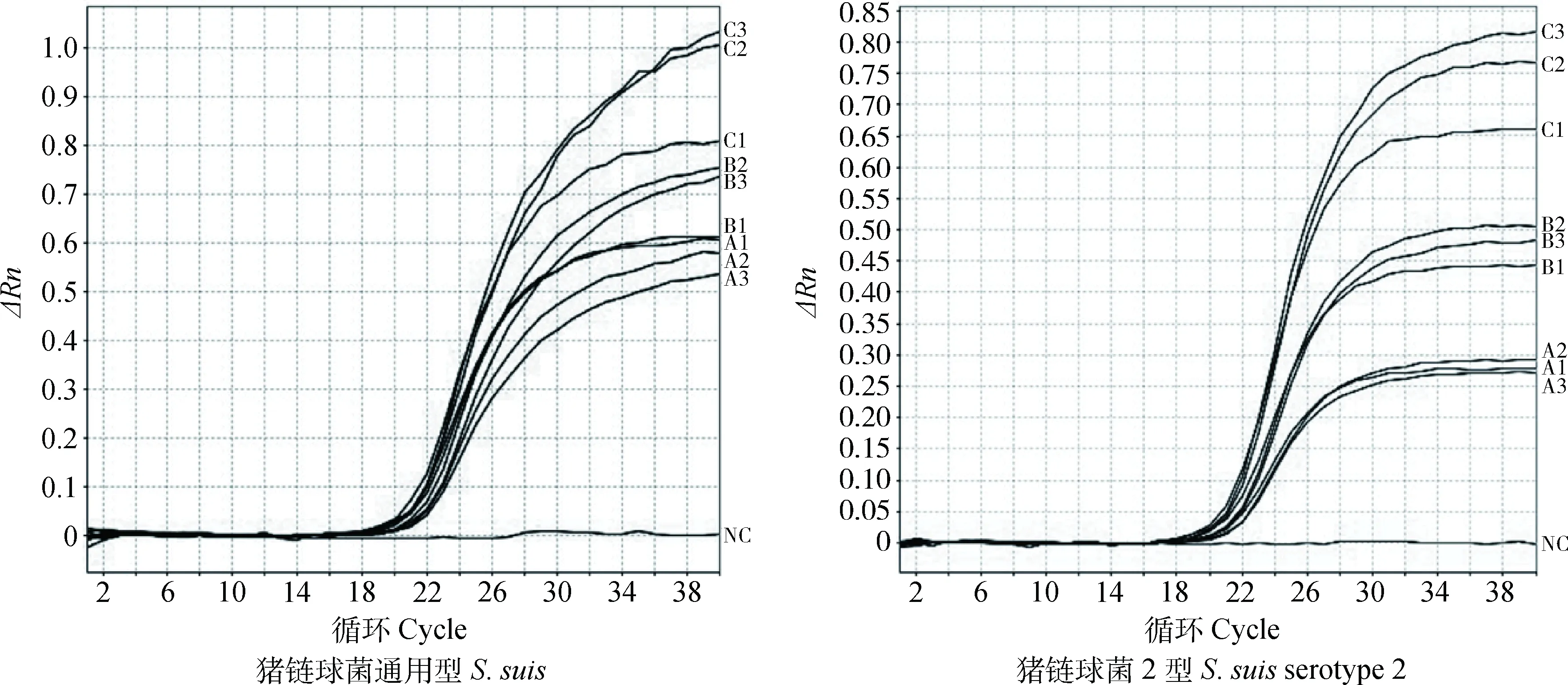
字母A、B、C表示探针浓度100、150、200 nmol·L-1,数字1、2、3表示引物浓度200、300、400 nmol·L-1,NC为阴性对照In the group name, A, B, C represent 100, 150, 200 nmol·L-1 probe concentration, respectively; and number 1, 2, 3 represent 200, 300, 400 nmol·L-1 primers concentration, respectively. NC represent negative control图1 9个引物和探针浓度优化组合的扩增曲线图Fig.1 Amplification curves of duplex real-time PCR for S. suis and S. suis 2 at 9 concentration groups of primer and probe
2.2 标准曲线绘制
在最优双重荧光定量PCR条件下分别对质粒标准品pMD-18T-GDH和pMD-18T-CPS2J的检测,均只单独出现FAM和HEX荧光曲线,即相互之间不存在非特异扩增。PCR的扩增结果如图2所示。8个浓度梯度的Ct值与对应的拷贝数的lg值呈现线性关系,且线性范围极宽;猪链球菌和猪链球菌2型的线性公式分别为y=-3.291 1x+41.154和y=-3.342 4x+41.562(y为Ct值,x为lg原始拷贝数),相关系数(R2)分别为0.999 4和0.999 3,扩增效率分别为101.303%和99.157%。
2.3 特异性、灵敏度、重复性
双重荧光定量PCR方法在检测9株猪链球菌(1、2、1/2、3、4、7、9、14、16型)基因组DNA时FAM荧光(gdh基因)均为阳性,但只有检测2和1/2型时HEX荧光(cps2J基因)才为阳性,而在对11株阴性对照菌的检测中双荧光都为阴性(结果未显示);表明这个方法可特异性鉴别猪链球菌和猪链球菌2型。
测定双重荧光定量PCR方法检测极限的结果如图3所示,在最优反应条件下对5 copies·μL-1以上模板量的扩增均能出现典型的扩增曲线,即检测极限值为5拷贝数。但是在低于10 copies·μL-1时试验的稳定性会下降(结果未显示)。

图2 质粒标准品DNA的扩增曲线图和标准曲线图Fig.2 Duplex RT-PCR amplification plots and standard curves of single plasmid standard DNA for S. suis and S. suis serotype 2, respectively
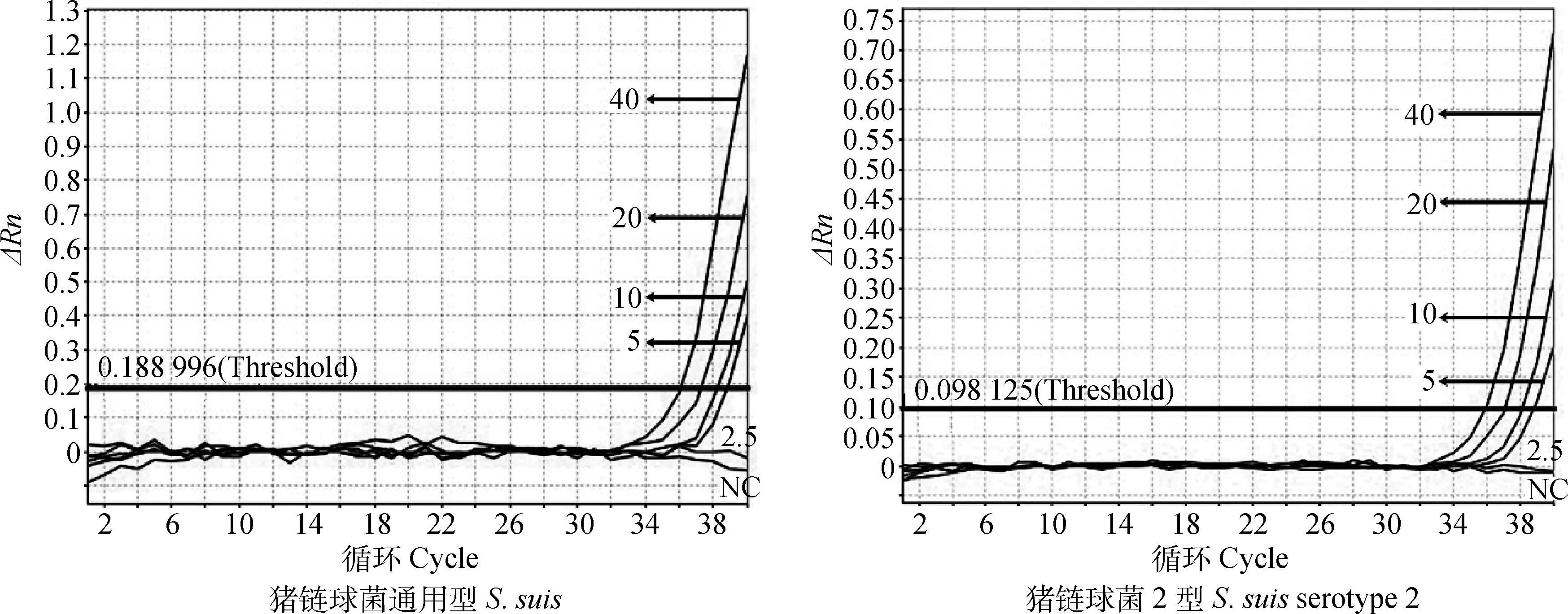
40、20、10、5、2.5表示质粒标准品的拷贝数(copies·μL-1)40, 20, 10, 5, 2.5 is the copy number of plasmid standard DNA (copies·μL-1)图3 双重荧光定量PCR对低浓度质粒标准品的扩增曲线图Fig.3 The detection limits of duplex RT-PCR for S. suis and S. suis serotype 2, respectively
我们将3次不同时间点对质粒标准品的重复检测结果绘制成误差限图(图4),显示5个质粒标准品检测Ct值的标准差都在0.06~0.24,3次检测组内变异系数在0.24%~1.19%间,组间的变异系数在0.39%~0.97%,稳定性极高。
2.4 临床样品检测
对67份临床样品进行双重荧光定量PCR和常规PCR检测,结果如表3所示,双重荧光定量PCR总共检出53例(79.1%)猪链球菌通用型阳性样品和24例(35.8%)猪链球菌2型阳性样品;并且猪链球菌2型阳性样品的通用型检测也都为阳性,占猪链球菌阳性样品的45.3%。对两PCR方法结果进行对比,显示定量结果中模板量大于等于100拷贝数的样品普通PCR结果都为阳性,模板量为0拷贝数的样品普通PCR都为阴性,两个范围内两方法的结果符合率为100%。而定量结果为1~100拷贝数的样品中,两方法通用型和2型的符合率分别为54.5%和50%,其中5例通用型(样品和拷贝数分别为鼻拭子7、14、15号:53、18、73,关节液1号:10,肺组织5号:66)和7例2型(样品和拷贝数分别为鼻拭子3、6、7、8、15号:7、24、13、13、77,关节液1号:9,肺组织5号:63)样品普通PCR为阴性,分别占荧光定量PCR通用型和2型阳性样品的9.4%和29.2%,另外6例通用型和7例2型样品普通PCR为阳性,其中最低拷贝数为通用型的35和2型的19。综合统计分析显示双重荧光定量PCR方法与通用型和2型普通PCR方法的符合率分别为92.5%和89.6%,kappa值分别为0.800和0.757,具有较高的一致性。以常规PCR结果为参考绘制ROC曲线(图5),显示双重荧光定量PCR方法通用型和2型的曲线下面积分别为0.966(P<0.001)和0.985(P<0.001),检测Ct值最佳的阳性阈值分别为35和38;在这个阈值下,双重荧光定量PCR对猪链球菌通用型检测敏感度和特异度分别为89.6%和94.7%,对猪链球菌2型的敏感度和特异度分别为100%和94%(箭头所指)。
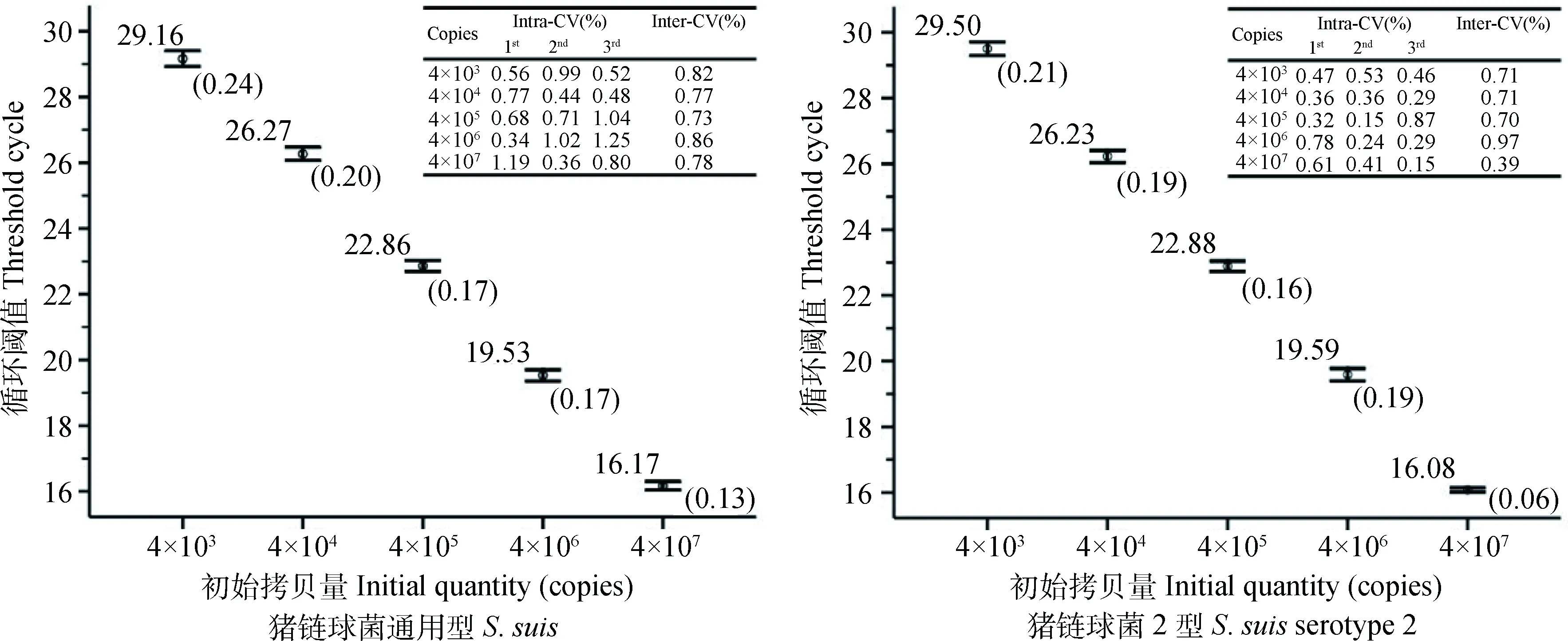
右上角表格为各浓度质粒标准品3次重复检测的批内和批间变异系数Intra-and inter-assay CV of three repeated detection for different concentration plasmid was shown in the table of the top right corner图4 双重荧光定量PCR对质粒标准品重复检测所得Ct值的误差限图Fig.4 The error bar of repeatability assay for S. suis and S. suis serotype 2, respectively
表3 双重荧光定量PCR与常规PCR对67份临床样品的检测结果
Table 3 Results of duplex real-time PCR and conventional PCR for clinical samples
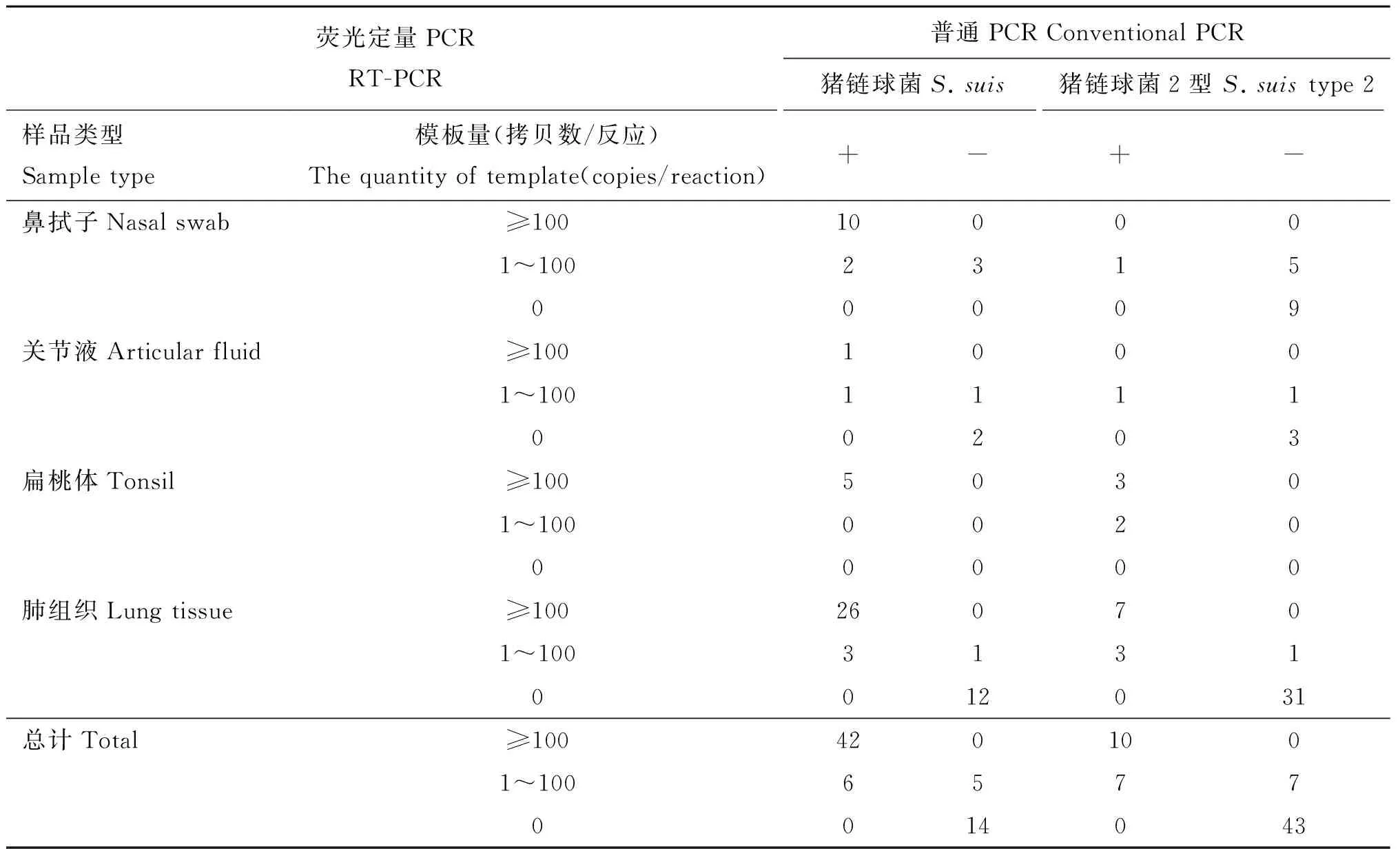
荧光定量PCRRT-PCR普通PCRConventionalPCR猪链球菌S.suis猪链球菌2型S.suistype2样品类型Sampletype模板量(拷贝数/反应)Thequantityoftemplate(copies/reaction)+-+-鼻拭子Nasalswab≥100100001~100231500009关节液Articularfluid≥10010001~100111100203扁桃体Tonsil≥10050301~100002000000肺组织Lungtissue≥100260701~10031310012031总计Total≥1004201001~10065770014043
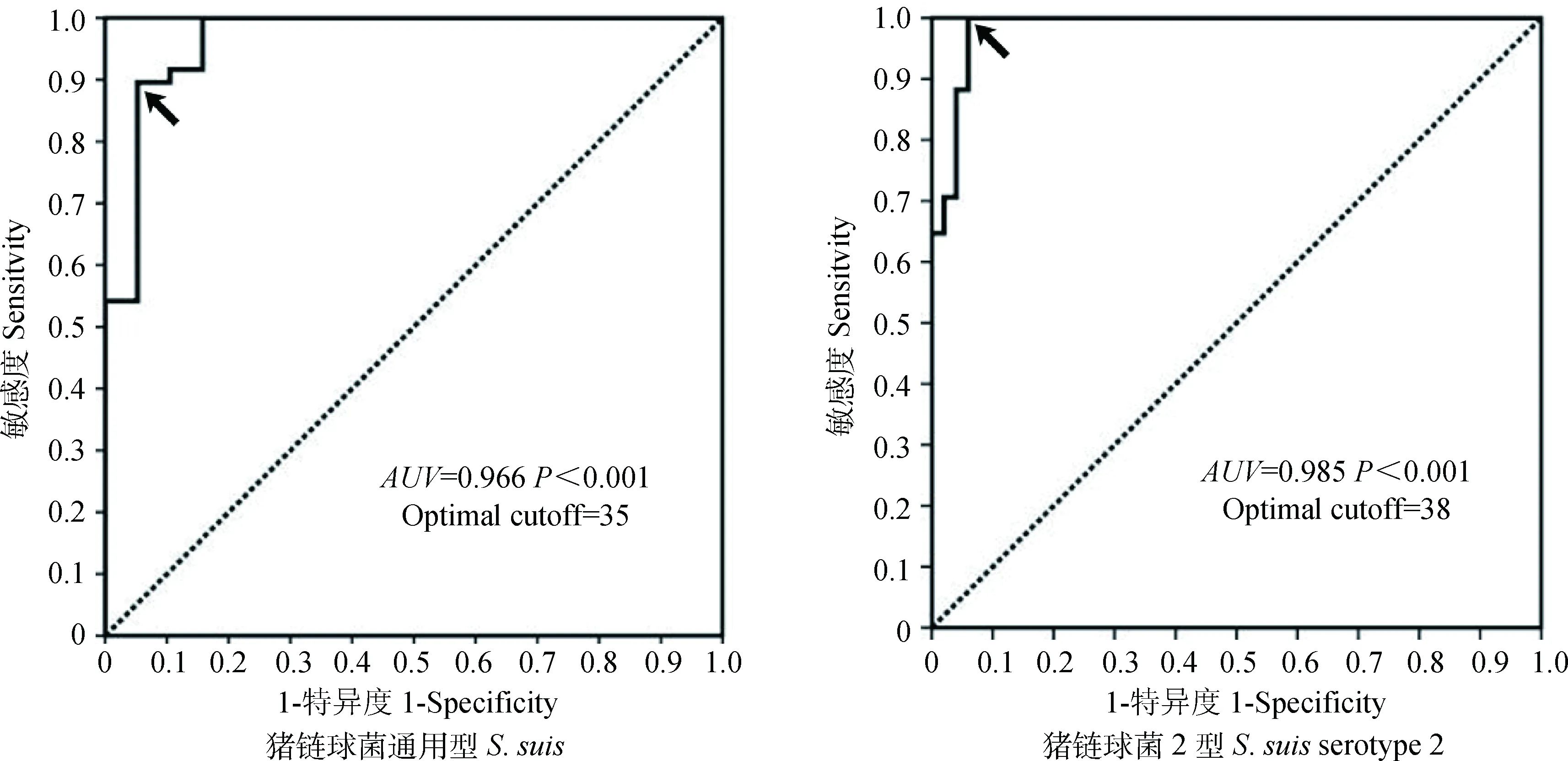
以荧光定量PCR检测Ct值为检验变量,常规PCR检测结果为状态变量绘制ROC曲线。AUV表示曲线下面积,大于9时说明检测方法具有很高的诊断价值,P<0.001说明诊断成立。最佳阈值是采用曲线上Youden指数最大点(Youden指数=敏感度+特异度-1),图上箭头所指点The Ct value of duplex Real-Time PCR was test variable, Ct value of conventional PCR was state variable, ROC was drawn according to them. AUV mean area under curve.Detection prompted high diagnostic value when AUV was above 9, P<0.001 indicated diagnosis was established.The best positive threshold was Youden index (specificity+sensitivity-1) maximum points on curve, as the arrow in Figure 5图5 以普通PCR检测结果为参照绘制双重荧光定量PCR检测临床样品结果的ROC曲线Fig.5 The receiver operating characteristic curve of duplex real-time PCR detection results for clinical samples which reference to conventional PCR
3 讨 论
猪链球菌是猪上呼吸道系统中的正常寄生菌,其致病性的划分比较模糊,部分菌株感染不引起临床症状,或者轻微的发热或败血症;但另外一些毒株可侵入脑、心、肺等主要器官,引发大量的炎症反应甚至休克性死亡[28]。现有证据表明,1~9和14型对猪具有致病性[3],而2、4、5、14、16、21、24型可感染人类引起临床症状[1];其中猪链球菌2型是毒力最强,并且分离频率最高的致病株,占全球报道的猪和人临床病例数的27.9%和74.7%[1, 3, 8],在北美、南美、欧洲、亚洲、澳大利亚等地区都是流行率最高的血清型[1,11-12, 29-32]。在我们的临床样品调查中也显示猪链球菌2型占猪链球菌阳性样品的45.3%,比例较高。所以在猪链球菌的疫情监测中,猪链球菌2型应设为重点监测对象。
猪链球菌病的初步诊断一般是根据临床症状、接触史和可视病理变化,确诊需要通过分离鉴定出病原菌。细菌分离培养与血清型分型是目前全球实验室普遍使用的诊断方法,其可靠性已得到研究者的认可;但像大部分细菌一样,猪链球菌的分离培养同样存在灵敏度低、实验时间长、操作要求高等缺点,所以越来越多的学者开始关注猪链球菌的基因分型鉴定。包括针对型特异性的荚膜多糖基因序列设计分型PCR,这部分研究大多集中在主要致病菌上,但最近有学者针对33个血清型(不包括32和34型)的cps基因设计了多个多重PCR[16,18],建立全套的基因分型方法;当然现在使用最多的还是针对猪链球菌多个保守基因的MLST方法[24],此方法主要检测cpn60、dpr、recA、aroA、thrA、gki、mutS等7个保守基因,根据这7个基因的基因型进行编码确定猪链球菌的血清型(ST),研究者还收集这些数据建立了MLST数据库,以方便猪链球菌的全球流行和分布情况的调查。
不过这两个基因分型方法都比较费时费钱,而且交叉污染的风险大,只能针对少量样品;而我们建立的双荧光定量PCR方法可以在1.5 h内完成对大量样品的处理和检测,全程闭管操作,并在监测猪链球菌通用型的同时可以完成对重点监测对象猪链球菌2型的筛选,与其他单荧光检测方法相比更省钱省时;而且检测结果与常规PCR方法的符合率达到92.5%和89.6%,kappa值达到0.800和0.757,模板在普通PCR灵敏度范围内的样品两方法检测结果符合率甚至达到100%,具有极高的一致性。当然,也和其他PCR方法一样,我们的方法无法区分2型和1/2嵌合型,因为这两种血清型的CPS基因非常相似,目前只能根据标准血清进行区分[33-34]。
在这次研究中,我们首先确定了双重荧光定量PCR的最优反应条件,并构建了两个靶基因的质粒标准品DNA;随后在最优条件下对标准品DNA进行检测并绘制了标准曲线,显示两个靶基因的检测结果和原始模板量都具有极高的线性相关性,相关系数均可达到0.999,扩增效率可达100%左右;并在多次的重复检测中保持着高度的稳定性,检测结果的标准差和变异系数分别低于0.24和1.19%;以细菌基因组DNA代替质粒标准品DNA为模板的检测结果同样可保持在这个水平(数据未显示)。
虽然我们无法收集齐35个猪链球菌血清型,但我们对主要的致病性血清型特别是2型进行了检测,显示双重荧光定量PCR方法可特异性识别猪链球菌和猪链球菌2型,两靶基因之间无交叉反应,并对其他链球菌或呼吸系统细菌无非特异性反应。在保持高特异性的同时,本方法的检测极限可达到5 拷贝数,远低于常规PCR方法,这也使得在对临床样品的检测中,双重荧光定量PCR具有更高的检出率。不过为了保证临床应用的特异性,我们以普通PCR方法为参照绘制ROC曲线,显示双重荧光定量PCR方法的曲线下面积达到0.966(P<0.001)和0.985(P<0.001),说明本方法具有很高的诊断价值;在最佳阈值下,双重荧光定量PCR检测猪链球菌的灵敏度和特异度达到89.6%和94.7%,检测猪链球菌2型的灵敏度和特异度达到100%和94%,基本满足临床样品检测对灵敏度和特异度的要求。
成功建立了一种灵敏、特异和稳定的双重荧光定量PCR方法,可同时及快速诊断猪链球菌和2型猪链球菌,非常适合大量临床样品的检测。但我们的研究也显示,在拷贝数低于普通PCR灵敏度的模板样品中,两方法的符合率只有54.5%和50%,这可能与普通PCR灵敏度低,容易出现假阴性有关,但也不能排除荧光定量PCR出现假阳性可能。要解决这一问题需要我们在下一步的研究中收集更多的临床样品进行平行检测,并引入第三种检测方法进行对比,探求荧光定量PCR方法在临床应用中Ct值的最佳阳性阈值,以获得最高灵敏度及特异度的平衡点。
4 结 论
成功建立灵敏、特异和稳定的双重荧光定量PCR方法,实现了猪链球菌和2型猪链球菌同时及快速诊断,此方法非常适合大量临床样品的检测,可应用于临床诊断和疫情监控,为诊断和防控猪链球菌病提供技术支持。
[1] GOYETTE-DESJARDINS G, AUGER J P, XU J G, et al.Streptococcussuis, an important pig pathogen and emerging zoonotic agent-an update on the worldwide distribution based on serotyping and sequence typing[J].EmergMicrobesInfect, 2014, 3(6): e45.
[2] GOTTSCHALK M, XU J G, LECOURS M P, et al.Streptococcussuisinfections in humans: what is the prognosis for Western countries? (Part II)[J].ClinMicrobiolNewslett, 2010, 32(13): 97-102.
[3] GOTTSCHALK M, SEGURA M, XU J G.Streptococcussuisinfections in humans: the Chinese experience and the situation in North America[J].AnimHealthResRev, 2007, 8(1): 29-45.
[4] WERTHEIM H F L, NGHIA H D T, TAYLOR W, et al.Streptococcussuis: an emerging human pathogen[J].ClinInfectDis, 2009, 48(5): 617-625.
[5] ARENDS J P, HARTWIG N, RUDOLPHY M, et al. Carrier rate ofStreptococcussuiscapsular type 2 in palatine tonsils of slaughtered pigs[J].JClinMicrobiol, 1984, 20(5): 945-947.
[6] MWANIKI C G, ROBERTSON I D, HAMPSON D J. The prevalence ofStreptococcussuistype 2 in Western Australian piggeries[J].AustVetJ, 1994, 71(11): 385-386.
[7] WISSELINK H J, SMITH H E, STOCKHOFE-ZURWIEDEN N, et al. Distribution of capsular types and production of muramidase-released protein (MRP) and extracellular factor (EF) ofStreptococcussuisstrains isolated from diseased pigs in seven European countries[J].VetMicrobiol, 2000, 74(3): 237-248.
[8] VECHT U, STOCKHOFE-ZURWIEDEN N, TETENBURG B J, et al. Virulence ofStreptococcussuistype 2 for mice and pigs appeared host-specific[J].VetMicrobiol, 1997, 58(1): 53-60.
[9] HIGGINS R, GOTTSCHALK M. An update onStreptococcussuisidentification[J].JVetDiagnInvest, 1990, 2(3): 249-252.
[10] NGA T V T, NGHIA H D T, TU L T P, et al. Real-time PCR for detection ofStreptococcussuisserotype 2 in cerebrospinal fluid of human patients with meningitis[J].DiagnMicrobiolInfectDis, 2011, 70(4): 461-467.
[11] MA E, CHUNG P H, SO T, et al.Streptococcussuisinfection in Hong Kong: an emerging infectious disease?[J].EpidemiolInfect, 2008, 136(12): 1691-1697.
[12] MESSIER S, LACOUTURE S, GOTTSCHALK M. Distribution ofStreptococcussuiscapsular types from 2001 to 2007[J].CanVetJ, 2008, 49(5): 461-462.
[13] OKURA M, LACHANCE C, OSAKI M, et al. Development of a two-step multiplex PCR assay for typing of capsular polysaccharide synthesis gene clusters ofStreptococcussuis[J].JClinMicrobiol, 2014, 52(5): 1714-1719.
[14] GOTTSCHALK M, LACOUTURE S, BONIFAIT L, et al. Characterization ofStreptococcussuisisolates recovered between 2008 and 2011 from diseased pigs in Quebéc, Canada[J].VetMicrobiol, 2013, 162(2-4): 819-825.
[15] LAKKITJAROEN N, TAKAMATSU D, OKURA M, et al. Capsule loss or death: the position of mutations among capsule genes sways the destiny ofStreptococcussuis[J].FEMSMicrobiolLett, 2014, 354(1): 46-54.
[16] LIU Z J, ZHENG H, GOTTSCHALK M, et al. Development of multiplex PCR assays for the identification of the 33 serotypes ofStreptococcussuis[J].PLoSOne, 2013, 8(8): e72070.
[17] KERDSIN A, DEJSIRILERT S, AKEDA Y, et al. FifteenStreptococcussuisserotypes identified by multiplex PCR[J].JMedMicrobiol, 2012, 61(Pt 12): 1669-1672.
[18] KERDSIN A, AKEDA Y, HATRONGJIT R, et al.Streptococcussuisserotyping by a new multiplex PCR[J].JMedMicrobiol, 2014, 63(Pt 6): 824-830.
[19] SMITH H E, VEENBERGEN V, VAN DER VELDE J, et al. Thecpsgenes ofStreptococcussuisserotypes 1, 2, and 9: development of rapid serotype-specific PCR assays[J].JClinMicrobiol, 1999, 37(10): 3146-3152.
[20] WANG K C, SUN X Q, LU C P. Development of rapid serotype-specific PCR assays for eight serotypes ofStreptococcussuis[J].JClinMicrobiol, 2012, 50(10): 3329-3334.
[21] WISSELINK H J, JOOSTEN J J, SMITH H E. Multiplex PCR assays for simultaneous detection of six major serotypes and two virulence-associated phenotypes ofStreptococcussuisin tonsillar specimens from pigs[J].JClinMicrobiol, 2002, 40(8): 2922-2929.
[22] BONIFAIT L, VEILLETTE M, LETOURNEAU V, et al. Detection ofStreptococcussuisin bioaerosols of swine confinement buildings[J].ApplEnvironMicrobiol, 2014, 80(11): 3296-3304.
[23] YANG W J, CAI X H, HAO Y Q, et al. Characterization ofStreptococcussuisserotype 2 blood infections using RT-qPCR to quantify glutamate dehydrogenase copy numbers[J].JMicrobiolMethods, 2010, 83(3): 326-329.
[24] KING S J, LEIGH J A, HEATH P J, et al. Development of a multilocus sequence typing scheme for the pig pathogenStreptococcussuis: identification of virulent clones and potential capsular serotype exchange[J].JClinMicrobiol, 2002, 40(10): 3671-3680.
[25] OKWUMABUA O, PERSAUD J S, REDDY P G. Cloning and characterization of the gene encoding the glutamate dehydrogenase ofStreptococcussuisserotype 2[J].ClinDiagnLabImmunol, 2001, 8(2): 251-257.
[26] OKWUMABUA O, O′CONNOR M, SHULL E. A polymerase chain reaction (PCR) assay specific forStreptococcussuisbased on the gene encoding the glutamate dehydrogenase[J].FEMSMicrobiolLett, 2003, 218(1): 79-84.
[27] SMITH H E, DE VRIES R, VAN′T SLOT R, et al. The cps locus ofStreptococcussuisserotype 2: genetic determinant for the synthesis of sialic acid[J].MicrobPathog, 2000, 29(2): 127-134.
[28] FITTIPALDI N, SEGURA M, GRENIER D, et al. Virulence factors involved in the pathogenesis of the infection caused by the swine pathogen and zoonotic agentStreptococcussuis[J].FutureMicrobiol, 2012, 7(2): 259-279.
[29] MARIE J, MORVAN H, BERTHELOT-HÉRAULT F, et al. Antimicrobial susceptibility ofStreptococcussuisisolated from swine in France and from humans in different countries between 1996 and 2000[J].JAntimicrobChemother, 2002, 50(2): 201-209.
[30] PADUNGTOD P, THARAVICHITKUL P, JUNYA S, et al. Incidence and presence of virulence factors ofStreptococcussuisinfection in slaughtered pigs from Chiang Mai, Thailand[J].SoutheastAsianJTropMedPublicHealth, 2010, 41(6): 1454-1461.
[31] 刘建涛,张 强,宋娅静,等. 猪链球菌2型表面蛋白分支酸合成酶通过p38MAPK和NF-κB通路促进TLR4依赖的炎性反应[J]. 畜牧兽医学报, 2014, 45(11): 1866-1873. LIU J T,ZHANG Q,SONG Y J,et al.Streptococcussuisserotype 2 protein aroc induces Toll-like receptor 4-dependent inflammatory responses in RAW264.7 via p38MAPK and NF-κB signaling[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(11): 1866-1873. (in Chinese)
[33] VAN CALSTEREN M R, GOYETTE-DESJARDINS G, GAGNON F, et al. Explaining the serological characteristics ofStreptococcussuisserotypes 1 and 1/2 from their capsular polysaccharide structure and biosynthesis[J].JBiolChem, 2016, 291(16): 8387-8398.
[34] OKURA M, TAKAMATSU D, MARUYAMA F, et al. Genetic analysis of capsular polysaccharide synthesis gene clusters from all serotypes ofStreptococcussuis: potential mechanisms for generation of capsular variation[J].ApplEnvironMicrobiol, 2013, 79(8): 2796-2806.
