厚朴总酚对金黄色葡萄球菌的抑菌作用及抗溶血作用
2018-03-13刘桂兰周永林李文华谢玲玲刘爱玲邓旭明
刘桂兰,周永林,李文华,谢玲玲,刘爱玲,邓旭明*
(1.吉林大学动物医学学院,长春 130062; 2.天津瑞普生物技术股份有限公司,天津 300300)
厚朴为木兰科木兰属植物厚朴或凹叶厚朴的干燥干皮、根皮和枝皮。为常用中药,列为中品,味辛、性温,具有行气化湿、温中止痛、降逆平喘等功效。厚朴在许多药方中都有出现,可见其在我国传统中药中的重要地位[1]。同时现代药理试验也证明了厚朴具有广谱抗菌、抗肿瘤、抗炎、抗溃疡、抗凝血、保护心脑血管及抑制吗啡戒断反应等重要作用。厚朴中的酚类为有效成分,厚朴总酚由9种酚类组成,其中以厚朴酚及和厚朴酚为主要成分[2-3]。在基于其众多药理功效的基础上,本次试验着重研究其在抗细菌感染方面的一些基础研究,并致力于厚朴总酚的药物产品转化。
近几年研究表明奶牛乳房炎的发病范围逐渐变广,发病率呈上升趋势,尤其以没有明显临床症状的隐形乳房炎最为严重[4]。乳房炎主要是由金黄色葡萄球菌、链球菌和大肠杆菌等病原菌感染所导致的,主要包括金黄色葡萄球菌、链球菌和大肠杆菌,动物中最先发现耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus, MRSA)感染是在患乳房炎的奶牛中。目前,国内外针对乳房炎主要是通过抗生素疗法,但随着乳房炎病原菌的耐药性产生(如MRSA),抗生素在肉品和奶制品中的残留等问题的出现,抗生素治疗已经不能作为唯一有效的治疗方法[5-7]。世界卫生组织也在特别强调药物使用的安全性,提倡回归自然,这都为非传统疗法,尤其是中草药疗法的制剂开发提供了良好的机遇[8]。
研究表明,多种中药制成的乳房灌注剂具有良好的抗金黄色葡萄球菌活性,在治疗临床型乳房炎过程中具有良好的效果[9]。此外,许多天然化合物可浓度依赖性地降低金黄色葡萄球菌α-溶血素的表达[10]。α-溶血素是一种攻击因子,若将α-溶血素注入皮内,能引起皮肤坏死,静脉注射则导致动物的迅速死亡。其作为金黄色葡萄球菌感染动物机体的主要毒力因子,金黄色葡萄球菌造成的乳房炎在发病过程中,α-溶血素起到主要的致病致炎作用。本试验研究了厚朴总酚对金黄色葡萄球菌的抗菌活性及其对金黄色葡萄球菌α-溶血素分泌的影响,通过直接抑制α-溶血素的最终表达量,降低金黄色葡萄球菌入侵乳房造成的毒性,再结合机体本身的免疫功能,最终成功地预防金黄色葡萄球菌感染造成的奶牛乳房炎发生,这从抗毒力策略角度去解决了实际问题。
1 材料与方法
1.1 菌株
金黄色葡萄球菌标准菌株USA300、ATCC 29213、ATCC 25923和BAA1707购自美国标准菌种保藏管理中心(ATCC),保存于-80 ℃。
1.2 试剂
厚朴总酚为本实验室制备(瑞普天津生物药业有限公司),抗α-溶血素多克隆抗体、辣根过氧化物酶标记二抗、ECL发光液和溶葡萄球菌素均购自美国Sigma-Aldrich公司;RNA提取试剂盒(Qiagen RNeasy Maxi column)购自德国Qiagen公司;反转录试剂盒(TaKaRa RNA PCR kit)和荧光定量PCR试剂盒(SYBR Premix ExTaqTM)购自TaKaRa公司。厚朴总酚溶解于DMSO中,制备成40 960 μg·mL-1的母液备用。
1.3 最小抑菌浓度的测定
最小抑菌浓度(minimal inhibitory concentration, MIC)试验用于验证金黄色葡萄球菌是否对厚朴总酚具有一定的敏感性,确定其是否具有抗菌活性。采用美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)推荐的肉汤微量稀释法测定厚朴总酚对金黄色葡萄球菌的MIC,苯唑西林作对照。
1.4 溶血试验
溶血试验是为确定厚朴总酚是否降低金黄色葡萄球菌α-溶血素的活性和作为进一步研究厚朴总酚保护由细菌感染造成细胞损伤的分子机制。挑取金黄色葡萄球菌USA300单菌落于2 mL MHB培养基中,200 r·min-1、37 ℃过夜培养,扩大培养至250 mL MHB培养基中至OD600 nm=0.3,加入不同亚抑菌浓度的厚朴总酚,于恒温摇床中继续培养(37 ℃,200 r·min-1)至平台期,每个处理组吸取1 mL样品,12 000 r·min-1离心1 min后收集上清。配制溶血体系,875 μL PBS缓冲液、100 μL培养物上清以及25 μL脱纤维兔血混合均匀后于37 ℃孵育15 min,离心收集上清并检测其吸光值(OD=543 nm)。
1.5 免疫印迹试验
为更直观地从蛋白质水平说明厚朴总酚可以降低α-溶血素的表达,采用蛋白质免疫印迹试验来进一步说明。取上述细菌培养物上清与上样缓冲液按照4∶1混匀后煮沸10 min。经12%聚丙烯酰胺凝胶电泳,分离后,按照金黄色葡萄球菌α-溶血素蛋白的大小切取胶,通过转膜仪转移至PVDF膜上,用5%的脱脂奶粉常温封闭2 h,用抗α-溶血素多克隆抗体孵育2 h和HPR标记的二抗孵育1 h,经ECL发光液处理后进行显影及胶片曝光。
1.6 荧光定量PCR试验
若蛋白质的表达量发生改变,很大程度上是影响了蛋白表达的某个过程,或影响α-溶血素蛋白表达的调控系统。荧光定量PCR试验可以在基因水平验证是否影响蛋白的表达[11]。金黄色葡萄球菌USA300在加入不同亚抑菌浓度厚朴总酚的MHB培养基中培养至OD600 nm=2.5。离心收集细菌(10 000 r·min-12 min,4 ℃),用含100 μg·mL-1溶葡萄球菌素的TES缓冲液重悬细菌,37 ℃水浴10 min,此后,按照试剂盒提取RNA,用TaKaRa RNA PCR kit(AMV)Ver.3.0试剂盒反转录得cDNA;荧光定量PCR引物如表1所示;用SYBR Premix ExTaqTM试剂盒在定量PCR扩增仪中进行扩增。循环参数为:95 ℃变性30 s,95 ℃ 5 s,53 ℃ 30 s,72 ℃ 30 s,反应体系为25 μL运行35个循环。以16S rRNA作为内参。结果分析采用ΔΔCt法。
表1 荧光定量PCR引物
Table 1 Primers used for RT-PCR
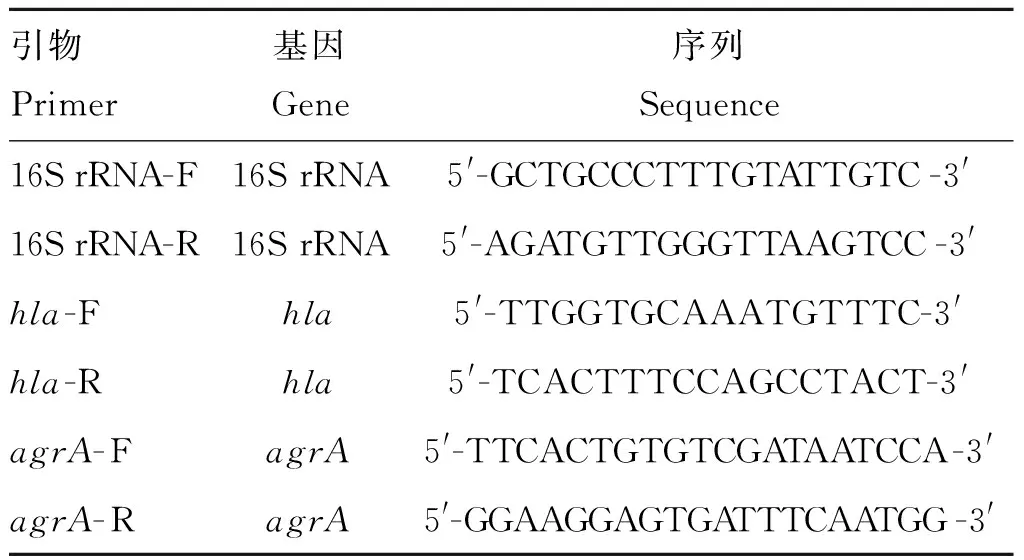
引物Primer基因Gene序列Sequence16SrRNA-F16SrRNA5'-GCTGCCCTTTGTATTGTC-3'16SrRNA-R16SrRNA5'-AGATGTTGGGTTAAGTCC-3'hla-Fhla5'-TTGGTGCAAATGTTTC-3'hla-Rhla5'-TCACTTTCCAGCCTACT-3'agrA-FagrA5'-TTCACTGTGTCGATAATCCA-3'agrA-RagrA5'-GGAAGGAGTGATTTCAATGG-3'
1.7 LDH释放试验
金黄色葡萄球菌感染动物可造成肺炎、伪膜性肠炎、心包炎和乳房炎等,甚至败血症、脓毒症等全身感染,乳腺上皮细胞用于细胞水平验证金黄色葡萄球菌的致病性和药物的保护效果。取生长状态良好的乳腺上皮细胞(本实验室保存),胰酶消化后重悬至1 mL的完全培养基中并稀释至1.5×105·mL-1,加入96孔板中,每孔100 μL,于培养箱中培养过夜。后加入重悬细菌和厚朴总酚,共培养5 h,离心收集细胞上清。配制并按照说明加入LDH试剂,避光反应30 min,酶标仪490 nm处测吸光值,计算LDH释放率。
1.8 统计分析
2 结 果
2.1 厚朴总酚对金黄色葡萄球菌的抗菌作用
由表2可知,厚朴总酚对金黄色葡萄球菌USA300的MIC为8 μg·mL-1,且其对甲氧西林耐药金黄色葡萄球菌(MRSA)(USA300和BAA1707)和甲氧西林敏感金黄色葡萄球菌(MSSA)(ATCC25923和29213)的MIC没有显著差异。
表2 厚朴总酚对金黄色葡萄球菌的最小抑菌浓度
Table 2 The MIC values of total magnolol againstS.aurues

菌株Strain来源OriginMIC/(μg·mL-1)苯唑西林厚朴总酚ATCC29213ATCC0.2516ATCC25923ATCC0.2516BAA1707ATCC1288USA300ATCC1288
2.2 亚抑菌浓度厚朴总酚抑制金黄色葡萄球菌培养物上清对兔红细胞的溶血活性和降低金黄色葡萄球菌α-溶血素的表达
如图1、表3所示,亚抑菌浓度的厚朴总酚能够抑制金黄色葡萄球菌溶血作用,且抑制呈现剂量依赖性。当厚朴总酚的浓度为4 μg·mL-1时,对ATCC 25923和USA300菌液上清抑制溶血活性效果非常明显,其溶血性仅为不加药对照组的3.47%和2.36%。厚朴总酚对金黄色葡萄球菌溶血素分泌的抑制作用与溶血活性试验结果相符合。在测试浓度范围内呈现剂量依赖性。当厚朴总酚的浓度达到4 μg·mL-1时,溶血素的分泌显著降低,两株标准金黄色葡萄球菌的培养物上清几乎检测不到α-溶血素(图2)。

图1 厚朴总酚对金黄色葡萄球菌培养物上清溶血活性的影响Fig.1 Impact of total magnolol on the hemolysis of S. aurues culture supernatants
2.3 厚朴总酚对金黄色葡萄球菌调控α-溶血素表达的hla和agrA基因转录的影响
荧光定量PCR实验考察厚朴总酚对hla和agrA转录水平的影响,结果如图3所示,加入不同浓度的厚朴总酚后,hla和agrA基因转录水平呈现剂量依赖性降低。
表3 亚抑菌浓度厚朴总酚对金黄色葡萄球菌培养物上清溶血活性的影响
Table 3 Impact of total magnolol on the hemolysis ofS.auruesculture supernatants

%
不加厚朴总酚的菌液上清溶血活性视为100%。*.P<0.05,**.P<0.01
The hemolytic activity of theS.auruesculture supernatant without total magnolol was considered as 100%.*.P<0.05,**.P<0.01
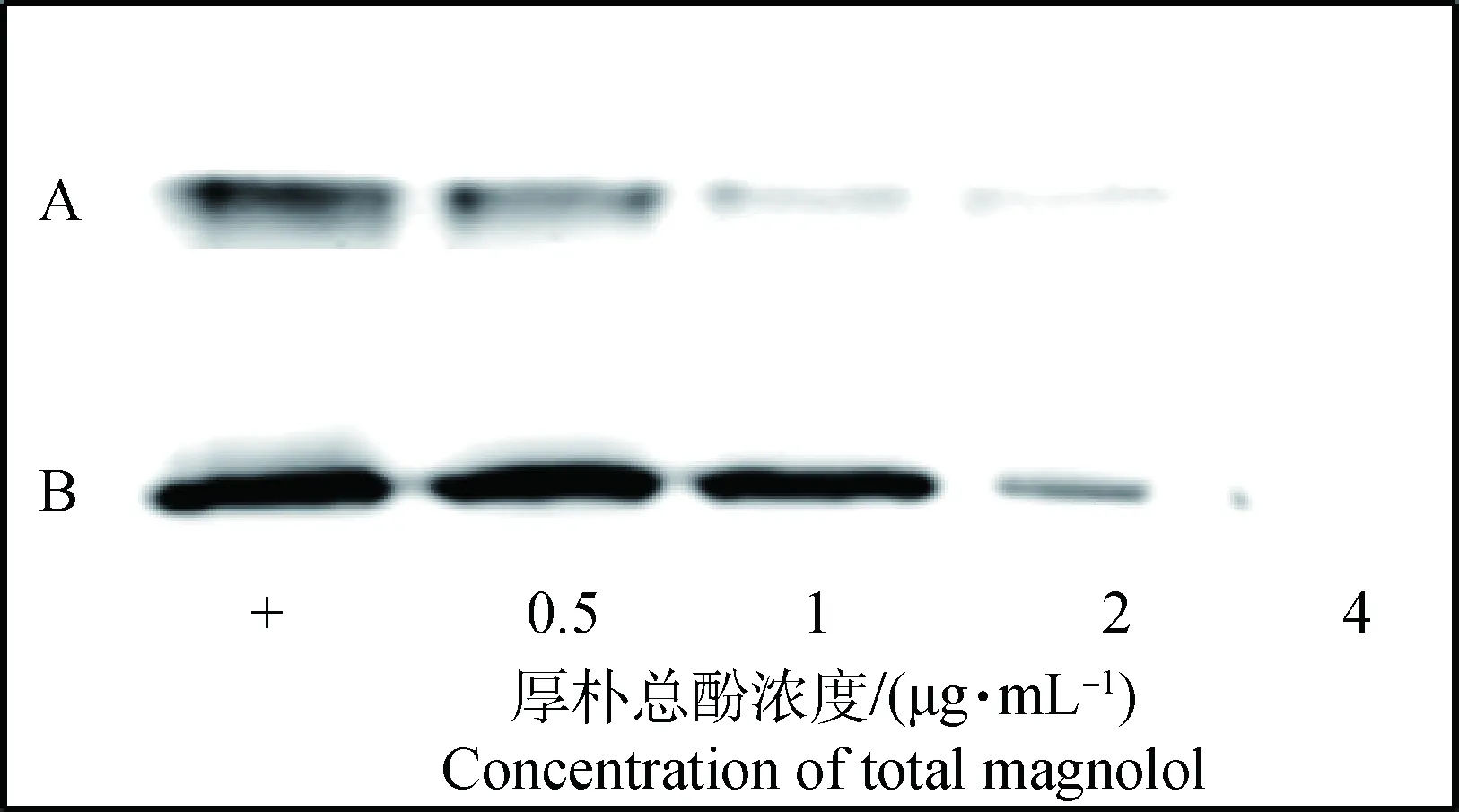
图2 厚朴总酚作用后ATCC 29213(A)和USA300(B)培养物上清中α-溶血素的免疫印迹分析Fig.2 Western blot analysis of α-hemolysin contents in the culture supernatants
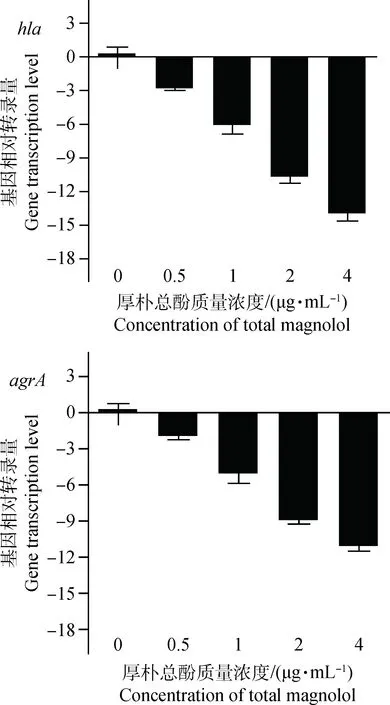
图3 金黄色葡萄球菌USA300 hla和agrA基因转录量Fig.3 Relative gene transcription of hla and agrA treated with total magnolol
2.4 厚朴总酚缓解金黄色葡萄球菌α-溶血素介导的细胞毒性作用
如图4所示,厚朴总酚(4 μg·mL-1)对乳腺上皮细胞无细胞毒性,在细菌与细胞共感染体系内加入厚朴总酚可极显著降低金黄色葡萄球菌α-溶血素介导的细胞毒性作用,且这一抑制作用呈明显剂量依赖性。
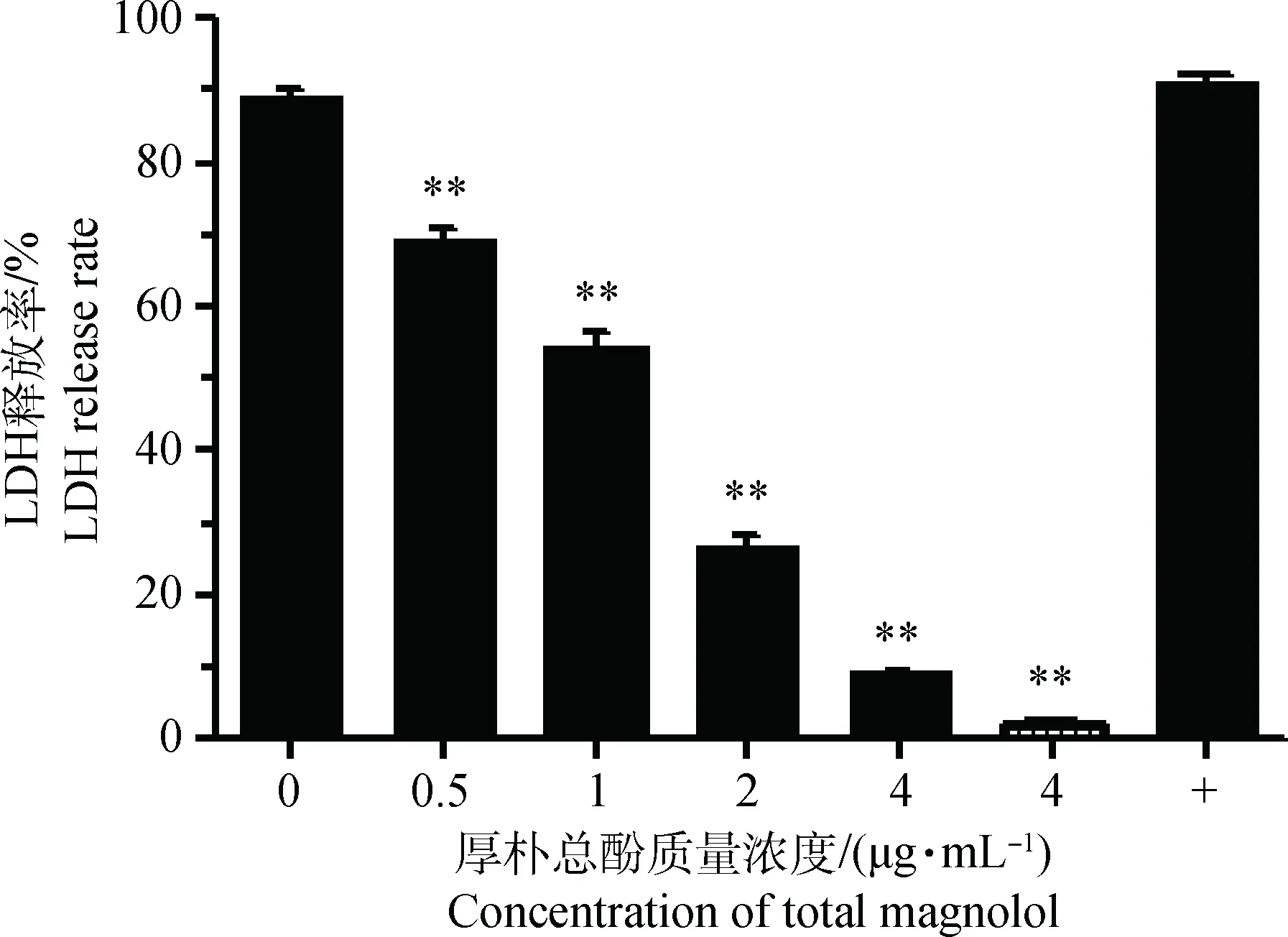

加入不同浓度厚朴总酚的金黄色葡萄球菌与乳腺上皮细胞共培养体系LDH释放率与细胞毒性,其中为厚朴总酚对乳腺上皮细胞的细胞毒性;*.P<0.05,**.P<0.01LDH release rate and cytotoxicity in co culture system of Staphylococcus aureus and mammary epithelial cells with different concentrations of total magnolol, indicates the cytotoxicity of total magnolon on mammary epithelial cells; *.P<0.05,**.P<0.01图4 LDH释放与细胞毒性Fig.4 LDH release and cell toxicity
3 讨 论
随着我国人民生活水平的提高,牛奶已经成为日常生活中不可或缺的一部分,但乳房炎已成为制约奶牛业发展的主要因素[12]。隐性乳房炎是奶牛乳房炎中发病率最高的一种,在我国隐性乳房炎的发病率高达20%~40%,甚至高达50%~80%,其临床不出现明显的症状,乳汁也无肉眼可见的异常,然而乳汁在理化性质及细菌学上已经发生变化,严重影响牛乳的质量[13]。隐性乳房炎较难及时发现和治疗,其中细菌,尤其是金黄色葡萄球菌感染是奶牛乳房炎的主要发病因素[14]。目前,国内外治疗奶牛乳房炎主要是应用传统的抗生素疗法,但随着乳房炎病原菌的耐药性产生,尤其是以金黄色葡萄球菌为主,抗生素治疗已经不能满足或不适宜防控乳房炎的发生[15]。
3.1 厚朴总酚对金黄色葡萄球菌抑菌作用
由厚朴总酚对金黄色葡萄球菌USA300的MIC结果可知,厚朴总酚具有一定的抗菌活性。相比与其他化学合成药物和抗生素,中药具有毒副作用低、吸收良好和药效广等优点[16-19]。这一结论提示,厚朴总酚可作为一种潜在的辅助性抗菌药物,在高剂量条件下可明显的起到抗菌活性。
3.2 厚朴总酚对金黄色葡萄球菌α-溶血素表达及其调控基因表达的影响
由溶血活性试验结果可知,当厚朴总酚的浓度为4 μg·mL-1时,厚朴总酚可抑制α-溶血素的溶血活性,进一步的荧光定量PCR试验结果表明厚朴总酚对hla和agrA基因的转录呈现剂量依赖性降低,α-溶血素表达基因和调控基因的转录水平受到厚朴总酚的抑制[20-24]。综上所述,厚朴总酚可抑制α-溶血素编码基因hla及其上游调控系统agrA基因的转录而降低α-溶血素的表达。
3.3 厚朴总酚对金黄色葡萄球菌α-溶血素介导的细胞毒性作用的干预效果
近年来,分子生物学的发展使得人们对于细菌的致病特性以及相关毒力因子结构和功能认识的不断加深,毒力因子已成为新型抗感染药物研发的重要靶标之一[25-27]。而各种细菌性毒力因子对于病原菌致病力的贡献不一,因此选择对致病菌致病机制不可或缺的毒力因子成为抗毒力策略的首选。金黄色葡萄球菌作为奶牛乳房炎的主要病原菌,其致病性主要依赖于一些分泌的毒力因子,如α-溶血素等[28]。本研究还发现亚抑菌浓度厚朴总酚处理可显著降低α-溶血素编码基因的转录和蛋白质表达,并明显缓解金黄色葡萄球菌α-溶血素介导的宿主细胞的细胞损伤作用,这一结果提示较低浓度厚朴总酚可通过抑制金黄色葡萄球菌毒力因子而发挥抗感染作用。
厚朴总酚可作为一种潜在的抗奶牛乳房炎的先导复合物,较高浓度可直接发挥抑菌或杀菌作用,较低浓度可通过抗毒力作用而发挥抗感染作用[29-31]。
4 结 论
厚朴总酚在高剂量和低剂量条件下均可发挥不同程度的抗金黄色葡萄球菌感染作用,可作为一种前景良好的药物更深层次去研究,本研究为后续厚朴总酚制成成品药的临床前期试验奠定了有价值的基础。
[1] 何可云, 董 志, 朱 毅. 厚朴酚与和厚朴酚的药理学研究现状[J]. 中成药, 2006, 28(5): 716-718. HE K Y, DONG Z, ZHU Y. Research of present situation Honokiol and Honokiol pharmacology[J].ChineseTraditionalPatentMedicine, 2006, 28(5): 716-718. (in Chinese)
[2] CHEN H Y, HUNG Y C, LEE E J, et al. The protective efficacy of magnolol in hind limb ischemia-reperfusion injury[J].Phytomedicine, 2009, 16(10): 976-981.
[3] 保志娟, 杨雪琼, 丁中涛, 等. 紫外分光光度法同时测定厚朴酚与和厚朴酚的含量及活性研究[J]. 天然产物研究与开发, 2004, 16(5): 435-438. BAO Z J, YANG X Q, DING Z T, et al. Simultaneous determination of magnolol and honokiol by UV spectrophotometry and study on free radical scavenger activity[J].NaturalProductResearchandDevelopment, 2004, 16(5): 435-438. (in Chinese)
[4] 王承南, 夏传格. 厚朴药理作用及综合利用研究进展[J]. 经济林研究, 2003, 21(3): 80-81. WANG C N, XIA C G. Research development ofMagnoliaofficinalismedication effect and multiple utilization[J].EconomicForestResearches, 2003, 21(3): 80-81. (in Chinese)
[5] MYLLYS V, ASPLUND K, BROFELDT E, et al. Bovine mastitis in Finland in 1988 and 1995—changes in prevalence and antimicrobial resistance[J].ActaVetScand, 1998, 39(1): 119-126.
[6] LEVISON L J, MILLER-CUSHON E K, TUCKER A L, et al. Incidence rate of pathogen-specific clinical mastitis on conventional and organic Canadian dairy farms[J].JDairySci, 2016, 99(2): 1341-1350.
[7] SHIH H C, WEI Y H, LEE C H, et al. Magnolol alters cytokine response after hemorrhagic shock and increases survival in Subsequent intraabdominal sepsis in rats[J].Shock, 2003, 20(3): 264-268.
[8] 吴维萍. 厚朴提取物对不同病原菌抑菌效果的研究[J]. 中国农村医学杂志, 2008, 6(4): 5-11. WU W P. Magnolia bark extract from the study of different pathogenic bacteria antibacterial effect[J].ChineseJournalofRuralMedicine, 2008, 6(4): 5-11. (in Chinese)
[9] RAGLE B E, WARDENBURG J B. Anti-alpha-hemolysin monoclonal antibodies mediate protection againstStaphylococcusaureuspneumonia[J].InfectImmun, 2009, 77(7): 2712-2718.
[10] SMITH-PALMER A, STEWART J, FYFE L. Influence of subinhibitory concentrations of plant essential oils on the production of enterotoxins A and B and alpha-toxin byStaphylococcusaureus[J].JMedMicrobiol, 2004, 53(Pt 10): 1023-1027.
[11] QIU J Z, FENG H H, LU J, et al. Eugenol reduces the expression of virulence-related exoproteins inStaphylococcusaureus[J].ApplEnvironMicrobiol, 2010, 76(17): 5846-5851.
[12] 张 彬, 薛 明, 崔 颖, 等. 新兽药消炎醌对乳牛乳腺炎临床治疗试验[J]. 中国兽医科技, 2000, 30(8): 28-29. ZHANG B, XUE M, CUI Y, et al. New veterinary decrease inflammation quinones medicine antiphlogistic quinone of dairy cow mastitis treatment of clinical trials[J].ChineseJournalofVeterinaryScienceandTechnology, 2000, 30(8): 28-29. (in Chinese)
[13] 路建彪, 刘文强. 奶牛乳房炎病原菌的分离与鉴定[J]. 中国兽医杂志, 2007, 43(1): 62-63. LU J B, LIU W Q. Pathogen isolation and identification of dairy cow mastitis[J].ChineseJournalofVeterinaryMedicine, 2007, 43(1): 62-63. (in Chinese)
[14] CHAFFER M, LEITNER G, WINKLER M, et al. Coagulase-negative staphylococci and mammary gland infections in cows[J].JVetMedB, 1999, 46(10): 707-712.
[15] 王志强, 宓 伟, 刘现兵, 等. 厚朴体外抑菌作用研究[J]. 时珍国医国药, 2007, 18(11): 2763. WANG Z Q, MI W, LIU X B, et al. Theinvitrogrowth-inhibitory effect ofMagnoliaofficinalisrehd. et wils. (MOR) on bacteria[J].LishizhenMedicineandMateriaMedicaResearch, 2007, 18(11): 2763. (in Chinese)
[16] BASELGA R, ALBIZU I, DE LA CRUZ M, et al. Phase variation of slime production inStaphylococcusaureus: implications in colonization and virulence[J].InfectImmun, 1993, 61(11): 4857-4862.
[17] WANG J P, RAUNG S L, CHEN C C, et al. The inhibitory effect of magnolol on cutaneous permeability in mice is probably mediated by a nonselective vascular hyporeactivity to mediators[J].NaunynSchmiedebergsArchPharmacol, 1993, 348(6): 663-669.
[18] 寇 芮. 动物源耐甲氧西林金黄色葡萄球菌耐药性分析及分子流行病学研究[D]. 南京: 南京农业大学, 2010. KOU R. Study on antibiotic resistance analysis and molecular epidemiology of methicillin-resistantStaphylococcusaureusfrom animals[D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese)
[19] 胡付品, 朱德妹, 汪 复, 等. 2013年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2014, 14(5): 369-378. HU F P, ZHU D M, WANG F, et al. CHINET 2013 surveillance of bacterial resistance in China[J].ChineseJournalofInfectionandChemotherapy, 2014, 14(5): 369-378. (in Chinese)
[20] SAITO J, SAKAI Y, NAGASE H.Invitroanti-mutagenic effect of magnolol against direct and indirect mutagens[J].MutatRes, 2006, 609(1): 68-73.
[21] LI N, SONG Y, ZHANG W Z, et al. Evaluation of theinvitroandinvivogenotoxicity of magnolia bark extract[J].RegulToxicolPharmacol, 2007, 49(3): 154-159.
[22] SAITO J, SHIBUYA K, NAGASE H, et al. Anti-clastogenic effect of magnolol on benzo(a)pyrene-induced clastogenicity in mice[J].FoodChemToxicol, 2008, 46(2): 694-700.
[23] WANG J, ZHOU X, LIU S, et al. Morin hydrate attenuatesStaphylococcusaureusvirulence by inhibiting the self-assembly of α-hemolysin[J].JApplMicrobiol, 2015, 118(3): 753-763.
[24] 陈勇川, 谢林利, 熊丽蓉, 等. 黄芩苷/黄芩素对耐甲氧西林金黄色葡萄球菌抗药性的逆转作用研究[J]. 中国药房, 2008, 19(9): 644-646. CHEN Y C, XIE L L, XIONG L R, et al. Reverse effect of baicalin/baicalein on antibiotic resistance of methicillin-resistantStaphylococcusaureus[J].ChinaPharmacy, 2008, 19(9): 644-646. (in Chinese)
[25] BERUBE B J, WARDENBURG J B.Staphylococcusaureusα-toxin: nearly a century of intrigue[J].Toxins, 2013, 5(6): 1140-1166.
[26] QIU J Z, NIU X D, DONG J, et al. Baicalin protects mice fromStaphylococcusaureuspneumonia via inhibition of the cytolytic activity of α-hemolysin[J].JInfectDis, 2012, 206(2): 292-301.
[27] PAPA R, ARTINI M, CELLINI A, et al. A new anti-infective strategy to reduce the spreading of antibiotic resistance by the action on adhesion-mediated virulence factors inStaphylococcusaureus[J].MicrobPathog, 2013, 63: 44-53.
[28] IKEMOTO S, SUGIMURA K, YOSHIDA N, et al. Antitumor effects ofScutellariaeradixand its components baicalein, baicalin, and wogonin on bladder cancer cell lines[J].Urology, 2000, 55(6): 951-955.
[29] SUGA H, SMITH K M. Molecular mechanisms of bacterial quorum sensing as a new drug target[J].CurrOpinChemBiol, 2003, 7(5): 586-591.
[30] BARON C. A novel strategy to target bacterial virulence[J].FutureMicrobiol, 2013, 8(1): 1-3.
[31] IWAO Y, TAKANO T, HIGUCHI W, et al. A new staphylococcal cassette chromosomemecIV encoding a novel cell-wall-anchored surface protein in a major ST8 community-acquired methicillin-resistantStaphylococcusaureusclone in Japan[J].JInfectChemother, 2012, 18(1): 96-104.
