基于DWI的肝癌栓塞早期疗效定量评估软件的设计及应用
2018-03-13任芳常英娟潘奇王珂王虹任静
任芳,常英娟,潘奇,王珂,王虹,任静
1.第四军医大学第一附属医院 放射科,陕西 西安 710032;2.西安医学院第二附属医院 影像科,陕西 西安 710038
引言
磁共振弥散加权成像(Magnetic Resonance Diffusion Weighted Imaging,MR-DWI)是目前能在活体上进行水分子扩散测量与成像的唯一方法,可以反映组织微观结构和功能的改变,在一定程度上可分析肝癌的细胞密度、核浆比及癌周浸润情况,在肝癌诊断和疗效评估上已经获得越来越多的认可[1-2]。由DWI计算出的表观扩散系数(Apparent Diffusion Coeffcient,ADC)表示水分子移动的自由度,肝癌组织在DWI多呈高信号,ADC值明显降低,且肝癌恶性程度与其ADC值相关,栓塞治疗后ADC值的升高在一定程度上反映了肝癌细胞的坏死[3-4]。
对于肝癌栓塞治疗前后的DWI图像和ADC值,临床上只能进行主观分析,很大程度上依赖医生的临床经验,缺乏客观的定量评估方法。DWI图像提供了可供进一步分析的丰富信息和数据,因此临床迫切需要可靠的图像后处理技术来弥补影像设备和成像中的不足,从而获得常规方法无法得到的深层信息。
MATLAB是美国MathWorks公司出品的主要用于算法开发、数据分析以及数值计算的高级技术计算语言和交互式环境。经过不断地改进和完善,MATLAB已经具备了超强的数据计算、图像处理和用户界面制作的功能。同时,它拥有对DICOM格式图像进行读取、分析和存储的函数,从而大大简化对医学图像处理的难度和复杂度。在MATLAB环境下开发的医学功能成像分析软件(Medical Functional Imaging Analysis,MedFIA)可以对比治疗前后的肝癌组织内每个像素的ADC值,还可以绘制治疗前后ADC值直方图和疗效彩色图谱,从而客观地反映肿瘤组织治疗前后的改变,及时准确地评估疗效,为临床提供更加直观、全面的分析信息;对患者下一步治疗方案的选择和预后评估具有至关重要的意义[5-6]。而且,软件界面友好和操作方便等优点便于临床工作者在日常工作中使用。
1 软件设计
1.1 MedFIA评估软件界面设计
MedFIA评估软件界面设计原则:主界面及子界面在排版样式上统一,与传统风格一致,对所有控件的位置和大小进行合理布局,保证清晰、简单地体现出界面的功能和特征。使用用户所熟悉的格式及标志,使用户自学入门,尽快掌握操作方法[7]。
1.2 系统构架设计
MedFIA评估软件分析流程图,见图1。首先,分别获取治疗前后的高低b值弥散图像;第二步,对治疗前后图像进行刚性配准以及病变分割[8];第三步,分别计算病变治疗前ADC值和治疗后ADC值并绘制其ADC值直方图;第四步,计算病变中每个像素在治疗前后的ADC变化值,同时绘制其直方图;第五步,根据用户输入的上下限阈值,将直方图分类并计算分类统计数据。

图1 MedFIA评估软件分析流程图
2 MedFIA评估软件功能
该软件主要实现的功能包括:图像读取、病变的配准和分割、ADC值计算、直方图绘制、治疗前后对比、疗效彩图显示、定量数据计算以及数据保存。各功能具体介绍如下:
(1)病变配准。尽管同一病人术前术后磁共振检查选择同样的视野(Filed of View,FOV),但是病人位置的不同以及呼吸带来的病变位移会导致病变在术前术后图像中位置不同。位置的不同又会导致结果分析的不准确。因此,图像预处理的第一步为图像配准。由于病变不存在变形和旋转,所以配准只需校正位置的变化[9]。
(2)病变分割。该软件的分割方式为半自动分割,分为以下3步。第一步:手动选取感兴趣区域(Region of Interest,ROI),进行病变的粗略选取;第二步:阈值分割,选择合适的阈值区分病变与正常组织[10];第三步:形态学分割,去除正常组织并且保留完整的病变[10]。
(3)ADC值计算。输入b值后,利用公式计算病变每个像素的ADC值[11],其中S代表DWI信号强度,b代表选取的b值,high为高b值,low为低b值。

(4)直方图绘制。计算病变内每个ADC值的频率,分别绘制治疗前后的ADC值直方图。直方图可以直观的显示ADC值的范围和分布情况。
(5)治疗前后对比。对比病变内的每一个像素在治疗前后的ADC值变化,量化治疗效果[12-13]。
(6)疗效彩图显示。将ADC变化值转化成色阶并覆盖在解剖图像上,更加直观地显示治疗效果[12-13]。
(7)定量数据计算。根据用户输入的阈值计算并显示ADC变化值分类统计数据[14]。
3 临床应用
目前,针对采取动脉内栓塞治疗的肝癌患者,预测其治疗效果常用的方法是观察肿瘤体积大小、组织密度的变化[15-16]。但是,肝癌组织密度在治疗前后变化一般不明显,而要出现明显的体积大小变化一般需要数月或者更长时间,时间对于此类病人至关重要,早期的疗效评估对后期治疗方案的选择及预后判断有重要意义[15-16]。
磁共振弥散成像相对快速、无创、敏感等特点使之成为大部分肝癌患者优先选择的检查项目,也是MedFIA评估软件用于早期治疗效果分析的基础数据。我们开发的MedFIA评估软件已经通过两名有经验的放射科医生对20例肝癌栓塞治疗的患者进行了临床验证:首先通过西门子工作站在肝癌栓塞治疗前后的肿瘤最大层面图像上画出圆形或类圆形ROI,使其尽量包括全部病灶。然后再将获取的平均ADC值与该软件计算出的肿瘤区域平均ADC值进行比较,两者的平均ADC值相似程度超过95%。初步证明该软件计算所得结果准确可信,可用于肝癌栓塞治疗患者的早期疗效评估。依据DWI即可对每位患者治疗前后的ADC值进行对比分析,并绘制出ADC变化值直方图,便于观察其整体变化趋势[5-6]。图2和图3可以看到基于像素分析的ADC值栓塞治疗后明显升高,按照预先设定的色阶分类ADC变化阈值(±160×10-6mm2/s)计算,红色代表治疗后ADC值明显升高的肝癌组织所占比例(67.92%),绿色代表ADC值无明显变化(22.73%),蓝色代表ADC值明显降低(9.35%)。ADC变化值直方图,见图2。图中显示肝癌栓塞治疗后ADC值整体升高,提示肝癌组织有明显坏死,治疗可能有效。ADC变化值彩色图谱及分类统计结果,见图3。图片根据彩色图谱还可以分析肝癌组织内每个像素点对治疗的反应情况:哪些部分ADC升高明显,提示该部位肝癌组织坏死明显,对治疗敏感程度也就一目了然。临床医生可以参考这些结果,拟定更为科学的后续治疗措施,做到有的放矢。分类统计数据将ADC值变化按升高、未变化、降低进行分类统计,进一步对治疗效果进行量化表示,更加直观地显示治疗前后肝癌组织ADC值的变化[5-6]。

图2 ADC变化值直方图
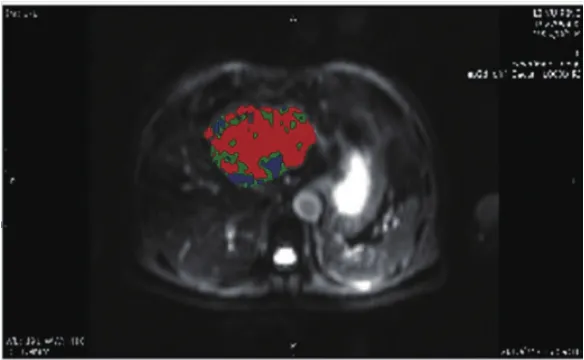
图3 ADC变化值彩色图谱及分类统计结果
4 结论
随着计算机及图像后处理技术的迅速发展,使得该技术广泛的应用于医学领域,为数字医疗开创了新时代。借助数字图像处理技术,可以获得更清晰、更准确的诊断结果。我们自主开发的MedFIA评估软件,主要基于二维磁共振弥散图像计算肝癌患者栓塞治疗前后ADC值的变化,量化评估其早期栓塞治疗的效果,通过临床验证和与相关文献报道比对,其重复性、稳定性和准确率均较高,完全能满足临床需求[14-16]。当然与国外售价高昂的同类软件相比,尚存在一定差距:比如病变的三维数据分析和显示,更多定量参数的获取等。另外该软件也需要在更多肝癌栓塞治疗病例中去应用,并结合组织病理变化和最终临床疗效进行深入验证与评估。总之,以肝癌为代表的肿瘤患者的DWI图像分析与后处理技术具有很大的应用优势和前景,不仅有利于提高临床诊断的准确性,也能快速、准确地判断临床疗效和预后,值得我们进一步去探索。
[1]段宏伟,张振勇,刘学平.磁共振扩散加权成像对肝癌的诊断价值[J].中国实用医药,2012,7(18):85-86.
[2]Gluskin JS,Chegai F,Monti S,et al.Hepatocellular carcinoma and diffusion-weighted MRI: detection and evaluation of treatment response[J].J Cancer,2016,7(11):1565-1570.
[3]武丽芳,颜竹芸,徐鹏举,等.ADC值变化率早期预测肝细胞癌(≤5.0 cm) TACE疗效的价值[J].放射学实践,2016,31(3):245-251.
[4]高回青,郁义星,胡春洪,等.弥散加权成像联合普美显磁共振成像在肝癌TACE术后疗效评估中的应用[J].介入放射学杂志,2016,25(9):774-778.
[5]Bonekamp S,Jolepalem P,Lazo M,et al.Hepatocellular carcinoma: response to TACE assessed with semiautomated volumetric and functional analysis of diffusion-weighted and contrast-enhanced MR imaging data[J].Radiology,2011,260(3):752-761.
[6]Li Z,Bonekamp S,Halappa VG,et al.Islet cell liver metastases:assessment of volumetric early response with functional MR imaging after transarterial chemoembolization[J].Radiology,2012,264(1):97-109.
[7]赵彩云,张永寿,赵晓辰.医学图像处理系统的设计与实现[J].中国医学装备,2014,11(2):45-47.
[8]Chapiro J,Lin M,Duran R,et al.Assessing tumor response after loco-regional liver cancer therapies: the role of 3D MRI[J].Expert Rev Anticancer Ther,2015,15(2):199-205.
[9]邓兵华,张明.Matlab环境下图像配准方法[J].电子科技,2014,27(1):139-141.
[10]李越.MATLAB在医学图像分割处理中的应用[J].价值工程,2015,34(28):191-194.
[11]Bharwani N,Koh DM.Diffusion-weighted imaging of the liver:an update[J].Cancer Imaging,2013,13(2):171-185.
[12]Corona-Villalobos CP,Halappa VG,Bonekamp S,et al.Functional magnetic resonance imaging response of targeted tumor burden and its impact on survival in patients with hepatocellular carcinoma[J].Invest Radiol,2015,50(4):283-289.
[13]Sobhani F,Xu C,Murano E,et al.Hypo-vascular liver metastases treated with transarterial chemoembolization: assessment of early response by volumetric contrast-enhanced and diffusion-weighted magnetic resonance imaging[J].Transl Oncol,2016,9(4):287-294.
[14]Bonekamp S,Li Z,Geschwind JF,et al.Unresectable hepatocellular carcinoma: MR imaging after intraarterial therapy. Part Ⅰ. Identification and validation of volumetric functional response criteria[J].Radiology,2013,268(2):420-430.
[15]Chapiro J,Wood LD,Lin M,et al.Radiologic-pathologic analysis of contrast-enhanced and diffusion-weighted MR imaging in patients with HCC after TACE: diagnostic accuracy of 3D quantitative image analysis[J].Radiology,2014,273(3):746-758.
[16]Bonekamp S,Halappa VG,Geschwind JF,et al.Unresectable hepatocellular carcinoma: MR imaging after intra-arterial therapy. Part Ⅱ. Response stratification using volumetric functional criteria after intraarterial therapy[J].Radiology,2013,268(2):431-439.
