经颅磁刺激在意识障碍中的应用综述
2018-03-13王勇白洋夏小雨杨艺何江弘李小俚
王勇,白洋,夏小雨,杨艺,何江弘,李小俚
1.燕山大学 电气工程学院,河北 秦皇岛 066004;2.陆军总医院附属八一脑科医院 神经外科,北京 100007;3.北京师范大学 认知神经科学与学习国家重点实验室,北京 100875
引言
目前,严重颅脑损伤导致的意识障碍(Disorder of Consciousness,DOC)的诊断和治疗十分困难。临床缺乏有效的诊断方法和治疗手段,从而无法做出准确的预后结果,进而治疗策略的制定也受到影响,严重影响患者的康复。意识障碍的神经调控和意识评估的研究较少,而且研究成果无法及时应用于临床实践。本文旨在概述相关研究成果,介绍经颅磁刺激的神经调控作用以及经颅磁刺激和脑电图联合技术(Combination of Transcranial Magnetic Stimulation and Electroencephalography,TMS-EEG)评估意识水平的作用。
1 意识障碍的诊疗现状简介
意识障碍的临床诊断分类主要包括植物状态/无反应觉醒综合症和微意识状态(Minimally Conscious State,MCS)。目前在临床实践中,诊断方法和治疗手段的缺乏直接影响了患者的评估和预后。临床现有的评估方法,主要依赖患者的临床行为评分,误诊率高达40%[1]。为提高诊断准确率,临床工作者引进了很多先进技术,比如EEG。功能核磁共振(Function Magnetic Resonance Imaging,fMRI)等。这些技术在意识诊断中不断发挥重要作用。临床中,针对意识障碍患者的治疗方式虽然很多,包括药物、高压氧、康复治疗等,但是治疗效果并不显著。电刺激技术,比如脊髓电刺激和脑深部电刺激,在意识障碍的治疗过程中取得明显效果。但是这些治疗手段也存在缺点:创伤性大并且治疗费用较高。近年来,无创神经调控技术越来越受到神经科学和康复医疗领域的重视,相关研究揭示了某些大脑结构或者神经元活动与认知或者运动功能之间的相关性[2]。最常用无创神经调控技术有:重复经颅磁刺激(Repetitive Transcranial Magnetic Stimulation,rTMS) 和 经 颅 电 刺激(Transcranial Direct Current Stimulation,tDCS)。 其 中rTMS的发展尤为迅速。rTMS在其他神经精神疾病领域的调控效果显著,并于最近开始应用于意识障碍领域。经颅磁刺激技术不仅可以无创调控大脑皮层,还能结合EEG作为一种新型检测手段,即TMS-EEG。TMS-EEG在意识障碍的应用,能够为意识障碍的意识水平和神经调控效果做出客观判断,从而辅助医务人员判断患者预后和制定治疗策略。
2 TMS-EEG评估意识水平
EEG是临床中常用的神经功能检测技术,EEG记录神经元的电活动,能够无创伤地记录整个大脑表层的瞬时和事件相关的大脑活动[3]。TMS-EEG是近几年发展起来的皮层状态检测技术[4]。TMS-EEG能够直接检测TMS刺激下的大脑活动,单脉冲TMS引起的大脑活动可以用TMS诱发电位(TMS Evoked Potential,TEP)来检测[5]。TEP检测包括:①皮层兴奋性:TEP是TMS刺激后持续大约300 ms且包含不同延迟成分的波动,并且这些波动代表大量神经元突触细胞的兴奋和抑制活动的总和[6];② 大脑有效连接性:通过源定位分析TEP的延迟的皮层分布能够定义从刺激区域到自动连接区域的传播方向[7]。
基于TEP的特征,研究记录了从清醒到睡眠状态的TMS-EEG,研究发现单脉冲TMS引起的大脑EEG反应跟意识水平相关,即从清醒到睡眠,随着意识水平的降低,TMS-EEG记录到的大脑诱发活动越来越弱[8]。根据这些发现,TMS-EEG开始被用于意识障碍的意识评估。研究发现,TMS在植物状态(Vegetative State,VS)患者大脑中诱发单一、局部的EEG反应,这表明植物状态患者大脑连接性中断。该发现与睡眠和麻醉状态的EEG反应类似。相反,TMS在微意识状态(Minimally Conscious State,MCS)患者大脑中可以诱发复杂、全脑的EEG反应,这跟清醒状态的EEG反应类似。因此,通过TMS-EEG测量皮层特性可以区分植物状态、微意识状态和闭锁综合征(Locked-In Syndrome,LIS)(图1)[9]。尤其是,在意识障碍患者意识恢复过程中,长期的TMS-EEG监控能够在早期发现患者大脑连接性的明显增强,并且早于临床行为改善的发生[9]。因此,TMS-EEG可以评估意识障碍的意识水平,并且可以长时程地监测意识恢复的过程。研究人员为了准确量化TEP,从中挖掘有关于大脑信息的整合和不同脑区的反应差异设计了一种稳定的基于理论的意识表征参数,叫做扰动复杂性指数(Perturbational Complexity Index,PCI)。PCI能够在个体水平区分有意识和无意识,清醒状态、微意识状态的PCI值在0.3以上,而深度睡眠和植物状态的PCI值在0.3以下[10-11]。但是仍需要相关研究验证PCI能够量化意识障碍患者的意识水平。

图1 12名意识障碍患者的TMS诱发电位
3 rTMS在意识障碍神经调控领域的应用
TMS基于电磁感应原理在大脑中形成足够剂量的电场,能够去极化神经元[12],达到调节皮层兴奋性的效果。在神经精神类疾病领域,rTMS是一种有效的无创调控手段。然而rTMS 应用于意识障碍领域的研究很少[13]。最近的研究报道,MCS患者在接受3次20 Hz rTMS治疗后出现明显的肢体行为改善,从而证明rTMS可能改善MCS患者的意识水平[14]。Manganotti等[15]的研究报道,6名患者(包括MCS和VS),接受单次20 Hz rTMS的治疗,结果发现一名MCS临床和脑电均表现出显著的改善。Naro等[16]研究报道10 Hz rTMS 刺激患者背外侧前额叶区,3名MCS患者和VS患者的临床表现改善明显。而且30次治疗后,VS患者神经性行为变化水平提高[17]。
最近Bai等[18]在rTMS对意识障碍的神经调控方面做了积极的尝试,研究中16名意识障碍患者(包括5名微意识状态和11名植物状态)接受10 Hz rTMS治疗,治疗部位为背外侧前额叶,治疗持续20 d。每天治疗包括1000个TMS脉冲,分为10次进行,每次持续10 s,间隔60 s,刺激强度为90%的相对运动阈值。治疗使用带有8字线圈的英国Magstim 公司R2型号TMS设备。刺激强度为相对静息状态运动阈值,运动阈值为静息状态下能够诱发右手第一骨间背侧肌处大于50 μV峰峰值的最小TMS脉冲强度。研究使用TMS-EEG和CRS-R量表评分,评估rTMS的治疗效果。研究结果发现5名MCS和11名VS中的4名患者的CRS-R评分均有提高,但是MCS比VS患者提高明显。而且治疗前后,VS患者大脑的TEP变化并不明显,TEP波形简单,变化趋势缓慢,而MCS患者大脑的TEP波形复杂,包含很多成分。特别地,一名患者接受20 d 10 Hz rTMS治疗后,出现明显的临床进步,CRS-R评分从8分升到13分,意识水平从MCS-恢复到MCS+,脑电评估结果也明显提高:患者TEP波形更加复杂,成分增多,PCI提高到0.3以上。而且意识的整合和分化理论说明rTMS对患者有着积极的调控作用。因此rTMS 作为意识障碍治疗手段存在可行之处,rTMS在DOC的相关研究,见表1[14-20]。
4 TMS-EEG评估神经调控对意识障碍的调控效果
TMS-EEG不仅仅研究皮层的输出而且提供皮层状况的额外信息。通过分析TEP的延迟,振幅以及TEP的分布和波形变化,可以更深层次地研究皮层兴奋性。研究人员将TEP作成类似MEP(Motion Evoked Potential)的量化指标,从而能够研究运动区以外的脑区,分析TMS刺激下皮层的脑电变化。无创调控技术诱导大脑可塑重建,表现为引起目标脑区的皮层活动瞬时变动,从而引起较远脑区甚至全脑的兴奋性变化[21-22]。研究人员为了确定全脑和局部的皮层兴奋性通常利用以下方法:① 单一电极的局部TEP;② 全脑平均场强度(Global Mean Field Amplitude,GMFA)表示的全脑TEP平均值;③ TMS诱发波形—全脑TEP。
4.1 TMS-EEG评估rTMS调控效果
TMS-EEG作为评估手段,评估rTMS调控效果的研究很少。Esser等[23]的研究中使用5 Hz rTMS刺激健康被试的M1区,并记录刺激前后的TMS-EEG,源定位结果显示,前运动区被激活,表明M1区和前运动的连接增强。而且与假刺激相比,全脑的TEP在刺激后明显增强。Helfrich等[24]的研究中使用1Hz rTMS刺激多动症儿童M1区,研究发现与皮层抑制相关的TEP成分减少。这两项研究说明TMS-EEG能够提供证据,证明rTMS能够调控皮层特性。然而,没有研究使用TMS-EEG评估rTMS在意识障碍的调控效果。近期,Bai等[18]的研究弥补了TMS-EEG评估在这个领域的空白。研究中,一名意识障碍患者的背外侧前额叶接受10 Hz rTMS调控,连续20 d。并在第一天调控前后(T0、T1),和20 d调控结束后(T2),利用TMS-EEG检测患者皮层状况。结果显示,与健康对照相比,T0时患者的GMFA反映的EEG成分比较简单,只包括35 ms的波峰和60 ms的波谷。T1比T0的GMFA表现更多EEG反应,而T2比T1的GMFA成分的波幅更加复杂。特别地,T2时患者的GMFA与健康对照类似。3个时间段的TEP波形图表现为,T0和T1的波形的时间分布类似,而与T2差异很大。TEP的源定位通过进行非参数统计表示显著兴奋区域的分布情况,其中黑色区域表示刺激引起的皮层兴奋区域,发现T0-T1-T2的兴奋性分布表现出从局部到全脑,从单侧到对侧的趋势(图2[18])。量化TEP的PCI结果说明,首次rTMS治疗后,PCI从0.27增到0.30,而20 d治疗结束后,PCI增到0.37。即该患者从植物状态恢复到微意识状态。该研究是首次基于TME-EEG特征探索rTMS在意识恢复过程中的调控作用。研究暗示TMS-EEG是一种有效工具,可以评估rTMS在意识障碍的调控效果。
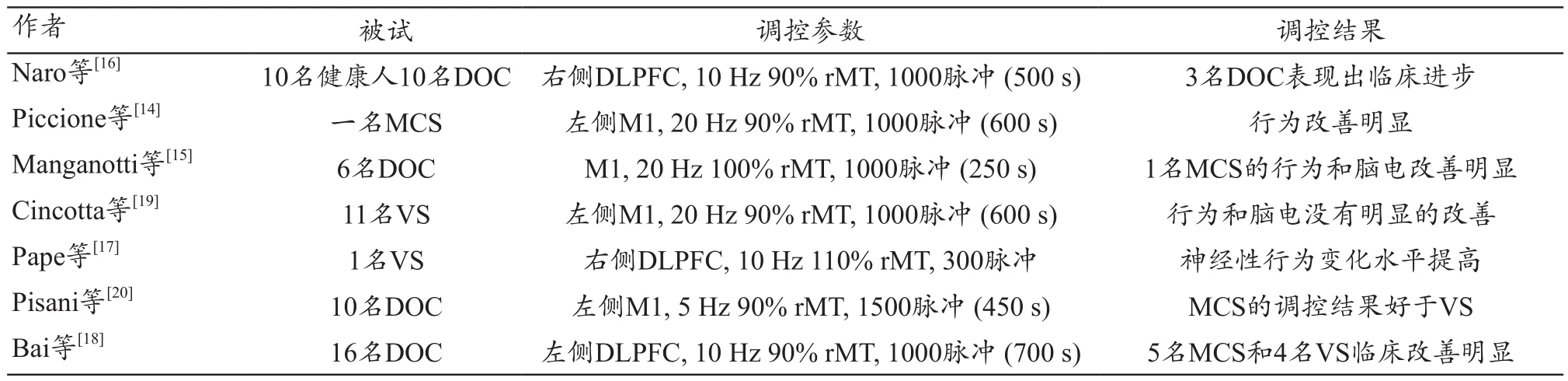
表1 rTMS在DOC的相关研究
4.2 TMS-EEG评估其他手段调控效果
tDCS作为另一种无创神经调控手段不仅可以调控正常大脑的皮层兴奋性[25],而且应用于一些神经性和精神类脑疾病的研究中。而在意识障碍的研究中,Naro等[26]发现tDCS能够提高MCS患者大脑的皮层兴奋性和连接性,而且发现tDCS对皮层连接性的调控结果的差异,可以区分不同意识状态[27]。Thibaut等[28-30]的研究也发现类似的结果,tDCS能够瞬时提高MCS患者的意识水平。Huang等[31]的研究认为,tDCS在MCS患者前额叶比后顶叶的调控效果好。Cavaliere等[32]利用静息态fMRI验证了tDCS能够改善MCS患者的临床表现。而Lauro等[25]的研究发现,tDCS虽然能够诱发出VS状态患者的一些意识相关临床表现,但是并不能显著提高VS状态患者的意识水平。Estraneo等[33]的研究发现重复tDCS并不能引起持续性DOC患者临床和脑电的短期变化。Bai等[34]在tDCS在意识障碍的应用也做了相关研究。16名意识障碍患者参与研究,包括9名VS和7名MCS(6名女性和10名男性)。tDCS调控范式为,刺激电流2 mA,刺激时间20 min,阳极放置在背外侧前额叶,阴极放置在眼眶上方。单次tDCS调控后,使用TMS-EEG在4个时间段检测皮层兴奋性(0~100,100~200,200~300,300~400 ms)。然后选取兴奋性变化显著的时间段进行局部兴奋性研究(额叶、左右半脑、中央和后部)。与基线和空白对照相比,研究发现MCS患者在早期时间段(0~100和100~200 ms)全脑兴奋性明显增强,而VS患者在0~100 ms时间段兴奋性增强,300~400 ms时间段兴奋性减弱。并且,MCS和VS患者的局部兴奋性明显不同。研究结果说明tDCS能够有效调控意识障碍患者的皮层兴奋性,而且MCS和VS患者的皮层兴奋性在时间和空间分布明显不同。因此tDCS在意识障碍领域的应用,不仅可以调控皮层的兴奋性,而且有可能作为一种诊断方法区分MCS和VS患者,见图3[34]。

图2 TEP和源定位

图3 tDCS调控前后局部兴奋性变化
5 总结
严重颅脑损伤后意识障碍患者的诊断和治疗仍是世界性难题,TMS技术的出现和应用,在意识障碍诊疗方面取得令人鼓舞的成果,也促进了人类对意识产生机制的理解,为广大患者和家属带来了新希望。然而,TMS作为诊疗工具,仍然没有形成国际通用的标准,相关协议还未得到统一,仍需要更多的研究,更多领域的合作。而且调控技术的改进,也在不断弥补现有技术的缺陷,比如深层刺激的TMS和高精度tDCS。但是临床研究还需要进一步的科研论证。不久的将来这些技术以及更科学先进的调控手段的出现,将为意识障碍领域带来曙光。
[1]Schnakers C,Vanhaudenhuyse A,Giacino J.Diagnostic accuracy of the vegetative and minimally conscious state: clinical consensus versus standardized neurobehavioral assessment[J].BMC Neurol,2009,9(1):35.
[2]Bergmann TO,Karabanov A,Hartwigsen G,et al.Combining non-invasive transcranial brain stimulation with neuroimaging and electrophysiology: Current approaches and future perspectives[J].Neuroimage,2016,140(8):4-19.
[3]Siebner HR,Bergmann TO,Bestmann S,et al.Consensus paper:combining transcranial stimulation with neuroimaging[J].Brain Stimul,2009,2(2):58-80.
[4]Rosanova M,Casarotto S,Pigorini A,et al.Combining transcranial magnetic stimulation with electroencephalography to study human cortical excitability and effective connectivity[J].Neuromethods,2012,67:435-457.
[5]Rogasch NC,Thomson RH,Farzan F,et al.Removing artefacts from TMS-EEG recordings using independent component analysis: importance for assessing prefrontal and motor cortex network properties[J].Neuroimage,2014,101:425-439.
[6]Rogasch NC,Daskalakis ZJ,Fitzgerald PB.Mechanisms underlying long-interval cortical inhibition in the human motor cortex: a TMS-EEG study[J].J Neurophysiol,2013,109(1):89-98.
[7]Bonato C,Miniussi C,Rossini PM.Transcranial magnetic stimulation and cortical evoked potentials: a TMS/EEG coregistration study[J].Clin Neurophysiol,2006,117(8):1699-1707.
[8]Massimini M,Ferrarelli FHuber R,et al.Breakdown of cortical effective connectivity during sleep[J].Science,2005,309(5744):2228-2232.
[9]Rosanova M,Gosseries O,Casarotto S,et al.Recovery of cortical effective connectivity and recovery of consciousness in vegetative patients[J].Brain,2012,135(4):1308-1320.
[10]Gosseries O,Thibaut A,Boly M,et al.Assessing consciousness in coma and related states using transcranial magnetic stimulation combined with electroencephalography[J].Ann Fr Anesth,2014,33(2):65-71.
[11]Casali AG,Gosseries O,Rosanova M,et al.A theoretically based index of consciousness independent of sensory processing and behavior[J].Sci Transl Med,2013,5(198):198ra105.
[12]Kobayashi M,Pascual-Leone A.Transcranial magnetic stimulation in neurology[J].Lancet Neurol,2003,2(3):145.
[13]Lefaucheur JP,André-Obadia N,Antal A,et al.Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS)[J].Clin Neurophy Siol,2014,125(11):2150-2206.
[14]Piccione F,Cavinato M,Manganotti P,et al.Behavioral and neurophysiological effects of repetitive transcranial magnetic stimulation on the minimally conscious state: a case study[J].Neurorehab Neural Re,2010,25(1):1068-1076.
[15]Manganotti P,Formaggio E,Storti SF,et al.Effect of highfrequency repetitive transcranial magnetic stimulation on brain excitability in severely brain-injured patients in minimally conscious orvegetative state[J].Brain Stimul,2013,6(6):913-921.
[16]Naro A,Russo M,Leo A,et al. A single session of repetitive transcranial magnetic stimulation over the dorsolateral prefrontal cortex in patients with unresponsive wakefulness syndrome: preliminary results[J].Neurorehab Neural Re,2015,29(7):603-613.
[17]Louise-Bender PT,Rosenow J,Lewis G,et al.Repetitive transcranial magnetic stimulation-associated neurobehavioral gains during coma recovery[J].Brain Stimul,2009,2(1):22-35.
[18]Bai Y,Xia X,Kang J,et al.Evaluating the effect of repetitive transcranial magnetic stimulation on disorders of consciousness by using TMS-EEG[J].Front Neurosci,2016,10:473.
[19]Cincotta M,Giovannelli F,Chiaramonti R,et al.No effects of 20 Hz-rTMS of the primary motor cortex in vegetative state: A randomised, sham-controlled study[J].Cortex,2015,71:368-376.
[20]Pisani LR,Naro A,Leo A,et al.Repetitive transcranial magnetic stimulation induced slow wave activity modi fi cation: A possible role in disorder of consciousness differential diagnosis[J].Conscious Cogn,2015,38:1-8.
[21]Carson RG,Kennedy NC.Modulation of human corticospinal excitability by paired associative stimulation[J].Front Hum Neurosci,2013,7(17):823.
[22]Lee L,Siebner H,Bestmann S.Rapid modulation of distributed brain activity by Transcranial Magnetic Stimulation of human motor cortex[J].Behav Neurol,2016,17(3-4):135-148.
[23]Esser SK,Huber R,Massimini M,et al.A direct demonstration of cortical LTP in humans: a combined TMS/EEG study[J].Brain Res Bull,2006,69(1):86-94.
[24]Helfrich C,Pierau SS,Freitag CM,et al.Monitoring cortical excitability during repetitive transcranial magnetic stimulation in children with ADHD: A single-blind, sham-controlled TMSEEG study[J].PLoS One,2012,7(11):e50073.
[25]Lauro LJR,Rosanova M,Mattavelli G,et al.TDCS increases cortical excitability: Direct evidence from TMS-EEG[J].Cortex,2014,58: 99-111.
[26]Naro A,Calabrò RS,Russo M,et al.Can transcranial direct current stimulation be useful in differentiating unresponsive wakefulness syndrome from minimally conscious state patients[J].Restor Neurol Neurosci,2015,33(2):159-176.
[27]Naro A,Russo M,Leo A,et al.Cortical connectivity modulation induced by cerebellar oscillatory transcranial direct current stimulation in patients with chronic disorders of consciousness:A marker of covert cognition[J].Clin Neurophysiol,2016,127(3):1845-1854.
[28]Thibaut A,Bruno MA,Ledoux D,et al.TDCS in patients with disorders of consciousness[J].Neurology,2014.
[29]Thibaut A,Di PC,Chatelle C,et al.Clinical response to tDCS depends on residual brain metabolism and grey matter integrity in patients with minimally conscious state[J].Brain Stimul,2015,8(6):1116-1123.
[30]Thibaut A,Wannez S,Donneau AF,et al.Controlled clinical trial of repeated prefrontal tDCS in patients with chronic minimally conscious state[J].Brain Injury,2017,31(4):466-474.
[31]Huang W,Wannez S,Fregni F,et al.Repeated stimulation of the posterior parietal cortex in patients in minimally conscious state: A sham-controlled randomized clinical trial[J].Brain Stimul,2017,10(3):718-720.
[32]Cavaliere C,Aiello M,Di Perri C,et al.Functional connectivity substrates for tDCS response in minimally conscious state patients[J].Front Cell Neurosci,2016,10:257.
[33]Estraneo A,Pascarella A,Moretta P,et al.Repeated transcranial direct current stimulation in prolonged disorders of consciousness: A double-blind cross-over study[J].J Neurol Sci,2017,375:464-470.
[34]Bai Y,Xia X,Kang J,et al.TDCS modulates cortical excitability in patients with disorders of consciousness[J].Neuroimage Clin,2017,15:702-709.
