复合镍钛丝在编制支架上的应用研究
2018-03-13左辉牛冬子王晨曦许国荣魏继昌刘丽
左辉,牛冬子,王晨曦,许国荣,魏继昌,刘丽
1.苏州迈迪威检测技术有限公司,江苏 苏州 215123;2.苏州茵络医疗器械有限公司,江苏 苏州 215123;3.中国食品药品检定研究院 医疗器械检定所,北京 102629
引言
血管内支架的治疗作为一种微创手术方法在近年中得到了快速的发展。支架的材料种类繁多[1-2],其中镍钛合金具有超弹性和形状记忆等特性,在骨科、牙科、血管、神经和外科领域均发挥较大作用[3-5],镍钛合金制成的血管支架具有弹性好、可恢复应变大、力量柔和持久、耐腐蚀性和生物相容性好等优点,因而得到了越来越广泛的应用[6-7]。
镍钛合金支架主要有镍钛合金管切割和镍钛合金丝编制而成的网状支架。典型的编制支架为IDEV公司的SUPERA支架。相比雕刻支架而言,编制的网状支架拥有高强度、高柔韧性、高寿命以及更高舒适性等优点[8-11],因而越来越受到欢迎。但由于镍钛合金的密度较低,因此镍钛合金网状编制支架被植入体内后很难在放射状态下被发现[12]。但支架在放射状态下的可见性与力学性能一样非常重要[13]。为了加强显影效果,常用的解决方法是在支架的两端增加显影标记点[14],但其缺点是仅能显示支架的端点,而不能反映编制支架在体内的弯曲状态。为了解决该问题,更好的体现编制支架的柔软性,出现一种复合材料的镍钛合金丝,即在镍钛丝的内部增加金属材料如铂(Pt)、钽和金等金属,又称显影核[15]。这些高密度的显影核在放射状态下有着很好的可视性,如一种“Drawn Filled Tubing(DFT)”(FortWayneMetals,FortWayne,USA)复合镍钛合金丝,内部显影成分被称为显影核。Boese等[16]对该复合镍钛合金丝在放射状态下的可视性进行研究,但局限于指定规格的丝径,同时也指出复合镍钛合金丝的力学性能也是产品设计时应该考虑的问题。Hewitt等[17]介绍了一种治疗脑动脉瘤的医疗器械采用了该类型丝,从而提高显影效果。Schaffer等[18]对含铂金显影成分的镍钛合金丝力学性能中的拉伸性能进行理论求解,但该方法受到显影材料种类、显影核形状等因素的影响,不具备通用性。同时该方法也不能计算复合丝在拉伸和弯曲情况下的残余应变。
本文研究的复合镍钛合金丝,是在正常的丝内径中增加显影单元,但受内部显影核材料、显影核面积和显影核形状等影响,复合镍钛合金丝的力学性能将发生改变,进而会影响整个支架的力学性能,尤其是在支架输送过程中,由于显影核的塑性变形,可能影响支架释放后的形状。因此,对复合镍钛合金丝进行力学分析,很有意义。目前,根据支架的使用特性,含有显影成分的支架被压握到输送管内后,支架在释放时会有残余应变。该残余应变对支架的形状自我恢复有着决定性的影响,同时也影响支架的临床效果。因此,该残余应变对支架的影响将是不得不考虑的问题。
基于ABAQUS有限元分析软件的数值计算方法已经被证实为模拟镍钛合金超弹性行为最有效的工具之一[19-21],该方法具有成本低,时间短等优点。本文针对Pt的圆形显影内核,利用有限元分析方法对其拉伸状态下的力学性能进行分析,结合相关试验数据的佐证,证明模型的可靠性和有效性。在此基础上,研究不同显影面积下,复合镍钛合金丝在拉伸和弯曲情况下的残余应变。在不影响支架力学性能的的基础上,选择显影效果更好的复合镍钛合金丝。
2 材料及试验过程
2.1 样本及试验过程
试验样本分为纯镍钛丝(NiTi)和内核含有10%显影面积的NiTi-Pt复合丝(NiTi-10% Pt),复合镍钛合金丝的截面图,见图1,内部显影成分为Pt铂金。
两种丝的外直径为d0=0.0051"(0.13 mm),试验样本的长度为L0=150 mm,热处理方式相同。采用的拉伸试验机为南方精科微机控制电子万能试验机NKK-4005D,在37°C的水域温度中对两种丝进行拉伸,拉伸速度为0.08 mm/min。

图1 NiTi-Pt复合镍钛丝
2.2 试验结果
试验得到拉伸过程中镍钛丝拉伸载荷和伸长位移之间的变化曲线,纯镍钛合金丝的载荷位移变化曲线,见图2。复合镍钛丝的载荷位移变化曲线,见图3。

图2 纯镍钛合金丝的拉伸曲线

图3 NiTi-10% Pt复合丝的拉伸曲线
为了便于分析,需要将载荷位移曲线转化为真实的应变和应力,转化公式如下:

其中,ΔL为试件改变的长度,F为施加的载荷,A0为试件的横截面。
3 材料本构模型
3.1 镍钛合金材料的本构模型
ABAQUS软件功能强大,特别是能够模拟复杂的非线性问题,它包括了多种材料本构关系及失效准则模型,并具有良好的开放性,提供了若干个用户子程序接口,允许用户以代码的形式来扩展主程序的功能。其中Abaqus/Standard求解器可以通过UMAT接口定义用户开发的材料本构模型。该软件中,拥有单独的本构模型用来描述镍钛合金超弹性,其参数,见图4,该本构模型能完整的描述镍钛合金的超弹性以及加载卸载路径。该本构模型的基础参数一共有16个,在Abaqus的软件中,镍钛合金的本构模型定义需要通过User Material接口来定义,其完整的数据格式如下:
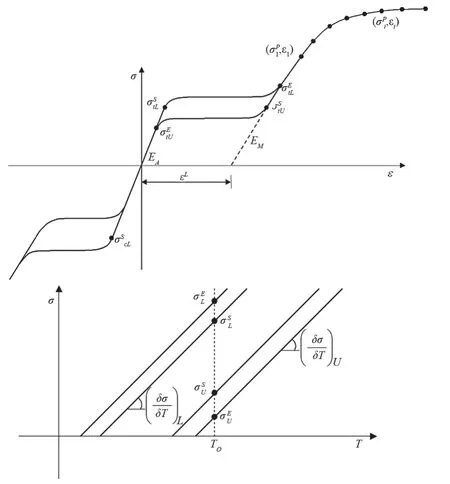
图4 镍钛合金丝的力学参数示意图
∗Material, name=ABQ_SUPER_ELASTIC
∗User Material, constants=15 +NA
EA,vA,EM,vM,εL,(δσ/δT)L,σStL,T0(δσ/δT)U,σStU, σEtU,σSCL, εLV,NA,Ns1-NSNA
∗Depvar
24,
结合图2的镍钛应力应变曲线及材料的本构模型,得到样品的材料参数如下:
*Material, name=ABQ_SUPER_ELASTIC
*User Material, constants=16
49098 , 0.33, 21750, 0.33, 0.0425, 6, 490, 591,37.0, 6,330,240,465, 0.0425, 1, 4
*Depvar
24,
建立长度为150 mm,直径为0.13 mm镍钛丝有限元模型,将材料数据带入有限元计算模型,得到仿真情况下载荷和位移变化曲线,与试验数据对比情况,见图5。
从图5中可以看出,拟合曲线和试验曲线有着很好的吻合度,材料参数及本构模型具有很高的可信性,能合理的反应材料的各种属性。

图5 仿真曲线和试验数据的对比(纯镍钛丝)
3.2 Pt的材料本构模型
Pt是一种延展性非常好的金属材料,断裂伸长率可达40%。其密度为21.45 g/cm3,拉伸模量为170 GPa,泊松比为0.39,屈服应力为25 MPa,屈服到一定程度后,应力平台为恒定的172 MPa,应力应变曲线,见图6[18]。

图6 铂金应力应变曲线
3.2 NiTi-10% Pt复合镍钛丝的模拟拉伸
根据上文的镍钛合金数据和Pt铂金的材料数据,建立含10%显影面积复合镍钛合金丝(NiTi-10% Pt)的有限元模型,见图7。
图7 复合镍钛显影丝的有限元模型
模拟拉伸情况下的载荷—位移变化曲线,见图8。从图中可以看出,规格为NiTi-10% Pt的复合镍钛合金丝,在模拟仿真的结果和测试结果有着非常高的吻合性(加载平台/卸载平台)。

图8 拟合数据和试验数据对比(NiTi-10% Pt)
4 加载平台和卸载平台预测
加载平台和卸载平台的高低,会影响编制支架慢性外向力(COF)和径向阻力(RRF),因此需要分析增加显影丝后,编制支架的性能。经过对镍钛合金和Pt材料参数及模型设置的验证,本文得到的有限元仿真模型能真实反映镍钛合金和Pt铂金单轴拉伸时所呈现出的力学性质。在此基础上,笔者通过有限元分析方法对含20%、30%及40% Pt显影材料的复合镍钛合金丝(NiTi-20% Pt、NiTi-30% Pt及NiTi-40% Pt)进行单轴拉伸的性能预测,结果见图9。根据式(1)和式(2)可以推导出的截面平均应力/应变。

图9 不同规格复合镍钛合金丝的截面平均应力应变曲线
从图9可以看出,复合镍钛丝的上下平台和极限拉伸应力随着显影含量的增加而降低。即慢性外向力(COF)和径向阻力(RRF)会降低。Schaffer等[18]认为,镍钛合金的加载平台强度在施加载荷使镍钛丝应变约为1%~8%时出现,方程(3)用于预测镍钛合金复合材料的加载平台应力,方程(4)用于预测镍钛合金复合材料的卸载平台应力。


从表1可以看出,本文预测的结果与Schaffer的预测结果很是接近。但是本文的有限元方法具有更广泛的适用性,不限显影材料种类和形状,也不限于是单轴拉伸、弯曲或扭转。
5 残余应变分析
编制支架在植入过程中,先将支架挤压到输送管中,支架将承受较大的变形,见图10;然后通过输送器将支架送到病变部位后释放,利用编制支架的自扩张功能,撑开血管,达到疏通血管的功能。但是,含显影核的镍钛合金丝在输送管中经历过度弯曲后,在病变部位自膨胀时,会留下不可恢复的残余塑性应变,该塑性应变会影响支架自膨胀后的形状。

图10 编制支架在输送管中的变形
编制支架在输送过程中的应力状态可分为单轴拉伸和弯曲两种状态,本文将分别讨论这两种情况下复合镍钛合金丝的残余应变。
5.1 单轴拉伸
在单轴拉伸的情况下,见图11。假定镍钛合金部分的回弹应力为δn(x,y),面积为Sn;显影核的压缩应力δc(x,y),面积为Sc;则复合丝的显影比例φ=Sc/(Sn+Sc)。

图11 显影丝拉伸变形示意图

表1 Schaffer的理论求解与本文仿真求解的对比(MPa)
在Z轴方向,复合镍钛合金丝在拉伸后回弹收缩,直到满足平衡方程:

即镍钛合金在Z方向所产生的回弹应力的合力等于显影核抵抗收缩的合力。
如假设截面上的应力δn(θ,R)和δc(θ,R)可视为与θ和R无关,由(5)式可知,在回弹收缩直到平衡状态下,镍钛合金平均应力δn与显影核的平均应力δc关系为

建立长为2 mm,外径为0.13 mm,显影面积分别为10%、20%、30%、40%、50%、60%、70%、80% 和 90%的复合镍钛合金丝有限元模型,材料设置参考上文。计算模型包含两步:
(1)在镍钛丝轴向施加拉伸位移。分别为0.05、0.1和0.2 mm, 根据式(1)换算成名义应变分别为2.47%、4.88%和9.53%。
(2)使其端点自由回弹收缩,计算残留应力和应变。
残留应力的结果数据,见表2,从中可以看出,显影部分平均应力与镍钛合金部分平均应力比值的β约等于显影比例φ,这与式(6)的推断一致。
不同显影面积的复合丝在不同的的拉伸应变下的残留应力,见表3。以10%显影面积为例,最大应变从2.47%~9.53%,但残余应变却在0.037%~0.038%范围内,没有随拉伸应变的增大而增大。同样的规律出现在20%、30%和40%规格复合镍钛合金丝中。但是,随着显影面积增大到60%,则出现残余应变随最大应变的增大而增大。
5.2 弯曲变形
在弯曲情况下,见图12。假定镍钛合金部分的回弹应力为δn(x,y),面积为Sn;显影核的压缩应力δc(x,y),面积为Sc。

图12 显影丝弯曲变形示意图
在Z轴方向,复合镍钛合金丝在弯曲后,回弹收缩的平衡方程为:

从式(7)可以看出,达到平衡状态时,镍钛合金在沿X轴方向所产生的回弹应力力矩等于显影核的压缩应力的力矩。即使镍钛合金部分在Z方向所产生的回弹应力的合力等于显影核的压缩应力的合力时,但由于镍钛合金部分的力偶大于显影核部分的力偶,形变恢复将继续进行。也就是说,同样的最大应变情况下,弯曲状态的残余应变会小于拉伸状态下的残余应变。
建立图7所示的有限元计算模型,复合镍钛合金丝的直径为0.13 mm,L=5 mm。载荷作用于P点,方向向下,见图13。为了和拉伸状态进行对比,使弯曲状态下的最大应力分别为2.47%、4.88%和9.53%(位于梁中点的最外侧),然后使其自由回弹,观察残余应变(位于梁中点的最外侧)。

图13 有限元弯曲计算模型示意图
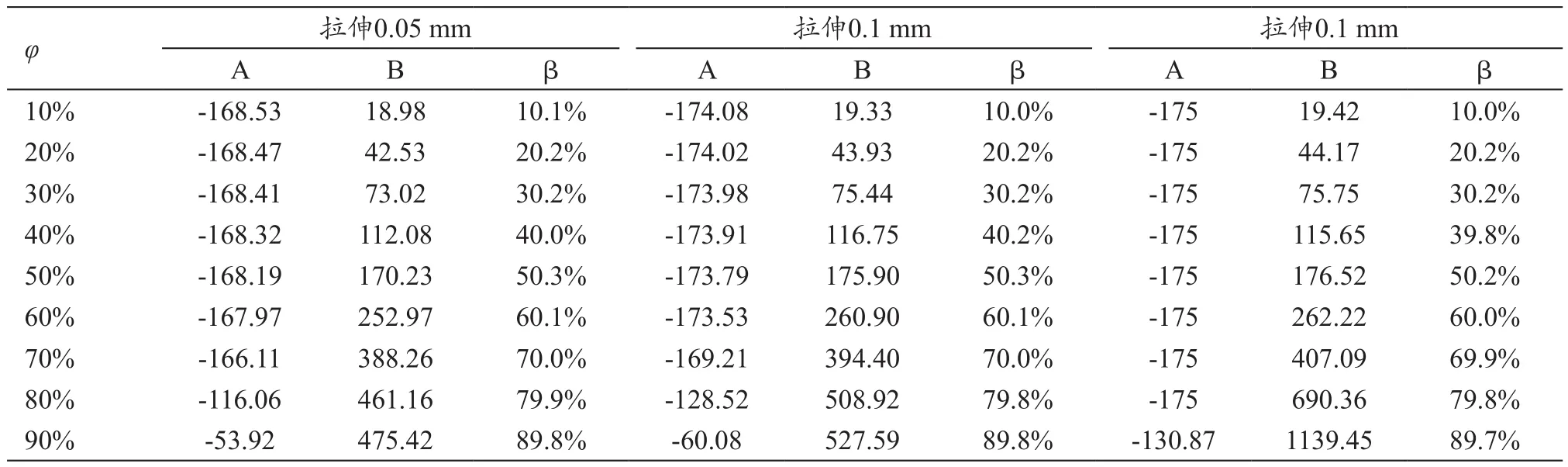
表2 轴向拉伸不同位移后的残留平均应力(MPa)

表3 单轴拉伸状态下,不同显影面积的复合丝在不同拉伸位移下的残余应变(%)
弯曲状态下,试样回弹后的残余应变,见表4。从表4可以看出,当显影面积在10%~40%之间时,残余应变与最大弯曲应变无直接关系,只与显影面积有关。当显影面积大于50%时,残余应变随最大弯曲应变的增大而增大。同时,同样显影面积在相同最大应变下,弯曲状态下的残余应变小于拉伸状态下的残余应变。这与前文的理论分析结论相一致。

表4 弯曲状态下,不同显影面积复合丝试样回弹后的残余应变(%)
6 总结及应用
为了确定复合镍钛合金丝对编制支架的使用性能是否产生影响,本文提出的有限元计算方法,能分析含有显影成分的镍钛合金丝单轴拉伸和弯曲时的力学性能。通过试验验证,证明了该方法具有非常高的可靠性。同时该方法不限丝径大小,丝径形状,显影核形状,加载方式等因素的影响,与Schaffer等[18]研究中数值求解法相比,本文的方法具有广泛通用性。
以本文提到的丝径规格和支架尺寸为例,得出如下结论:
(1)该复合镍钛合金丝在Pt含量10%~40%之间时:拉伸和弯曲残余应变与最大应变之间无直接关系;建议显影核面积占全丝截面积的比例不超过40%。作者在该镍钛丝生产厂商的官网上发现(FortWayneMetals,FortWayne,USA),目前在销售复合丝的最大显影面积为40%。
(2)最大应变相同时,弯曲状态下的残余应变小于拉伸状态下的残余应变。因此该公司的编制支架在被压至输送管中后释放时,支架力学性能基本不变。
基于此,在血管支架的编制过程中,苏州茵络医疗器械有限公司的产品将其中某一根丝换成复合镍钛合金丝,可明显提高支血管架在X光下的可视性,见图14,这在临床上有着非常重要的意义。

图14 含有显影丝的编制支架(镍钛合金丝)
在选用复合镍钛丝时,选用直径为0.13 mm,显影核面积占全丝截面积的40%。在满足增强显影效果的同时,又不会影响支架的临床效果。NiTi-40% Pt显影丝的镍钛丝编制支架被植入到生物体后,在X光下的显影效果,见图15。

图15 NiTi-40% Pt显影丝在体内通过X光观察的效果
本文的所提供的有限元分析方法能有效的分析不同规格、不同显影核形状及不同显影核材料的复合镍钛显影丝在拉伸和弯曲状态下的残余应变。本文的缺点是,本文仅以镍钛丝的单轴拉伸和3点弯曲作为研究方法,没有直接建立支架的模型,从而模拟出复合镍钛丝在支架压握和释放时的真实过程。该方向将是作者后续研究的内容。
[1]Mani G,Feldman MD,Patel D,et al.Coronary stents: A materials perspective[J].Biomaterials,2007,28(9):1689-1710.
[2]Sealy MP, Guo YB,Liu JF,et al.Pulsed laser cutting of magnesium-calcium for biodegradable stents[J].Procedia Cirp,2016,42:67-72.
[3]Petrini L,Migliavacca F.Biomedical applications of shape memory alloys[J].J Metall,2011,2011(2011):1-14.
[4]Wadood A.Brief overview on nitinol as biomaterial[J].Adv Mat Sci Engin,2016,2016(4):1-9.
[5]Lam YY.A new left atrial appendage occluder (Lifetech LAmbre TM, Device) for stroke prevention in atrial fi brillation[J].Card Rev Med Incl Mol Inter,2013,14(3):134-136.
[6]Stoeckel D,Pelton A,Duerig T.Self-expanding nitinol stents:material and design considerations[J].Eur Radiol,2004,14(2):292-301.
[7]Joseph G,Hooda A,Thomson VS.Contralateral approach to iliac artery recanalization with kissing nitinol stents present in the aortic bifurcation[J].Indian Heart J,2015,67(6):561-564.
[8]Kassab E,Marquardt A,Neelakantan L,et al.On the electropolishing of NiTi braided stents- challenges and solutions[J].Mater Werkst,2014,45:920-929.
[9]Heller L,Vokoun D,Šittner P,et al.3D flexible NiTi-braided elastomer composites for smart structure applications[J].Smart Mater Stru,2012,21(4):317-321.
[10]Ahlhelm F,Kaufmann R,Ahlhelm D,et al.Carotid artery stenting using a novel self-expanding braided nickel-titanium stent: feasibility and safety porcine trial[J].Tech Vasc Interv Radiol,2009,32(5):1019-1027.
[11]Zou Q,Xue W,Lin J,et al.Mechanical characteristics of novel polyester/NiTi wires braided composite stent for the medical application[J].Res Phys,2016,6:440-446.
[12]Russell SM.SMST-2000:Proceedings of the International Conference on Shape Memory and Superelastic Technologies[M].Almere:ASM International,2001.
[13]Wiskirchen J,Kraemer K,König C,et al.Radiopacity of current endovascular stents: Evaluation in a multiple reader phantom study[J].J Vasc Inter Radiol,2004,15(8):843-852.
[14]Wiskirchen J,Venugopalan R,Holton AD,et al.Radiopaque markers in endovascular stents-benefit and potential hazards[A].RöFo-Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren[C].New York:Georg Thieme Verlag Stuttgart,2003,175(4):484-488.
[15]Schaffer JE.DFT: Biocompatible wire[J].Adv Mater Proc,2002,160(10):51-54.
[16]Boese A,Rose G,Friebe M,et al.Increasing the visibility of thin NITINOL vascular implants[J].Curr Direc Biom Engin,2015,1(1):503-506.
[17]Hewitt TJ,Merritt BE,Patterson WR.Filamentary devices for treatment of vascular defects:US,9295473 B2[P].2016.
[18]Schaffer JE,Gordon R.Engineering characteristics of drawn filled nitinol tube[A].SMST-2003: Proceedings of the International Conference on Shape Memory and Superelastic Technologies (ASM International)[C].2004:109-118.
[19]Gong X,Pelton AR.ABAQUS analysis on nitinol medical applications[A].ABAQUS Users’ Conference, Newport, Rhode Island[C].2002:1-10.
[20]Rebelo N,Perry M.Finite element analysis for the design of Nitinol medical devices[J].Min Inv Ther All Tech,2000,9(2):75-80.
[21]Shayanfard P,Šandera P,Horná Kovái J,et al.Ni-Ti selfexpanding vascular stent configuration and biomedical interaction with artery: Finite element analysis[J].Sol Stat Phen,2016,258:366-369.
