半滑舌鳎源美人鱼发光杆菌美人鱼亚种的分离鉴定
2018-03-13张志强吴同垒王洪彬史秋梅高桂生河北科技师范学院河北秦皇岛066604
杨 楠,张志强,吴同垒,王洪彬,史秋梅,高桂生(河北科技师范学院,河北秦皇岛 066604)
美人鱼发光杆菌(Photobacteriumdamselae)又称海弧菌,是海洋革兰氏阴性球杆菌,包括美人鱼亚种(Photobacteriumdamselaesubsp.Damsela;PDD)和杀鱼亚种(Photobacteriumdamselaesubsp.Piscicida;PDP)两个亚种,在美国、日本、欧洲和我国的海水养殖中为常见的病原菌[1-2]。该菌是嗜盐病原菌中的重要成员,是一种机会致病菌,广泛存在于海水及寄生于海产动物中,没有明显的宿主特异性,能够感染多种海洋经济鱼类,造成大批死亡;比如雀鲷科鱼[3]、卵形鲳鲹[4]、斑节对虾[5]、鲱鱼[6]等;也有报道称,该菌还能感染甲壳类、软体动物、爬行动物[7]。在海洋哺乳动物中,1988年首次报道美人鱼发光杆菌美人鱼亚种从发病宽吻海豚体内分离[6]。患病鱼临床表现为败血症,体表溃疡,腮部、鳍部出血,断尾;该菌发病迅速,死亡率高,给养殖业的造成重大经济损失。对人而言,PDD是一种人鱼共患病病原菌,机会性感染暴露于盐水或半咸水域和海洋活动过程中造成的伤口,可能会演变为坏死性筋膜炎甚至致命[8]。
2016年5月,秦皇岛市昌黎县某海水养殖基地,大批舌鳎突然死亡,死亡率高达25%。病鱼食欲不振,不喜活动,脱离鱼群,体表溃疡,腮鳍部出血,有的甚至断尾;剖检可见肠道充血,腹水严重,肝脏肿胀充血,肾脏微黄。研究从病鱼体内分离出优势菌株,进行PCR鉴定、生化特性鉴定,最终确定分离菌是美人鱼发光杆菌美人鱼亚种。
1 材 料
1.1 病料样品 河北秦皇岛市昌黎县某海水养殖基地病死舌鳎鱼,体重在420~780 g之间。
1.2 实验材料 普通营养琼脂培养基,购自青岛高科园海博生物技术有限公司;血琼脂平板(兔血)购自郑州安图生物工程股份有限公司;药敏片,购自杭州微生物试剂公司;2×Es Taq MasterMix,购自康为世纪公司; 16S rDNA所用引物,均由北京生工生物工程有限公司合成;克隆菌株DH5α为实验室保存;ATB全自动生化鉴定系统,由法国梅里埃公司生产;ID32E鉴定试剂条购自北京威泰科生物技术有限公司。
1.3 实验动物 试验用舌鳎鱼购自某水产养殖基地,体重约200 g/尾;清洁级BALB/c小鼠,购自中国医学科学院实验动物研究所;实验动物试验前均在实验室自由采食1周,以适应环境。
2 方 法
2.1 细菌分离与鉴定
2.1.1 细菌的分离培养与镜检 无菌采集心血接种于营养琼脂上,30 ℃培养12 h,平板上长出均一菌落,挑取单菌落于血液琼脂上进行菌落形态和溶血性观察;对分离菌株进行革兰氏染色镜检,观察细菌染色特性及形态;选取优势菌落接种于普通LB液体培养基中,划线于两个兔血琼脂平板上,分别置于30 ℃和37 ℃培养12 h,观察分离菌株是否于37 ℃生长。
2.1.2 分离菌株的16S rDNA 基因序列分析 抽提分离菌株基因组并以其为模板进行PCR,引物为27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R 5'-GGTTACCTTGTTACGACTT-3')。50 μL PCR体系:2×Taq PCR Mix 25 μL,上游引物1 μL,下游引物1 μL,ddH2O 22 μL,模板1 μL。回收目的基因片段,与pMD18-T连接后转入DH5α大肠杆菌感受态细胞;挑单菌落PCR检测,阳性菌株提取质粒并送测序。
测序结果经过拼接后,在NCBI上Blast工作区上进行序列比对,下载同源性高的菌株序列以及相关菌种的16SrRNA序列,进行同源性分析、构建系统发育树。
2.1.3 生化鉴定 采用ATB自动生化鉴定系统:将分离菌株接种鲜血琼脂培养基,刮取菌落接种生理盐水,调整菌液浓度至0.5个麦氏浊度, 将菌液加入ID32E生化鉴定试纸条样品孔中,40 μL/孔,并在厌氧培养的孔中加入一滴矿物油,置于湿盒中,30 ℃培养24 h;次日在吲哚实验孔加入一滴James染液,将试纸条置于ATB自动鉴定系统中进行鉴定。
2.2 药敏试验 按照美国临床检验标准委员会(NCCLS)推荐的标准K-B纸片法进行试验操作和结果判断。
2.3 动物致病性试验及分离菌LD50检测
2.3.1 动物致病性试验 将纯培养分离菌接种于LB培养基30 ℃培养10 h,用生理盐水洗涤,调整菌液为1.0×108CFU/mL。选取12只健康舌鳎鱼,随机分成3组,2个实验组,1个对照组,每组4尾。实验组每尾腹腔注射0.2 mL菌液,对照组注射0.2 mL生理盐水,连续观察4 d,记录试验舌鳎鱼发病死亡情况,并对病死鱼进行细菌分离鉴定。
2.3.2 分离菌对舌鳎鱼的LD50检测 选取健康舌鳎鱼60尾,随机分成6组,5组为实验组,1组为对照组,每组10尾。用灭菌生理盐水稀释菌液至1.0×106、1.0×105、1.0×104、1.0×103、1.0×102CFU/mL五个实验梯度,实验组每尾腹腔注射0.2 mL菌液,对照组每尾腹腔注射等体积的生理盐水。攻毒后72 h观察患病及死亡情况,用寇氏改良法计算LD50,并对病死鱼进行剖检、细菌分离鉴定。
2.3.3 分离菌对BALB/c小鼠的LD50检测 选取健康BALB/c小鼠60只,分组处理同2.3.2。用灭菌生理盐水稀释菌液至1.0×108、1.0×107、1.0×106、1.0×105、1.0×104CFU/mL五个实验梯度,实验组小鼠腹腔注射0.1 mL菌液,对照组注射等体积生理盐水;其余操作同2.3.2。
3 结 果
3.1 细菌分离与鉴定
3.1.1 细菌分离培养与镜检 从半滑舌鳎中分离出一株细菌,在兔血平板长出半透明,圆形光滑、中间较隆起、边缘整齐中等大小菌落,呈现典型的β型溶血(图1),为革兰氏染色阴性的球杆菌(图2)。

图1 分离菌血琼脂培养Fig 1 Blood agar medium
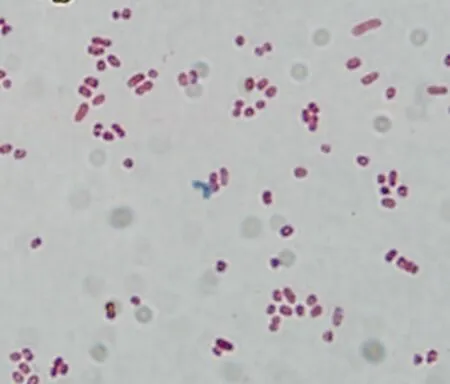
图2 分离菌革兰氏染色镜检结果Fig 2 Gram staining
3.1.2 分离菌株的16S rDNA基因序列分析 以抽提分离菌株基因组为模板,16S rDNA引物进行PCR扩增,产物经琼脂糖凝胶电泳,于1500 bp(图3)出现目的条带。分离菌株16S rDNA基因序列与GenBank上公布的美人鱼发光杆菌参考株高度同源,证实其确为美人鱼发光杆菌。利用Lasergene软件上的MegAlin分区对分离菌与美人鱼发光杆菌标准株ATCC33539、CECT5064 等参考菌株进行序列比对。结果显示(图4、图5),分离菌株与美人鱼发光杆菌处于同一分支,进一步说明分离菌株为美人鱼发光杆菌。
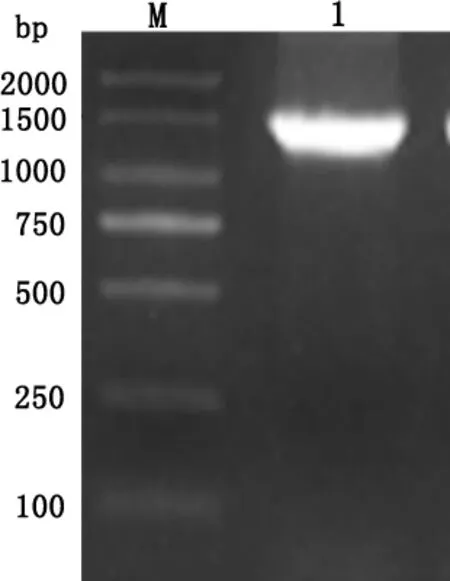
M:DNA标准DL2000;1:从心血中分离菌的16S rDNA扩增产物M:DL2000 Marke;1:PCR products of positive strains from the heart blood图3 分离菌16S rDNA PCR扩增产物Fig 3 PCR result of 16S r DNA gene from Isolated bacteria
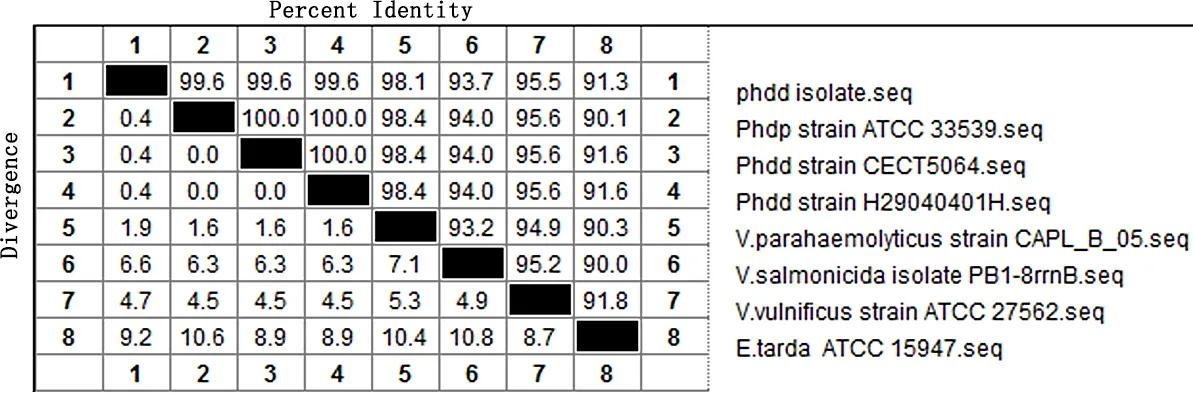
图4 分离菌株16S rDNA同源性比较Fig 4 Homology comparison of nucleotide sequences of 16 S rDNA gene
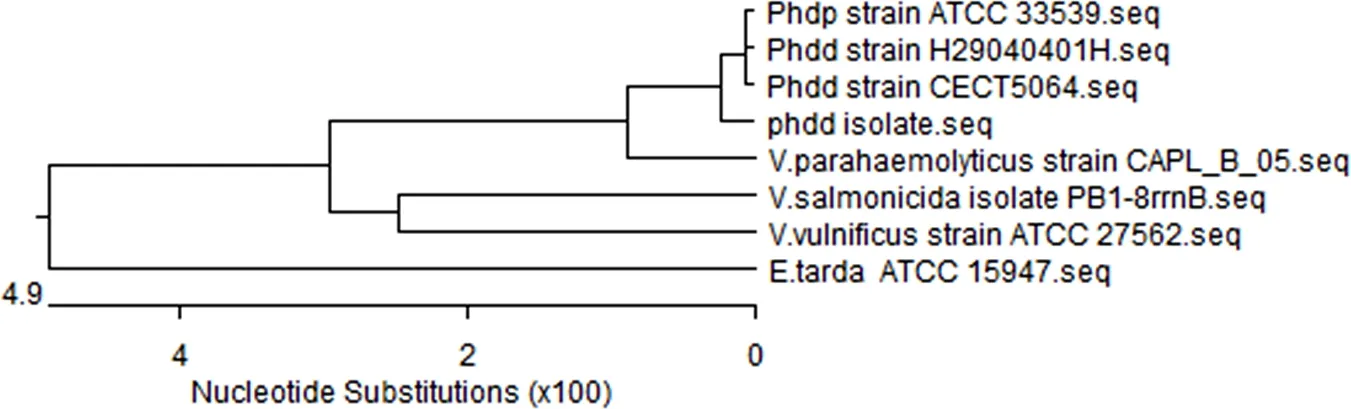
图5 分离菌株16S rDNA基因序列的系统发育树Fig 5 Phylogenetic analysis based on sequences 16 S rDNA gene
3.1.3 分离菌生化鉴定结果 对分离菌株进行生化特性鉴定证实其为美人鱼发光杆菌,进一步检测分离菌株七叶苷发酵阳性,37℃生长良好,证实其为美人鱼亚种。
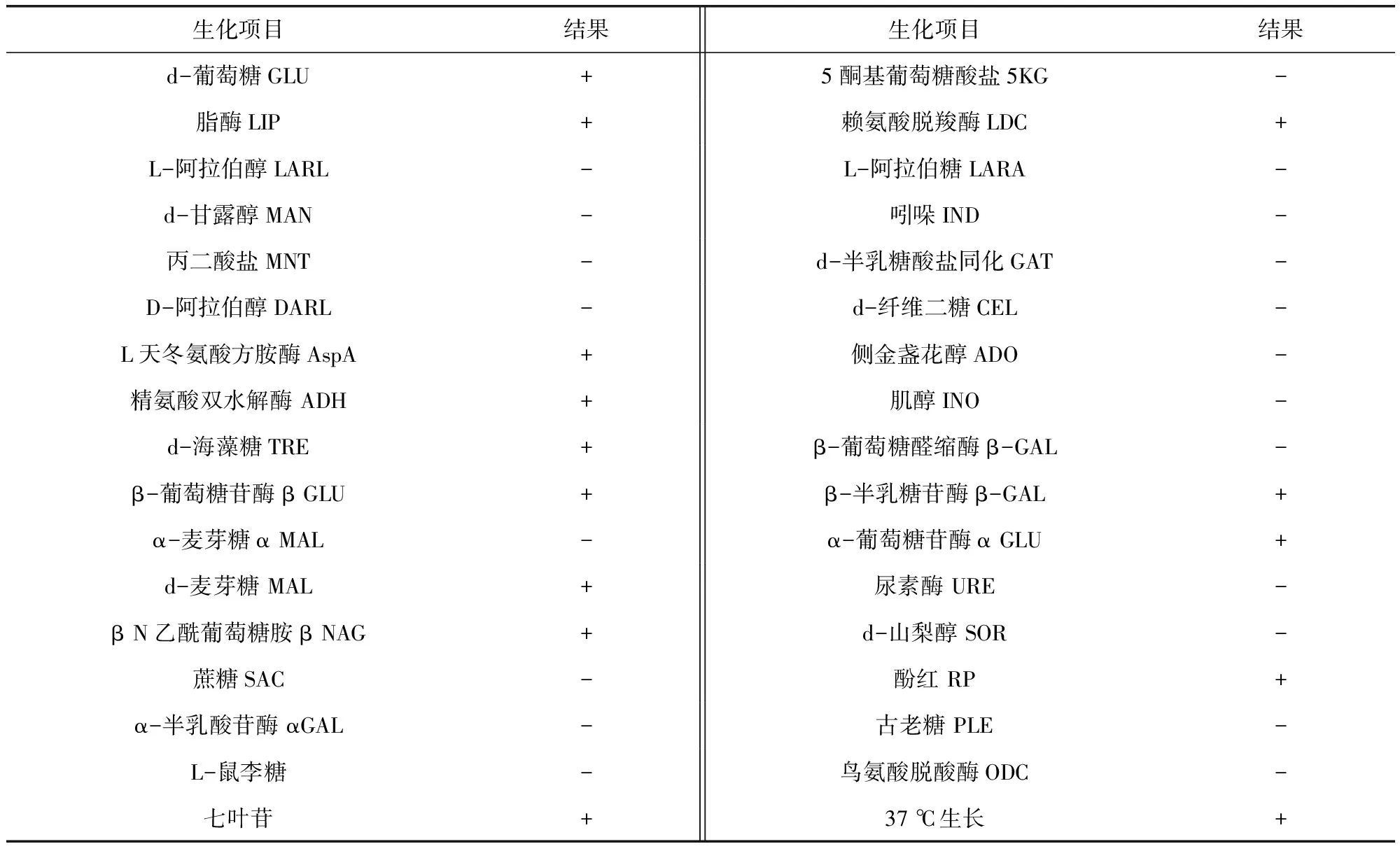
表1 分离菌株主要生化指标Tab 1 Main phenotypic traits of the isolate
“+”表示阳性;“-”表示阴性。
"+"positive;"-"negative.
3.2 药敏试验 药敏试验共计使用21种药物,结果显示,分离菌对恩诺沙星、诺氟沙星、环丙沙星、乙酰甲喹敏感;对头孢拉定、多西环素中敏;对大观霉素、庆大霉素、林可霉素、二甲氧嘧啶、新诺明、替米考星、间甲氧嘧啶、青霉素、链霉素、土霉素、氨苄青霉素、新霉素、头孢曲松、卡那霉素、阿米卡星不敏感。
3.3 分离菌动物回归试验及LD50检测
3.3.1 分离菌动物回归试验 实验组舌鳎鱼在接种分离菌12 h后出现死亡,36 h全部死亡;对照组无死亡。实验组舌鳎鱼腮部有出血症状,剖检发现肝脏肿胀,肠粘膜出血,这与最初分离菌的症状相符。从死亡舌鳎鱼内脏分离细菌培养,按照上述方法镜检、PCR试验、生化鉴定,确定该病菌与养殖场病死舌鳎鱼体内分离的细菌一致,均为美人鱼发光杆菌。
3.3.2 分离菌对舌鳎鱼的LD50检测 5个试验梯度中,第1组舌鳎鱼在攻毒16 h后出现死亡,第1、2组舌鳎鱼48 h内全部死亡,连续观察一周,第5组和对照组无死亡。根据表2数据,利用寇氏改良法计算出PDD对舌鳎鱼的LD50=3.1×104CFU/mL。
3.3.3 分离菌对BALB/c小鼠的LD50检测 实验1组小鼠在接种病菌5 h后出现死亡,实验1、2组小鼠在16 h内全部死亡;对照组没有死亡,连续观察一周。根据表3数据,利用寇氏改良法计算出PDD对BALB/c小鼠的LD50=5.0×105CFU/mL。

表2 分离菌半数致死量检测结果Tab 2 Median lethal dose of isolated bacteria
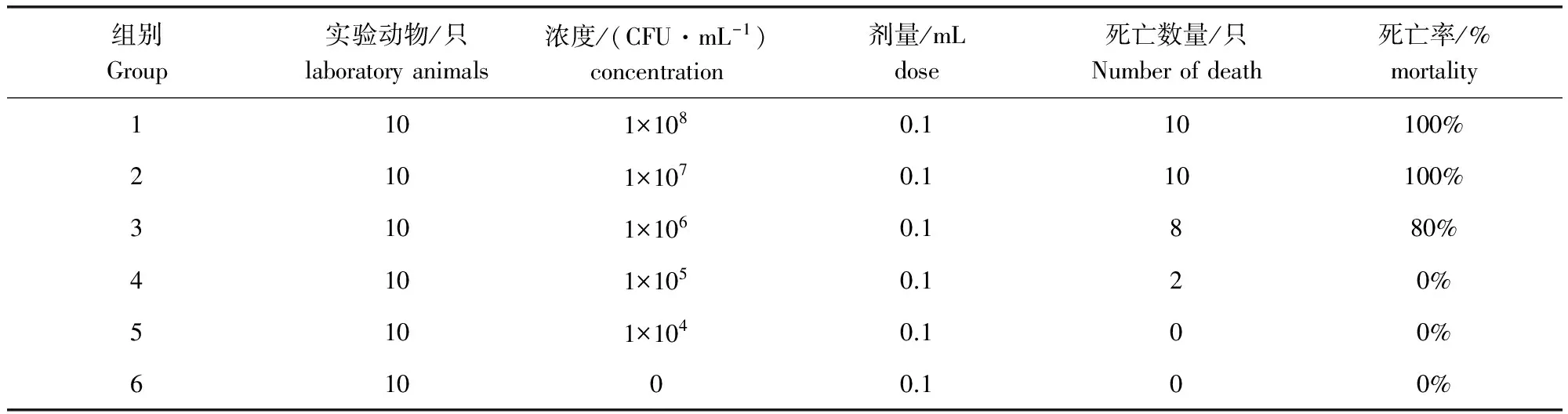
表3 分离菌半数致死量检测结果Tab 3 Median lethal dose of isolated bacteria
4 讨论与小结
美人鱼发光杆菌包含美人鱼杀鱼亚种和美人鱼亚种两个亚种,其中美人鱼亚种以前被称为美人鱼弧菌,具有某些弧菌特性,研究发现美人鱼亚种细菌条件致病,感染宿主范围广泛,能够感染多种鱼类,亦可感染包括人在内的哺乳动物,具有一定的公共卫生学意义。PDD感染鱼类主要引起细菌性败血症,死亡率较高。研究PDD分离自秦皇岛某养殖基地病死舌鳎内脏,病鱼外观表现与病理变化与PDD感染相似。
美人鱼发光杆菌美人鱼亚种最早从患有皮肤溃烂病的雀鲷鱼[3]中发现,此后陆续从大菱鲆、海鲤、石斑鱼、鲨鱼以中分离得到[9],但从半滑舌鳎鱼种分离该菌尚属首次。PDD感染致病的资料较少,对于其致病的报道多集中于国外,但其造成危害较大,尤其近年来该菌所致感染在我国呈上升趋势,实验室已多次从冀东沿海地区分离出该菌,应重视其潜在威胁。除此之外,对美人鱼发光杆菌美人鱼亚种进行研究的意义在于其具有的公共卫生学价值,PDD能够感染人已被证实,食源性途径和伤口是人类感染的主要方式[10]。研究中所分离的菌株能够在37 ℃生长良好,同时对舌鳎鱼和小鼠均具有较强的致病性(半数致死量分别为3.1×104CFU/mL和5.0×105CFU/mL),揭示了其对人类健康的潜在威胁。
目前,对于水产细菌病原的防治多以抗生素和化学药物为主,其能够对细菌性病原有一定的治疗效果,但其所造成的抗生素残留、水体污染以及诱导细菌多重耐药情况不容忽视。对江苏沿海地区水体细菌进行耐药情况调查结果表明,江苏省沿海地区分离的部分水产养殖致病菌出现多重耐药,二重、三重、四重、五重耐药率分别为 22.3%、13.5%、10.9%、6.6%,某些菌株甚至达到十一重耐药[11];上海地区分离菌株多重耐药率为100%,海南地区分离菌株多重耐药率为77.5%[12]。由此可见,海水弧菌的多重耐药现象严重,各地区病原菌所耐药物并不一致,存在地区差异。在水产上耐药严重的病原菌有嗜水气单胞菌、温和气单胞菌[13]、爱德华氏菌等[14],其多重耐药的情况已引起人们重视。若抗生素继续不科学、不合理使用,可能会使耐药菌演变为超级细菌,给水产养殖业和人类健康构成巨大威胁。通过长期对冀东地区水产病原进行监测,所分离的部分菌株亦呈现明显的多重耐药情况。对研究分离的美人鱼发光杆菌美人鱼亚种进行药敏试验结果显示,分离菌株对多种抗生素不敏感,反映出本地水产细菌耐药形势严峻,可进一步检测分离菌株的耐药基因,为该病的防控提供参考。
[1] 房 海. 水产养殖动物病原细菌学[M]. 中国农业出版社, 2010.
Fang H. Aquacultural Animal Pathogenic Bacteriology[M].China Agricultural university Press,2010.
[2] 王庚申, 许文军, 谢建军,等. 条石鲷(Oplegnathus fasciatus)源美人鱼发光杆菌杀鱼亚种(Photobacteriumdamselaesubsp.piscicida)的分离鉴定[J]. 渔业科学进展, 2017, 38(2):151-157.
Wang G S,Xu W J,Xie J J,etal. Isolation and Identification ofPhotobacteriumdamselaesubsp.piscicidafrom Diseased Rock Bream (Oplegnathus fasciatus) [J].Progress in fishery Sciences, 2017, 38(2):151-157.
[3] 张 飞. 大黄鱼源美人鱼发光杆菌的分离鉴定与致病性研究[D]. 集美大学, 2013.
Zhang F. Studies on the identification and virulence ofPhotobacteriumdamselaeisolated fromPseudosciaencrocea[D]. JiMei University, 2013.
[4] 苏友禄, 冯 娟, 郭志勋,等. 美人鱼发光杆菌杀鱼亚种感染卵形鲳鲹的病理学观察[J]. 海洋科学, 2012, 36(2):75-81.
Su Y L,Feng J,Guo Z X,etal. Histopathological analysis of golden pompanoTrachinotusovatusinfected withPhotobacteriumdamselaesubsp.piscicida[J]. Marine Sciences, 2012, 36(2):75-81.
[5] 兰 萍, 宋晓玲, 张 辉,等. 美人鱼发光杆菌对凡纳滨对虾非特异性免疫功能及抗病力的影响[J]. 渔业科学进展, 2010, 31(1):65-7
Lan P,Song X L,Zhang H,etal. Effect ofPhotobacteriumdamselaeon the non-specific immune response and disease resistance ofLitopenaeusvannamei[J]. Progress in fishery Sciences, 2010, 31(1):65-7.
[6] Yashgin H, Nima B, Majid B S. First time isolation ofPhotobacteriumdamselaesubsp.damselaefromCaranxsexfasciatusinPersian Gulf, Iran[J]. Iranian Journal of Microbiology, 2015, 7(3):178-184.
[7] Terceti M S, Rivas A J, Alvarez L,etal. RstB regulates expression of thePhotobacteriumdamselaesubsp.damselaemajor virulence factors damselysin, phobalysin P and phobalysin C.[J]. Frontiers in Microbiology, 2017, 8
[8] Takahashi H, Miya S, Kimura B,etal. Difference of genotypic and phenotypic characteristics and pathogenicity potential ofPhotobacteriumdamselae,subsp.damselae, between clinical and environmental isolates from Japan[J]. Microb Pathog, 2008, 45(2):150-158.
[9] Terceti M S, Ogut H, Osorio C R.Photobacteriumdamselaesubsp.damselae, an emerging fish pathogen in the Black Sea: evidences of a multiclonal origin[J]. Applied & Environmental Microbiology, 2016, 82(13):AEM.00781-16.
[10] Thune R L, Fernandez D H, Hawke J P,etal. Construction of a safe, stable, efficacious vaccine againstPhotobacteriumdamselaessp.piscicida[J]. Diseases of Aquatic Organisms, 2003, 57(1-2):51.
[11] 乔 毅. 江苏省沿海地区水产养殖主要致病菌耐药性研究[D]. 上海海洋大学, 2015.
Qiao Y. Study on the major pathogenic bacteria resistance of aquaculture in the coastal regions of Jiangsu provinceD]. Shanghai Ocean University, 2015.
[12] 写腊月. 海水弧菌耐药性调查及整合子—基因盒系统检测[D]. 上海海洋大学, 2012.
Xie L Y. Survey of antimicrobial resistance and detection of integron gene cassettes of Vibrio isolates from mariculture[D]. Shanghai Ocean University,2012.
[13] 谭爱萍. 水产动物源气单胞菌耐药性与质粒介导喹诺酮类耐药研究[D]. 华南农业大学, 2016.
Tan A P. Surveillance of antimicrobial resistance and study of plasmid-mediated quinolone resistance among aeromonas isolates from different aquatic animals[D]. South China Agricultural University, 2016.
[14] 葛慕湘, 靳晓敏, 张艳英,等. 迟钝爱德华氏菌耐药表型及 4 种耐药基因检测[J].水产科学, 2015, 34(5):300-304.
Ge M X,Jin X M,Zhang Y Y,etal.Detection of drug resistance and four drug resistance genes in bacterial pathogenEdwardsiellatarda[J].Fisheries science, 2015, 34(5):300-304.
