人参提取液体外抑制IHNV作用效果研究
2018-03-13茆安婷尹玉伟郭曦尧李月红吉林农业大学动物科学技术学院长春130118
茆安婷,尹玉伟,代 静,郭曦尧,程 义,李 东,李月红(吉林农业大学动物科学技术学院,长春 130118)
传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus,IHNV),弹状病毒科,诺拉弹状病毒属[1],作为传染性造血器官坏死病(infectious heamatopoietic necrosis,IHN)的病原体,是一种线性单链RNA病毒,最早在上世纪50年代在北美西部华盛顿及俄勒冈州于红大马哈鱼(Oncorhynchus nerka)孵卵期的鱼苗身上首次被发现[2],并迅速蔓延到欧洲和亚洲,在全世界鲑鳟鱼类中流行[3]。目前在对IHNV的防治措施主要有两个方面,其一是抗病育种[4],其二是通过对健康鱼体进行早期的免疫接种,使机体免疫系统产生特异性免疫反应从而达到预防病毒的作用。而这两种方法存在一定的不确定性,同时对鱼类自身的健康及相关食品安全存在一定的隐患,虽然目前尚未有相关报道表明IHNV会直接影响人类的健康,但随着病毒变异、鱼机体的药物残留导致的食品安全问题可能会对人类的健康造成影响,所以寻找新型药物迫在眉睫,目前在我国渔业养殖中,绿色、无公害、无耐药性的新抗病毒中兽药将逐步成为市场的主导。为寻找抗传染性造血器官坏死病病毒(IHNV)的有效药物,有文献表明,习欠云等人[5]发现人参多糖复合物对对虾肝脏中SOD超氧化物歧化酶活力有明显提高效果,对于血清中PO和LSZ有类似作用;同时人参皂甙Rb1在体外细胞试验中能够灭活病毒[6]。为此试验选取人参提取液对IHNV进行体外抑制方面的研究,为IHVN防治药物的研发提供新的思路及参考。
1 材料与方法
1.1 材料 鲤鱼脑细胞系(common carp brain, CCB)细胞培养液:M199固体培养基(北京Solarbio公司)溶解于蒸馏水中,0.22 μm过滤,加入10%体积胎牛血清和1%体积双抗(青霉素-链霉素溶液100x,长春晶美生物),4 ℃保存。
CCB细胞维持液:M199固体培养基溶解于蒸馏水中,0.22 μm过滤,4 ℃保存。
噻唑蓝溶液(MTT溶液)∶50 mg噻唑蓝(长春梦怡美生物科技有限公司)溶解于10 mL蒸馏水中,0.22 μm过滤,4 ℃保存。
人参提取液:将中药人参片(购于吉林省长春市百草大药房,参照中国药典2005版附录IX进行质量鉴定)运用水浴加热法提取,再将提取得到的药液通过水浴锅浓缩得到浸膏,4 ℃保存[7-8],使用时用蒸馏水溶解至饱和,0.22 μm过滤。
其他材料:上述常用试剂均为分析纯,二甲基亚砜(DMSO)、胰酶消化液等购自长春梦怡美生物科技有限公司。CCB细胞、IHNV为实验室保藏。
1.2 试验方法
1.2.1 病毒滴度测定 将CCB细胞接种于96孔板中,27 ℃、5%CO2培养24 h备用,将病毒悬液按照10-1-10-10做连续稀释后按照100 μL/孔接种于长成单层细胞的96孔板中,每个浓度做8孔重复,梯度降温至15 ℃,继续培养72 h,记录每孔细胞病变情况,根据Reed-Muench法计算半数组织培养感染量(ICID50)[9]。
1.2.2 RTCA[10]实时监控不同浓度人参提取液对IHNV的抑制作用 将CCB细胞以400个/孔的浓度接种于16孔E-Plate细胞增殖板内,5% CO2、27 ℃培养24 h后弃去细胞培养液,加入100 μL/孔病毒液感染CCB细胞,对照组加入无血清细胞维持液。5% CO2、15 ℃条件下孵育2 h后弃去病毒液,细胞维持液洗涤两次后分别加入100 μL/孔2%、4%、8%人参提取液,每个浓度3孔重复,细胞对照加入无血清细胞维持液。将E-Plate细胞增殖板放回实时细胞分析仪内,设置每间隔15 min监测并记录CI值,继续监测72 h。后续实验中所用人参提取液均为本步骤筛选出抑制效果最佳的人参提取液浓度。
1.2.3 人参提取液对IHNV的直接灭活作用 将人参提取液与病毒按照1∶1体积混合,27 ℃环境下分别作用30 min、1 h、2 h、4 h和8 h,加入到长成单层细胞的96孔板中,100 μL/孔,每时间点重复4孔[11]。梯度降温至15 ℃,5% CO2继续培养。同时设置细胞对照组和病毒对照组。当病毒对照组CPE达80%左右时,记录各孔CPE情况,MTT法测490 nm处OD值,计算人参提取液对IHNV的抑制率。

1.2.4 人参提取液对IHNV复制的阻断作用 将毒力100TCID50的病毒液100 μL/孔接入长成单层细胞的96孔板中,梯度降温至15 ℃。培养30 min、1 h、2 h、4 h、8 h、12 h、16 h,每时间点做4孔重复。达到培养时间后弃去病毒液,用细胞维持液洗涤2次。加入100 μL/孔的人参提取液,5%CO2,15 ℃继续培养。同时设置细胞对照和病毒对照。当病毒对照组CPE达80%左右时,记录各孔CPE情况,MTT法测490 nm处OD值,计算人参提取液对IHNV复制阻断的抑制率,评估人参提取液对IHNV复制的阻断作用。
2 结 果
2.1 病毒滴度测定结果 测定结果见表1。由公式计算可得,病毒TCID50=10-5.6,即当稀释度为10-5.6时,可使孔内50%的细胞发生病变。
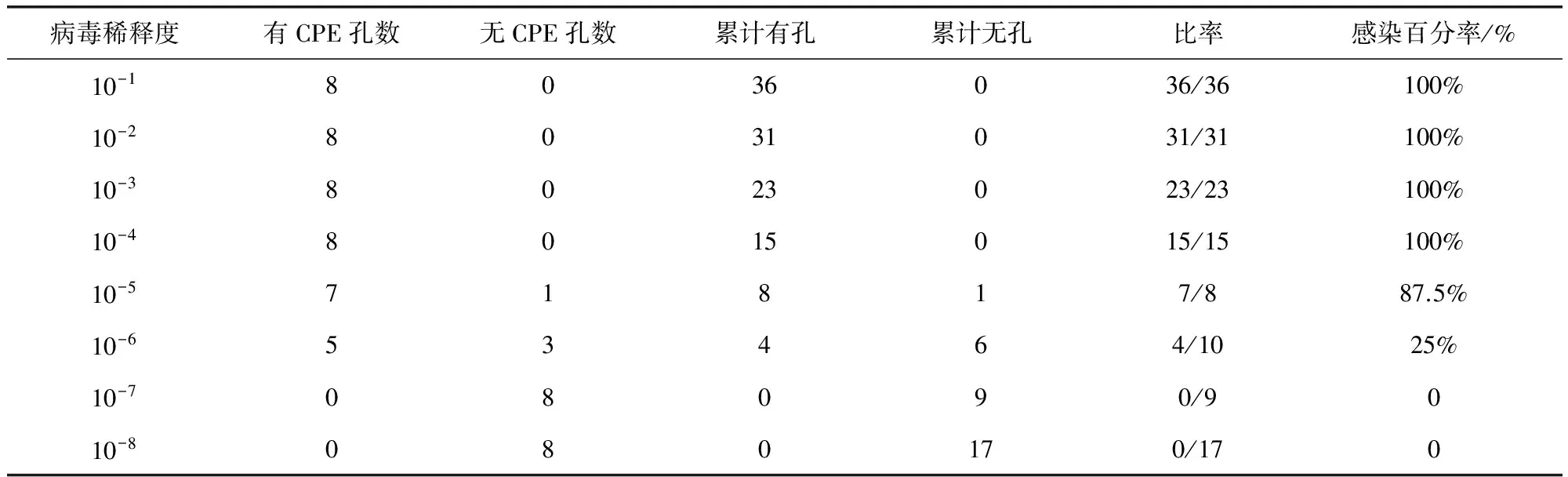
表1 病毒滴度测定结果Tab 1 Results of virus titer test
2.2 RTCA实时监控不同浓度人参提取液对IHNV的抑制效果 由图1可知,根据RTCA实时无标记细胞功能分析仪检测得到的细胞曲线,细胞接种24 h 期间各组细胞曲线均值稳定上升,细胞生长状态良好,加样前无明显停滞或下降趋势。加入病毒液后,细胞经温度和病毒的刺激增殖受到抑制,曲线骤降至同一水平。病毒吸附的4 h后细胞指数降低,显示病毒开始明显抑制CCB细胞生长,而细胞对照组仍成稳定增长趋势。从人参提取液对IHNV的抑制效果上,4%人参提取液对IHNV的抑制效果最佳,后期与细胞对照组细胞指数接近。而8%人参提取液在前期促进了细胞的生长,后期保护效果不佳。
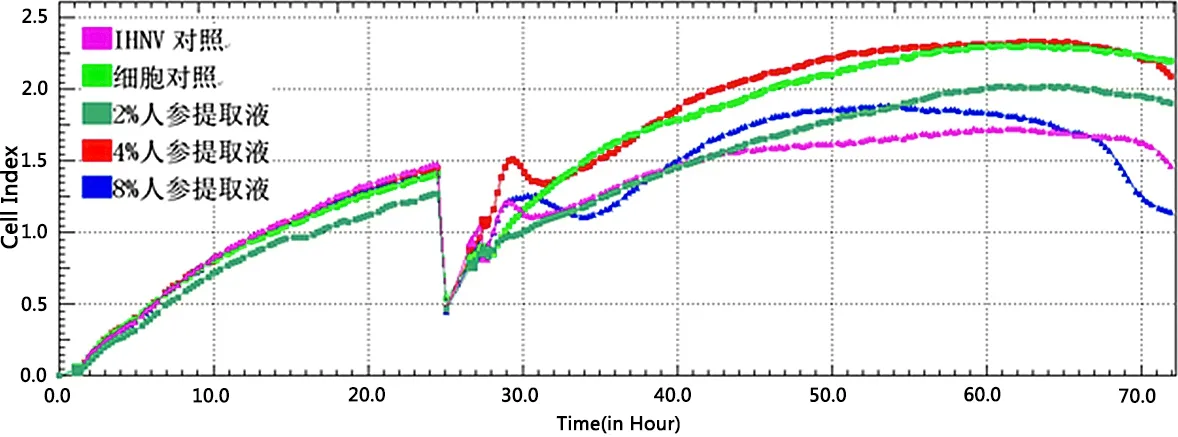
图1 不同浓度人参提取液对IHNV抑制作用Fig 1 Inhibitory effect of ginseng extract with different concentrations on IHNV
2.3 人参提取液对IHNV的直接灭活作用结果 由表2可知,人参提取液对IHNV有直接灭活作用,5个时间点检测抑制率最高达51.5%,但各个时间点间抑制率结果差异不显著(P>0.05)。

表2 人参提取液对IHNV直接灭活抑制率结果Tab 2 Inhibitory effect of ginseng extract on direct inactivation of IHNV
抑制率结果一列数据右上角标注相同字母表示结果差异不显著(P>0.05)
the results of the inhibition rate are shown in the upper right corner of the data. The results of the same letter are not significant (P>0.05)
2.4 人参提取液阻断IHNV复制结果 由表3可知,IHNV先作用30 min~16 h后加入的人参提取液对病毒均具有复制抑制作用,病毒先作用1~4 h期间,人参提取液抗病毒作用明显,抑制率接近60%。实验期间人参提取液均表现出持续抑制作用,但30 min和16 h时抑制作用较其他时间点不明显。
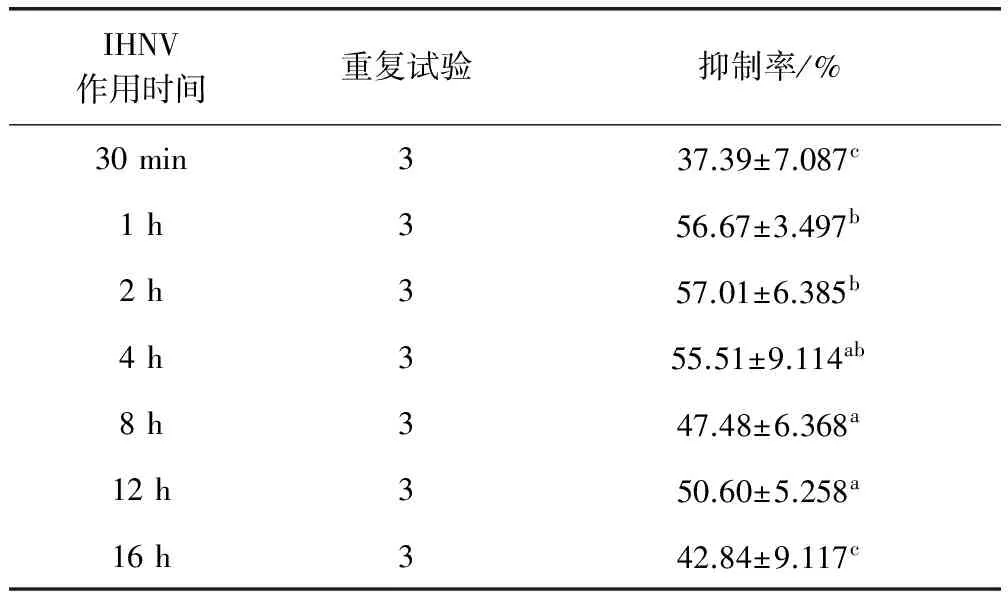
表3 人参提取液阻断IHNV复制抑制率结果Tab 3 Ginseng extract was used to block IHNV replication inhibition rate
抑制率结果一列数据右上角标注相同字母,表示差异不显著(P>0.05),标注字母不相同表示差异显著(P<0.05)
the result of inhibition rate is the same in the top right corner of the data, which means that the difference is not significant (P>0.05), and the letters are different, which means significant difference (P<0.05)
3 讨论与小结
为了探讨人参提取液体外抑制CCB细胞感染IHNV的能力,构建体外CCB细胞模型,运用RTCA技术和MTT法分别测得2%人参提取液、4%人参提取液和8%人参提取液对IHNV感染CCB细胞后抑制作用曲线,从阻断病毒复制和杀灭病毒两方面讨论人参提取液作用效果。 研究表明,4%人参提取液对IHNV具有明显抑制作用,能够在一定时间内保护细胞不受IHNV病毒的侵染,2 h时对病毒灭活抑制率最高达到51.5%,1~12 h内对病毒复制有持续抑制作用,而8%人参提取液在前期促进了细胞的生长,后期保护效果不佳,对比说明人参提取液对IHNV的抑制不与剂量成依赖关系。
人参中含有Rg1、Rb1等30多种人参皂苷、α-人参烯等挥发油、人参酸等有机酸、人参黄酮苷等黄酮以及木脂素、甾醇、氨基酸、多糖等多种有益成分,其中人参皂苷及多糖等为主要有效成分[5]。而人参皂甙Rb1具有抗病毒的能力,在体外细胞试验中能够灭活病毒,使N蛋白表达下降从而起到抑制病毒复制的作用[6]。
由于目前IHNV增殖、复制和与宿主间相互作用的研究匮乏,试验用RTCA实时无标记技术测得4%人参提取液对IHNV抑制作用明显,较常见病毒CPE实验省时省力,结果精确,避免了由于病毒在细胞内复制作用微弱导致空斑形成不明显对试验造成的误差,实时监测形成完整细胞效应图谱,该技术已经应用于多项基于细胞的检测,结果可信度较高[12-16]。MTT法在试验过程中需将细胞液吸出,此过程可能导致细胞的流失影响试验结果准确性,故采用加大重复试验来避免误差形成。而体外细胞试验具有操作方面、灵敏、不易受外界因素干扰的优点。
通过查阅大量文献设定不同浓度的人参提取液作用于感染IHNV的CCB细胞,以探究人参提取液对IHNV的抑制作用及最适抑制浓度,为今后以人参作为防治IHNV的有效药物奠定试验基础,同时为结合我国传统中药开发防治IHNV的新型药物提供有效参考。
[1] Dietzgen R G, Calisher C H,etal. Famliy-Rhabdoviridae[J].Virus Taxonomy, 2012, 686-713.
[2] Rucker R R, Whipple W J,etal. A contagious disease of salmon possibly of virus origin[J]. Fish and Wild life Service,1953, 35-46.
[3] Winton J.R. Recent advances in detection and control of infectioushema to poietic necrosis virus in aquaculture[J]. Annual Review of Fish Diseases,1991.,Pages 83-93.
[4] Lapatra S E, Lauda K A, Jones G R,etal. Susceptibility and humoral response of Brown trout X lake trout hybrids to infectious hematopoietic necrosis virus:a model for examining disease resistance mechanisms[J].Aquaculture,1996,146(3):179-188.
[5] 习欠云,刘小龙,方淑娴,等.人参多糖复合物对南美白对虾免疫增强效果的研究[J].2009,30(6):15-17.
Xi Q Y, Liu X L, Fang S X,etal. Study on ginseng polysaccharide on immune effect of Penaeus vannamei[J].2009,30(6):15-17.
[6] 赵 昕.人参皂甙Rb1体外抗PRRSV的作用及其机制[D].山西农业大学,2013:37-38.
Zhao X ,etal. Effect of ginsenoside Rb1 on PRRSV in vitro and its mechanism[D]. Shanxi Agricultural University. 2013:37-38.
[7] 徐 燕,典灵辉,陆江赢,等.德庆首乌二苯乙烯苷提取的研究[J].辽宁化工,2011,10(1):4-6.
Xu Y, Dian L H, Lu J Y,etal. Study on Extraction of two Stilbene Glucoside from Deqin Shouwu[J]. Liaoning Chemical Industry,2011,10(1):4-6.
[8] 刘 丹,汤海峰,张三奇,等.虎杖中有效成分提取方法的研究[J].中成药,2007,29(4):516-521.
Liu D, Tang H F, Zhang S Q,etal. Study on extraction method of effective components in Polygonum cuspidatum [J]. Proprietary Chinese Medicine, 2007,29(4):516-521.
[9] 殷 震,刘景华. 动物病毒学(第2版)[M].北京:科学出版社,1997.
Yin Z, Liu J H,etal. Animal Virology (Second Edition)[M]. Beijing: Science press,1997.
[10] Solly K, Wang X, Xu X,etal. 2004. Application ofreal-time cell electronic sensing (RT-CES) technology to cell-based assays[J]. Assay Drug Dev. Technol, 2:363-372.
[11] Dong C X, Hayaashi K, Mizukoshi Y,etal. Structure of acidic polysaccharides from Basella rubra L and their antiviral effects[J]. Carbohyd Polym, 2011(84):1084-1092.
[12] Atienza J M, Zhu J, Wang X,etal. 2005. Dynamicmonitoring of cell adhesion and spreading on microelectronic sensor arrays[J]. Biomol Screen, 10:795-805.
[13] Ke Y, Wu D, Princen F,etal. 2007. Role of Gab2 in mammary tumorigenesisand metastasis[J]. Oncogene, 26:4951-4960.
[14] Xing J Z, Zhu L, Jackson J A,etal. 2005. Dynamic monitoring of cytotoxicity on microelectronic sensors[J]. Chem Res Toxicol, 18:154-161.
[15] Yu N, Atienza J M, Bernard J,etal. 2006. Real-time monitoring of morphological changes in living cellsby electronic cell sensor arrays: an approach to study G protein-coupledreceptors[J]. Anal Chem, 78:35-43.
[16] 胡 潜,李 强, 张显昱,等.传染性造血器官坏死病毒(IHNV)研究进展[J]. 现代农业科技, 2014, 4:48.
Hu Q, Li Q, Zhang X Y,etal. Research progress on dye-associated hematopoietic necrosis virus (IHNV)[J]. Modern Agricultural Science and Technology, 2014, 4:48.
