物理处理对大豆蛋白-磷脂酰胆碱结构影响的拉曼分析
2018-03-13江连洲张潇元朱一方OLGAOlegovnaBabich王中江
江连洲 张潇元 朱一方 李 杨 OLGA Olegovna Babich 王中江
(1.东北农业大学食品学院, 哈尔滨 150030; 2.克麦罗沃国立大学食品科学与技术学院, 克麦罗沃 650056)
0 引言
大豆蛋白由于蛋白含量高、乳化性能好以及利于机体消化吸收而被广泛应用于食品工业生产中。但是天然大豆蛋白难以满足工业生产中对蛋白质功能特性的不同需求,需对其进行适度的改性[1]。磷脂酰胆碱作为安全、无毒副作用并具有治疗与保健功能的天然两性离子表面活性剂,与蛋白质的相互作用会影响蛋白质结构及乳液界面特性,进而增强了其乳化能力,并影响到蛋白质的微胶囊化性质[2-4]。
大豆蛋白-磷脂酰胆碱复合体系普遍存在于传统豆制品加工、新兴全豆类制品加工中。目前国内外研究者关于蛋白-磷脂酰胆碱复合体系的研究较为成熟,多集中于对复合比例、乳化条件、复合物相互作用机制及乳液稳定机制的研究[5-12]。众多研究均表明,磷脂酰胆碱的添加可以使蛋白质乳液的粒径降低。然而,已有关于大豆蛋白-磷脂酰胆碱相互作用机理的影响研究仍不清晰,超声、高压处理后大豆蛋白-磷脂酰胆碱复合体系对蛋白质结构变化的影响研究也尚属空白。
本文利用拉曼光谱分析超声、高压均质作用于大豆蛋白-磷脂酰胆碱复合体系中的各种功能键与复合磷脂酰胆碱后蛋白质二级结构的变化。通过拉曼光谱图频率和强度反映大豆蛋白-磷脂酰胆碱复合体系所处环境和构象变化等信息,以期通过结构变化的辨认为探清超声及高压均质处理下大豆蛋白-磷脂酰胆碱复合物加工处理提供参考和指导。
1 材料与方法
1.1 材料与试剂
大豆蛋白,蛋白质量浓度892.1 mg/mL(山东省高唐蓝山集团);磷脂酰胆碱(北京索莱宝科技有限公司);氢氧化钠、磷酸二氢钠、磷酸氢二钠(分析纯试剂)。
1.2 仪器与设备
T18 Basic型高速分散机/匀浆机(德国IKA公司);超声波细胞破碎仪(宁波新芝生物科技股份有限公司);实验型高压均质机(英国Stansted Fluid Power公司);79-1型磁力加热搅拌器(武汉格莱莫检测设备有限公司);XW-80A型旋涡混合器(上海青浦沪西仪器厂);PerkinElmer Raman Station 400型拉曼光谱仪(美国PE公司);PH SJ-4A型实验室pH计(中国上海雷磁公司)。
1.3 方法
1.3.1大豆蛋白-磷脂酰胆碱复合物的制备
参照LEE等[13]方法将质量浓度为100 mg/mL的大豆蛋白和20 mg/mL磷脂酰胆碱溶于缓冲液(0.1 mol/L、pH值7.0磷酸盐缓冲溶液)中,室温(20℃)下搅拌2 h,另取质量浓度为100 mg/mL的大豆蛋白溶于缓冲液(0.1 mol/L、pH值7.0磷酸盐缓冲溶液)中,室温下搅拌2 h。分别用高速乳化均质机进行均质处理,处理条件为20 000 r/min剪切5 min[14]。
1.3.2超声处理大豆蛋白-磷脂酰胆碱复合乳液
将粗乳液通过超声波细胞破碎仪进一步处理。超声处理的方法及条件设定参照HU等[15]方法并进行一定修改。将超声波处理器的钛探头(直径0.636 cm)插入液面,在20 kHz下在输出功率为500 W下处理9 min,超声时间5 s,间隔时间5 s,并每3 min向冰水浴中加入冰块保持低温。
1.3.3高压均质处理大豆蛋白-磷脂复合乳液
将粗乳液通过高压均质机进一步均质乳化。高压均质处理的方法及条件设定参照DYBOWSKA[16]方法并进行一定修改。高压均质机采用均质压力为100 MPa,均质次数为4次,并每均质一次将样品置于冰水浴中保持低温。
1.3.4拉曼光谱的测定及分析
拉曼光谱的测定参照HERRERO等[17]方法并进行一定修改。相关参数设定为激发光波长785 nm,激光功率80 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10次,4次扫描进行累加。以苯丙氨酸((1 003±1) cm-1)作为归一化因子,得到大豆蛋白及磷脂的拉曼谱图。谱图基线校正、谱峰归属查找采用ACD Labs V12软件。
1.3.5数据统计分析
每次试验做3次平行,结果用平均值±标准差表示,利用SPSS Statistics 22软件对数据进行ANOVA差异显著性分析,P<0.05为显著性差异。采用Origin 9.1软件、ACD Labs V12软件、Raman Spectral Analysis Package Version 2.1软件进行数据分析、图表处理及图谱分析处理。
2 结果与分析
2.1 大豆蛋白主链结构特征拉曼光谱分析
不同处理大豆蛋白及磷脂酰胆碱的拉曼谱图如图1所示,英文缩写符号如表1所示,依据已有研究进行各峰位归属分别列于表2中[18]。拉曼光谱中谱峰位置及强度的变化主要用于研究大豆蛋白二级结构及疏水微环境变化。
大豆蛋白的构象主要由酰胺Ⅰ带的拉曼特征峰确定,酰胺Ⅰ带拉曼特征峰位置为:α-螺旋结构,1 645~1 660 cm-1;β-折叠结构,1 665~1 680 cm-1;β-转角结构,1 680~1 690 cm-1;无规卷曲结构,1 660~1 670 cm-1。本实验中大豆蛋白的拉曼图谱二级结构的定量计算由Raman Spectral Analysis Package Version 2.1软件完成。
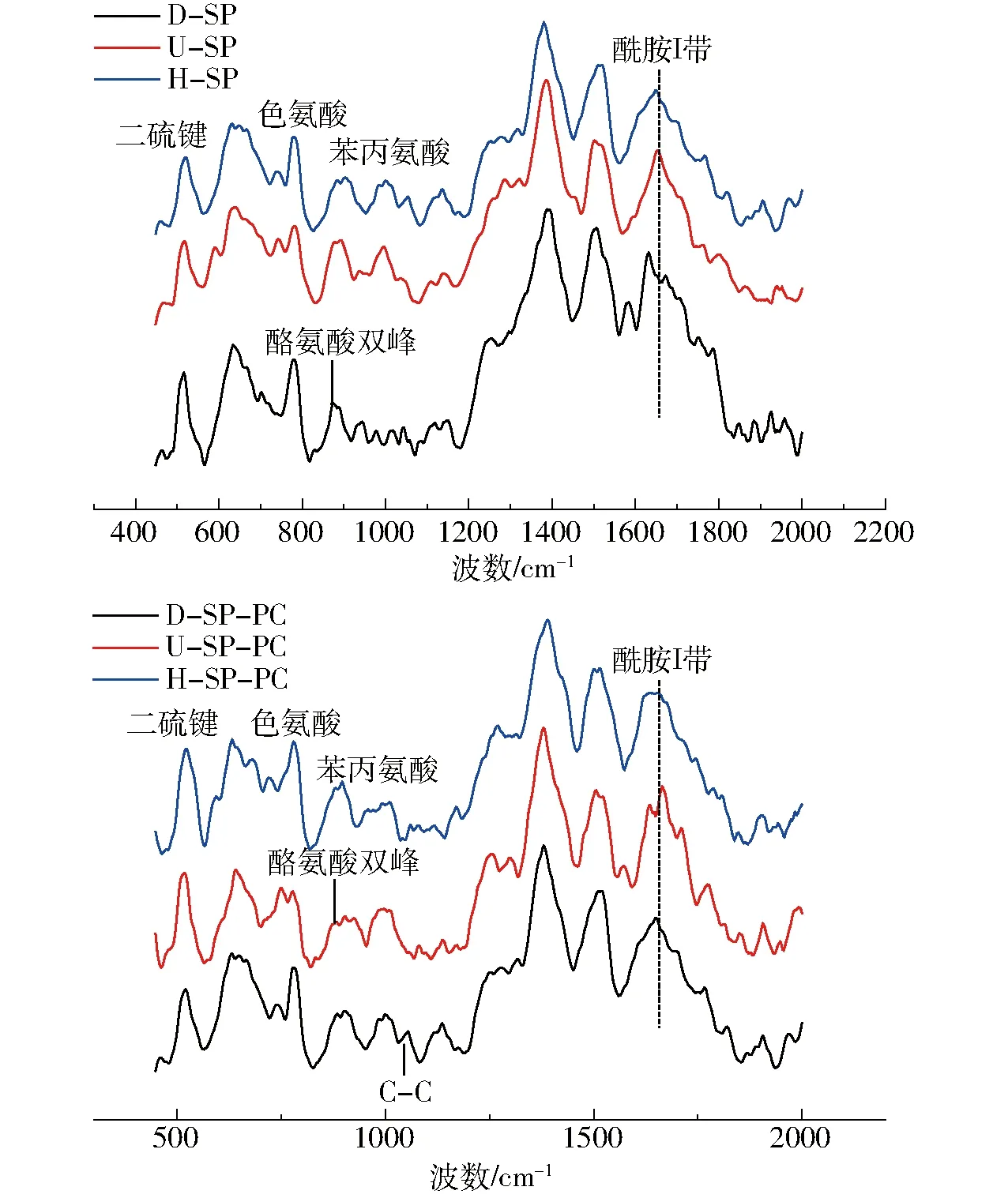
图1 不同处理条件下大豆蛋白-磷脂酰胆碱复合体系的拉曼图谱Fig.1 Raman spectra of soybean protein-phosphatidylcholine composite system in different treatments
英文缩写英文名称中文名称D-SPdispersiontreatmentsoybeanprotein分散处理大豆蛋白D-SP-PCdispersiontreatmentsoybeanprotein-phosphatidylcholine分散处理大豆蛋白-磷脂U-SPultrasonictreatmentsoybeanprotein超声处理大豆蛋白U-SP-PCultrasonictreatmentsoybeanprotein-phosphatidylcholine超声处理大豆蛋白-磷脂H-SPhighpressurehomogeneoussoybeanprotein高压均质处理大豆蛋白H-SP-PChomogeneoussoybeanprotein-phosphatidylcholine高压均质处理大豆蛋白-磷脂

表2 大豆蛋白拉曼峰位归属Tab.2 Tentative assignment of some bands in Raman spectrum of soybean protein
蛋白质的酰胺Ⅰ带及酰胺Ⅲ带常被用于检测蛋白质的主链结构,拉曼谱图中1 665~1 675 cm-1处谱带表明大豆蛋白中主要存在α-螺旋结构及无规卷曲结构。在本研究中蛋白质的酰胺Ⅰ带用于研究蛋白质二级结构相对含量的定量分析[19],测试结果如表3所示。结果表明,大豆蛋白二级结构组成为:30.59% α-螺旋结构、24.28% β-折叠结构、16.76% β-转角结构及28.37%无规卷曲结构。
通过比较可知,超声处理及高压均质处理均提高了大豆蛋白α-螺旋结构及无规则卷曲结构含量,并降低了大豆蛋白的β-构型结构。
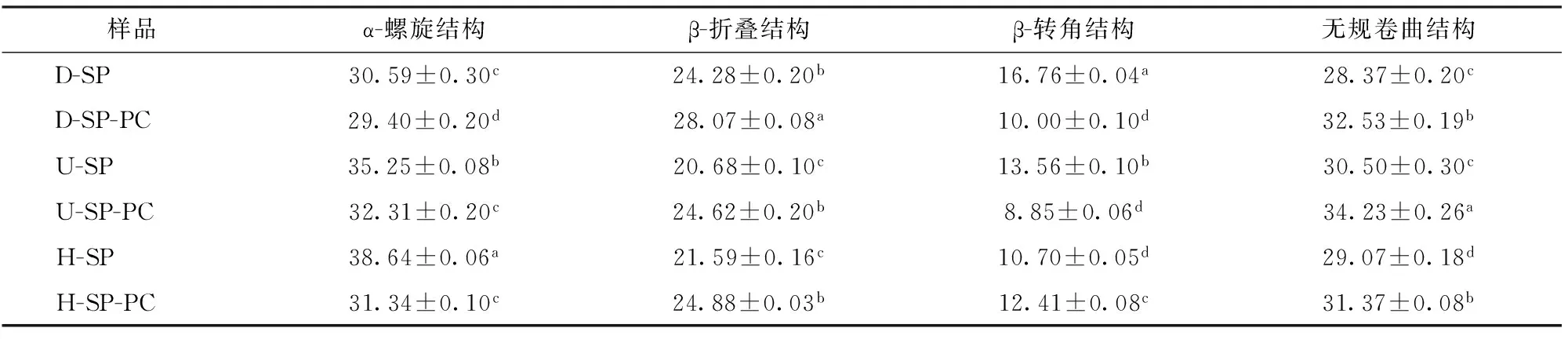
表3 不同处理样品蛋白二级结构组分相对含量Tab.3 Percentages of protein secondary structure of sample with different treatments %
注:同一列数据后不同字母代表差异显著(P<0.05),下同。
研究表明高压均质产生的压力作用、高频振荡和对流撞击等机械力诱导蛋白质结构发生改变[20],在本研究中高压均质作用下大豆蛋白的有序结构增多,FLOURY等[21]研究发现高压均质可使大豆蛋白的变性温度升高,加大了大分子结构的稳定性。研究表明高压均质作用下蛋白质α-螺旋结构含量增加、β-折叠结构含量降低,与本研究结果相同,研究指出均质处理使大豆蛋白内部氢键结构排列发生改变[22]。
超声处理下大豆蛋白的无序结构含量较多,这可能是由于超声处理下大豆蛋白分子刚性结构减弱,柔性结构增加,分子由有序变得无序[23]。研究表明大豆蛋白的二级结构主要由肽链氨基酸上羰基和酰胺基团之间形成的氢键维持,超声波处理能够破坏氢键作用是本研究中大豆蛋白β-折叠结构含量降低的可能原因[24-25]。
综合比较可知,大豆蛋白-磷脂酰胆碱交互作用显著降低了蛋白质α-螺旋结构,并转变为无规则卷曲结构及β-折叠结构。超声处理及高压均质作用下大豆蛋白-磷脂酰胆碱复合物中蛋白质α-螺旋结构均低于高速分散处理组,而β-折叠结构及无规卷曲结构含量较高。这可能是由于超声处理及高压均质作用可促进大豆蛋白-磷脂酰胆碱交互作用,进而改变了大豆蛋白二级结构。毕爽等[20]研究推测高压均质作用下卵磷脂结合到大豆蛋白α-螺旋结构中的疏水性氨基酸区域,表现为α-螺旋结构含量降低,β-折叠结构及β-转角结构含量升高。经过不同条件高压均质处理后,蛋白质中二级结构含量均发生了明显的变化。
2.2 大豆蛋白侧链结构特征拉曼光谱分析
如表4所示,色氨酸在拉曼谱图上表现出多个拉曼谱带用于监测蛋白质微环境极性及氢键变化规律,LI-CHAN[26]研究表明760 cm-1附近区域的拉曼峰强度降低与色氨酸残基由原本“包埋式”转变为“暴露式”有关。已有研究表明热变性造成蛋白质结构的破坏,进而引起色氨酸残基的暴露,在拉曼谱图中表现为色氨酸谱带强度的降低[27-30]。然而,在本研究中,超声处理下760 cm-1附近区域的色氨酸拉曼峰强度增加,该区域归属于色氨酸残基的伸缩振动,表明此条件下色氨酸残基更趋于“暴露态”。而高压均质作用下大豆蛋白色氨酸微环境并未发生显著变化。
与磷脂酰胆碱的交互作用下,大豆蛋白的色氨酸拉曼光谱强度有所增大,这是由于交互作用下大豆蛋白色氨酸被重新包裹进入分子内部,另一可能原因是大豆蛋白与磷脂酰胆碱交互作用位点为蛋白质的疏水侧链基团。超声处理及高压均质作用下色氨酸拉曼光谱归属峰强度显著增大,进一步验证了超声处理及高压均质作用更大程度地促进了大豆蛋白-磷脂酰胆碱的交互作用。
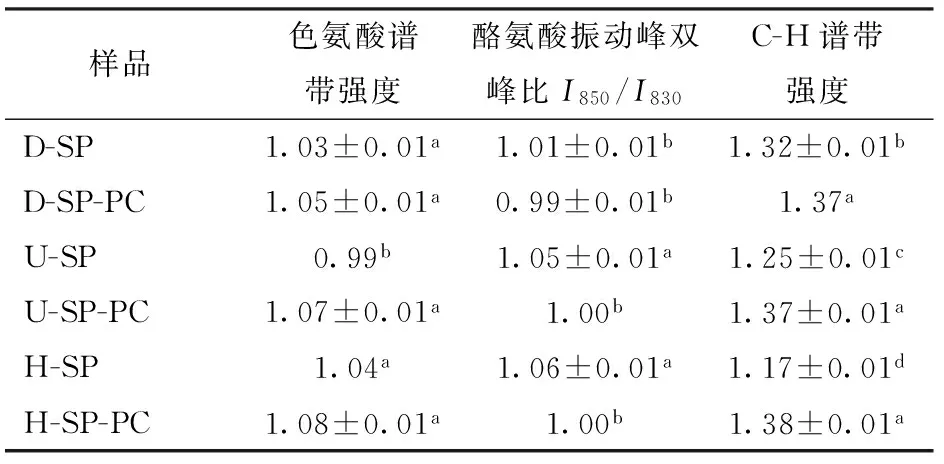
表4 不同处理条件下大豆蛋白侧链基团谱带强度Tab.4 Intensities of tryptophan band, tyrosyl doublet of soy protein with different treatments
850 cm-1和830 cm-1是酪氨酸残基苯环的呼吸振动和面外弯曲倍频之间的费米共振[30],通过两条谱线的强度比,推测酪氨酸是氢键的供体或是受体。若I850/I830比值为2.5,酪氨酸苯环上的羟基氧原子是强氢键受体;如果I850/I830比值为1.25,此时酪氨酸苯环上的羟基氧原子为中强度氢键的供体或受体;如果比值为0.3,表明酪氨酸苯环上的羟基氧原子是强氢键的供体。在本研究中,I850/I830比值分布于0.99~1.06之间,表明所测试蛋白的酪氨酸残基暴露于溶液的极性微环境下作为中性强度氢键的供体或受体。
通过比较可知,超声处理及高压均质作用均显著提高了大豆蛋白酪氨酸拉曼归属峰强度,表明两者作用下大豆蛋白酪氨酸残基更趋于“暴露态”,而大豆蛋白-磷脂酰胆碱交互作用下大豆蛋白酪氨酸拉曼归属峰强度有所降低,进一步验证了大豆蛋白与磷脂酰胆碱交互作用位点可能为蛋白质的疏水侧链基团。
1 450 cm-1是脂肪族氨基酸的拉曼归属谱线,研究表明脂肪族氨基酸的拉曼归属峰强度降低与脂肪族氨基酸暴露有关[28],在本研究中超声处理及高压均质作用下大豆蛋白在1 450 cm-1处的拉曼归属峰均有显著降低、脂肪族氨基酸趋于“暴露态”,这与大豆蛋白结构的局部解折叠及二级结构转变有关[27]。而交互作用下大豆蛋白脂肪族氨基酸拉曼归属谱带强度均有所增大,这是由于交互作用下脂肪族氨基酸更多包埋于分子内部的原因。而超声处理及高压均质处理并未进一步改变大豆蛋白-磷脂酰胆碱复合物中蛋白质脂肪族氨基的谱带强度。
2.3 大豆蛋白二硫键构型的拉曼光谱分析
二硫键是蛋白质三级结构的重要维持力,500~550 cm-1范围内是二硫键的特征谱带。二硫键在不同振动模式下所反映出来的拉曼位移有所不同,如500~510 cm-1处为g-g-g(旁-旁-旁)模式,515~525 cm-1为g-g-t(旁-旁-反)模式,535~545 cm-1为t-g-t(反-旁-反)模式[17]。由图1可知,大豆蛋白二硫键拉曼归属峰位于516 cm-1处,表明大豆蛋白二硫键主要构型为g-g-t模式,而超声处理、高压均质作用下,大豆蛋白二硫键构型未发生显著变化,仍保持g-g-t振动模式。而大豆蛋白-磷脂酰胆碱交互作用也未改变二硫键构型,表现为大豆蛋白-磷脂酰胆碱复合体系组的二硫键拉曼归属峰均位于515~520 cm-1范围内。
2.4 磷脂酰胆碱结构的拉曼光谱分析
拉曼光谱中的C—C骨架振动可以用来表征磷脂酰胆碱脂链的反式-旁式构象变化。面内和面外的C—C伸缩振动出现在1 000~1 200 cm-1区域内,其中1 064 cm-1和1 129 cm-1谱线代表了C—C链反式构象的伸缩振动,而1 090 cm-1谱线则归属于C—C键扭曲式异构体的贡献[31]。在本研究中考虑到大豆蛋白的拉曼吸收,采用差谱对磷脂酰胆碱的结构进行光谱分析,通过I1090/I1064及I1090/I1129表示脂链的无序程度,具体结果如表5所示。

表5 不同处理条件下磷脂酰胆碱I1090/I1064及I1090/I1129拉曼峰强度Tab.5 Normalized intensities of I1090/I1064 and I1090/I1129 soybean protein- phosphatidyl choline with different treatments
由表5可知,超声处理及高压均质作用下,磷脂酰胆碱的拉曼峰高强度比值I1090/I1064及I1090/I1129均有所增加,表明磷脂酰胆碱脂链中C—C的旁式构象增多,脂链的无序性增强,这是由于大豆蛋白与磷脂酰胆碱在超声处理及高压均质作用下表现出更强的交互作用,进一步证明大豆蛋白-磷脂酰胆碱的交互作用位点为大豆蛋白疏水氨基酸侧链及磷脂酰胆碱疏水脂链,两者之间的疏水作用是大豆蛋白-磷脂酰胆碱交互作用的主要形式。
3 结束语
以大豆蛋白、磷脂酰胆碱为原料,通过拉曼光谱分析大豆蛋白-磷脂酰胆碱复合物与大豆蛋白的各种功能键与蛋白质二级结构的变化。结果表明,超声处理及高压均质处理均提高了大豆蛋白α-螺旋结构及无规则卷曲结构含量,并降低了大豆蛋白的β-构型结构。大豆蛋白-磷脂酰胆碱交互作用显著降低了蛋白质α-螺旋结构,并转变为无规则卷曲结构及β-折叠结构。超声处理及高压均质作用下大豆蛋白-磷脂酰胆碱复合物中蛋白质α-螺旋结构均低于高速分散处理组,而β-折叠结构及无规则卷曲结构含量较高。与磷脂酰胆碱复合后,超声、高压均质作用改变了大豆蛋白色氨酸、酪氨酸所处的微环境,具体表现为大豆蛋白色氨酸拉曼光谱强度有所增大以及色氨酸、酪氨酸残基由“包埋态”趋于“暴露态”。进一步证明因超声处理及高压均质作用而暴露的疏水性基团使其更易与磷脂酰胆碱发生疏水相互作用,更大程度地促进了大豆蛋白-磷脂酰胆碱的交互作用。大豆蛋白-磷脂酰胆碱的交互作用位点为大豆蛋白疏水氨基酸侧链及磷脂酰胆碱疏水脂链,两者之间的疏水作用是大豆蛋白-磷脂酰胆碱交互作用的主要形式。超声处理、高压均质作用下,大豆蛋白二硫键构型未发生显著变化,仍保持g-g-t振动模式。蛋白-磷脂酰胆碱交互作用也未改变二硫键构型。本研究为超声、高压均质作用于大豆蛋白-磷脂酰胆碱复合产品提供了一定的理论依据。
1 MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk [J]. Food Chemistry, 2015, 173:694-701.
2 McCANN T H, SMALL D M, BATEY I L, et al. Protein-lipid interactions in gluten elucidated using acetic acid fractionation [J]. Food Chemistry, 2009, 115(1):105-112.
3 McCRAE C H. Heat stability of milk emulsions: phospholipid-protein interactions [J]. International Dairy Journal, 1999, 9(3):227-231.
4 NIEUWENHUYZEN W V, SZUHAJ B F. Effects of lecithins and proteins on the stability of emulsions [J]. Lipid, 1998, 100(7):282-291.
5 BECKWITH A C. Interaction of phosphatidylocholine vesicles with soybean 7S and 11S globulin proteins [J]. Journal of Agricultural & Food Chemistry, 1984, 32(6):1397-1402.
6 WAGNER J R, TOMAS M C, LUPANO C E. Influence of pH-calcium relationship on soybean proteins-lecithin interaction and stability of oil in water (O/W) emulsions [J]. Functional Properties of Food Components, 2007:23-31.
7 FANG Y, DALGLEISH D G. Casein adsorption on the surfaces of oil-in-water emulsions modified by lecithin [J]. Colloids & Surfaces B Biointerfaces, 1993, 1(6):357-364.
8 MANTOVANI R A, CAVALLIERIL, NETTO F M, et al. Stability and in vitro digestibility of emulsions containing lecithin and whey proteins [J]. Food & Function, 2013, 4(9):1322-1331.
9 PONGSAWATMANIT R, HARNSILAWAT T, MCCLEMENTS D J. Influence of alginate, pH and ultrasound treatment on palm oil-in-water emulsions stabilized by β-lactoglobulin[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2006, 287(1-3):59-67.

LI Jufang, LÜ Ying, XU Jingting, et al. Solution physicochemical properties and rheological behavior of lecithin-soybean protein complex [J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2013, 44(8):207-212.(in Chinese)
11 PUPPO C, CHAPLEAU N, SPERONI F, et al. Physicochemical modifications of high-pressure-treated soybean protein isolates [J]. Journal of Agricultural & Food Chemistry, 2004, 52(6):1564-1571.
12 涂宗财, 汪菁琴, 阮榕生,等. 超高压均质对大豆分离蛋白功能特性的影响[J]. 食品工业科技, 2006, 27(1):66-67.
TU Zongcai, WANG Qingqin, RUAN Rongsheng, et al. Effect of ultrahigh pressure homogenization on functional properties of soybean protein isolate[J]. Science and Technology of Industry, 2006, 27(1):66-67.(in Chinese)
13 LEE S J, MCCLEMENTS D J. Fabrication of protein-stabilized nanoemulsions using a combined homogenization and amphiphilic solvent dissolution/evaporation approach [J]. Food Hydrocolloids, 2010, 24(6-7):560-569.
14 TAN C P, NAKAJIMA M. Effect of polyglycerol esters of fatty acids on physicochemical properties and stability of beta-carotene nanodispersions prepared by emulsification/evaporation method[J]. Journal of the Science of Food & Agriculture, 2005, 85(1):121-126.
15 HU H, WU J, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions [J]. Food Hydrocolloids, 2013, 30(2):647-655.
16 DYBOWSKA B E. Rheology of whey protein O/W emulsions obtained by one and two stage homogenization [J]. Milchwissenschaft-milk Science International, 2001, 56(11):628-632.
17 HERRERO A M, JIMENEZCOLMENROI F, CARMONA P. Elucidation of structural changes in soy protein isolate upon heating by Raman spectroscopy [J]. International Journal of Food Science & Technology, 2009, 44(4):711-717.
18 王中江, 张潇元, 隋晓楠,等. 热处理大豆蛋白体外消化产物结构特征分析[J]. 食品科学, 2017,38(1):20-26.
WANG Zhongjiang, ZHANG Xiaoyuan, SUI Xiaonan, et al. Structural characteristics of in vitro digestion products of heat-treated soybean protein[J]. Food Science, 2017,38(1):20-26. (in Chinese)
19 黄群, 金永国, 马美湖,等. 超高压处理对S-卵白蛋白构象与功能特性的影响[J/OL]. 农业机械学报, 2013, 44(3):161-166.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20130330&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2013.03.030.
HUANG Qun, JIN Yongguo, MA Meihu, et al. Effect of ultra high pressure on conformation and functional properties of S-ovalbumin[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2013, 44(3):161-166. (in Chinese)
20 毕爽, 李杨, 隋晓楠,等. 高压均质对大豆蛋白-磷脂复合体系结构及理化/功能性质的影响[J].食品科学, 2017,38(5):148-153.
BI Shuang, LI Yang, SUI Xiaonan, et al. Effect of high pressure homogenization on structural, physicochemical and functional properties of soybean protein-lecithin composite system[J]. Food Science, 2017, 38(5): 148-153. (in Chinese)
21 FLOURY J, DESRUMAUX A, LARDIERES J. Effect of high-pressure homogenization on droplet size distributions and rheological properties of model oil-in-water emulsions [J]. Innovative Food Science & Emerging Technologies, 2000, 1(2):127-134.
22 张媛. 超高压均质对大豆分离蛋白影响及制备复合蛋白膜研究[D].哈尔滨: 东北农业大学, 2016.
ZHANG Yuan.Effect of ultra-high pressure homogenization on soybean protein isolate and study on preparation of composite protein films[D]. Harbin: Northeast Agricultural University, 2016. (in Chinese)
23 包中宇. 超声波技术对大豆分离蛋白功能性质、结构及凝胶特性的影响[D].南昌: 南昌大学, 2015.
BAO Zhongyu.Effects on the functional, structural and gelation property of soybean protein isolate treated by ultrasound[D]. Nanchang: Nanchang University, 2015. (in Chinese)
24 GULSEREN I, GUZEY D, BRUCE B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions [J]. Ultrasonics Sonochemistry, 2007, 14(2):173-183.
25 CHANDRAPALA J, ZISU B, PALMER M, et al. Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate [J]. Ultrasonics Sonochemistry, 2011, 18(5):951-957.
26 LI-CHAN E C Y. The applications of Raman spectroscopy in food science [J]. Trends in Food Science & Technology, 1996, 7(11):361-370.
27 XU X L, HAN M Y, FEI Y, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic [J]. Meat Science, 2011, 87(3):159-164.
28 HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems [J]. Critical Reviews in Food Science and Nutrition, 2008, 48(6):512-523.
29 NGARIZE S, ADAMS A, HOWELL N K. Studies on egg albumen and whey protein interactions by FT-Raman spectroscopy and rheology [J]. Food Hydrocolloids, 2004, 18(1):49-59.
30 FERRER E G, GOMEZ A V, ANON M C, et al. Structural changes in gluten protein structure after addition of emulsifier. A Raman spectroscopy study [J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2011, 79(1):278-281.
31 许以明. 拉曼光谱及其在结构生物学中的应用[M]. 北京:化学工业出版社, 2005.
