头穴透刺对脑出血大鼠脑组织中脾酪氨酸激酶表达的影响*
2018-03-13刘晓莹于学平
刘晓莹,邹 伟,于学平
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
脑出血(Intracerebral hemorrhage,ICH)作为一种致命性的中风,全世界范围内每年约有200万人患病[1-4]。现有的治疗方法在改善患者预后方面疗效不理想,炎症反应在ICH导致的神经系统损伤中作用尤为重要[5-7]。所以识别ICH后炎症反应的分子机制,有效调控炎症反应将为治疗脑出血提供新方向[8]。脾酪氨酸激酶(Spleen tyrosine kinase,SYK)作为蛋白酪氨酸激酶(PTK)家族的成员,是一种非受体型酪氨酸激酶[9]。作为治疗炎症和自身免疫性疾病的有效靶点,SYK已被大量实验证实参与了中风、癌症、动脉粥样硬化等多种疾病的发生发展过程[10-13],已成为医学研究的新热点。针灸作为中国传统医学的重要组成部分,在降低中风患者致残率、促进神经功能恢复等方面的疗效显著,已在世界范围内得到了广泛的关注和认可[14-15],但其机理尚未完全清楚。已有研究证实针刺“百会”透“曲鬓”具有拮抗脑出血炎性脑损伤的作用[16],笔者采用自体血输注法制备大鼠脑出血模型,观察针刺“百会”透“曲鬓”穴对脑出血大鼠SYK表达的影响,从而揭示“百会”透“曲鬓”针刺法治疗急性期脑出血的作用及可能的作用机制,以期为针灸治疗脑出血提供新思路。
1 材料与方法
1.1 实验仪器与试剂
台式牙钻机(中国上海齿科医械厂,307-6型);立体定位仪(中国成都仪器厂,STW-1型);低温冷冻离心机(德国Thermo公司,002421);电泳仪(美国BIO-RAD公司,1645070);切片机(德国菜卡公司,2135);显微摄影成像系统(美国moticam公司,3000);Rabbit Anti-SYK antibody (Bioss, bs-0685R);Mouse Anti-beta-Actin antibody(Bioss,bsm-33036M)。
1.2 动物分组
从哈尔滨兽医研究所购得成年雄性SD大鼠156只,SPF级,体质量280~320 g。随机分为假手术组(n=12)、模型组(n=48)、抑制剂组(n=48)和针刺组(n=48);每组按术后6 h、12 h、24 h和72 h分为4个亚组(n=12)。
1.3 脑出血模型制备
脑出血模型:戊巴比妥(60 mg/kg)腹腔注射麻醉大鼠,仰卧位固定于立体定位仪上,头皮中线切口,暴露前囟点和冠状缝。定于前囟点后侧0.2 mm与右侧3.5 mm交汇处,用直径1 mm牙科钻钻孔至硬脑膜表面;取大鼠自体尾尖血50 μL,以20 μL/min速度注入尾壳核(AP:0.24 mm, L:3.5 mm, D:6 mm)[17],留针5 min后退出微量注射器。牙科水泥封孔,缝合、包扎、消毒。根据Zea Longa[18]的5分制评分标准,1~3分表明造模成功。
假手术动物模型:大鼠接受与模型组相同的各项操作,断尾取尾尖血50 μL,微量注射器进针后不注血,留针5 min后退针。
1.4 干预方法
针刺组:百会、曲鬓穴定位参照《实验动物穴位图谱》,常规剪毛消毒,以0.30 mm×25 mm针灸针快速刺入百会穴帽状腱膜下,并向右下方曲鬓穴透刺,进针深度15 mm,以200转/min小幅度捻转,每捻针5 min后间隔5 min,反复操作,共留针30 min。每12 h针刺1次。
假手术和模型组:在针刺治疗相应时间内抓取固定1次,固定30 min,不做任何处理。
抑制剂组:脑出血造模后1 h腹腔注射Piceatannol(34.62 mg/kg)。
1.5 指标检测
1.5.1 神经系统功能评估 分别在造模后6 h、12 h、24 h、72 h应用mNSS评分系统[19]进行神经功能评分。
1.5.2 免疫组化 戊巴比妥(60 mg/kg)腹腔注射麻醉大鼠,4%多聚甲醛灌流,大鼠断头取脑,多聚甲醛后固定,脱水,石蜡包埋,脑组织切片(5 μm)。美国moticam3000显微摄影成像系统,每张切片在400倍显微镜下随机选取血肿周围区5个非重叠视野,计数阳性细胞数的平均值[20]。
1.5.3 Western Blot 分别取脑出血(ICH)后6 h、12 h、24 h和72 h实验组大鼠右侧(出血侧)大脑半球,裂解脑组织;取总蛋白50 μg; SDS-PAGE 电泳,然后转移到PVDF膜上,再用5%的脱脂牛奶阻封闭,进行一抗孵育、二抗孵育;DAB试剂盒显色,将膜置于扫描仪中扫描,用凝胶图像处理系统分析目标带的分子量和净光密度值[21]。
1.6 统计学分析
所有数据均用Graph Pad Prism6统计软件进行分析。神经功能评分、免疫组化、western Blot及ELISA结果应用单因素方差分析结合Tukey检验,显著性差异为P<0.05 。
2 结果
2.1 针刺治疗对脑出血大鼠神经功能影响
如表1所示,与假手术组相比各时间点模型组mNSS评分显著升高(P<0.05);与模型组相比相同时间点针刺组与抑制剂组评分明显降低(P<0.05);针刺组与抑制剂组组间比较无显著差异(P>0.05)。
2.2 针刺治疗对脑出血大鼠SYK水平的影响
2.2.1 不同时间点各组大鼠脑组织SYK免疫组化结果 脑组织中SYK主要在神经元及神经胶质细胞中表达。结果如表2 所示,与假手术组相比,模型组SYK水平明显升高(P<0.05);与模型组相比同一时间点针刺组、抑制剂组SYK水平显著降低(P<0.05),针刺组与抑制剂组组间比较无显著差异(P>0.05)。
2.2.2 不同时间点各组大鼠脑组织SYK蛋白水平 如图1、表3所示,与假手术组相比,模型组SYK水平明显升高(P<0.05);与模型组相比同一时间点针刺组、抑制剂组SYK蛋白表达显著降低(P<0.05),针刺组与抑制剂组组间比较无显著差异(P>0.05)。
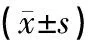
表1 各组大鼠神经功能评分情况比较
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与抑制剂组比较,③P>0.05

表2 各组大鼠血肿周围脑组织SYK阳性细胞数比较
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与抑制剂组比较,③P>0.05
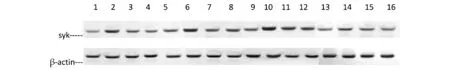
图1 各组大鼠血肿周围脑组织SYK蛋白水平比较 注:1.假手术组6 h;2.模型组6 h;3.抑制剂组6 h;4.针刺组6 h;5.假手术组12 h;6.模型组12 h;7.抑制剂组12 h;8.针刺组12 h;9.假手术组24 h;10.模型组24 h;11.抑制剂组24 h;12.针刺组24 h;13.假手术组72 h;14.模型组72 h;15.抑制剂组72 h;16.针刺组72 h

组别例数ICH6hICH12hICH24hICH72h假手术组60.58±0.160.58±0.160.58±0.160.58±0.16模型组241.0±0.17①1.02±0.17①1.23±0.13①1.06±0.22①抑制剂组240.75±0.14②0.80±0.11②0.90±0.20②0.77±0.11②针刺组240.75±0.16②③0.80±0.10②③0.93±0.20②③0.85±0.14②③
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与抑制剂组比较,③P>0.05
3 讨论
脾酪氨酸激酶(SYK)属于蛋白酪氨酸激酶(PTK)家族中的成员,是一种非受体型酪氨酸激酶[22]。人类SYK基因定位于第9号染色体长臂q22上,包含有629个氨基酸,分子量为72 kD。SYK具有三磷酸腺苷(ATP)的结合位点和自磷酸化的酪氨酸残基,含有2个串联的SH2结构域及1个酪氨酸激酶结构域SH1。SYK通过SH2区域与依赖酪氨酸的免疫受体活化基序(Immu-noreceptor tyrosine-based activation motifs,ITAM)结合而活化,作为免疫受体的关键介质在炎性细胞中表达[23-29]。
SYK广泛存在于造血细胞、淋巴细胞、成纤维细胞、血管内皮细胞上,有抑制细胞增殖分裂、影响细胞因子分泌、影响细胞分化、抑制肿瘤细胞等多种生物学功能[13,22]。SYK磷酸化活化,发生构象改变,并参与NF-kB、Akt等多个下游信号级联的活化,导致细胞分化、凋亡、增殖异常,在细胞的信号转导中起重要作用[30-31]。脑出血后,血液大量累积,激发细胞炎症反应,使单核细胞浸润,小胶质细胞活化,血脑屏障破坏,加重脑水肿,造成严重的脑损伤[32-33]。Yue He等[34]实验发现:蛛网膜下腔出血(SAH)大鼠脑组织中SYK水平显著升高,应用SYK抑制剂进行干预,可有效减少炎性细胞因子生成,减轻脑水肿程度,有效改善了SAH后大鼠神经功能损伤。也有研究表明,SYK参与了小鼠缺血性中风的病理过程,SYK抑制剂可有效缩小病灶体积,减轻脑水肿[25]。对于有着相同结构基础和相似生理病理机制的脑出血,SYK在其发病机制及治疗中的作用还未得到广泛关注。因此,研究SYK在脑出血中的表达情况,寻找特异性的抑制剂,调控免疫反应激活,将为脑出血的治疗提供新的思路。
头皮针刺法是在中国传统针灸理论基础上,结合现代解剖学、病理生理学知识发展而来的一种新型针刺疗法。在前期的实验中发现,针刺“百会”透“曲鬓”可以通过促进脑出血急性期内源性GDNF表达,发挥神经重塑作用[35];通过抑制Notch1和Hes1蛋白的表达促进神经干细胞的再生和修复[36];并且通过抑制NF-kB经典通路,有效拮抗脑出血炎性脑损伤[16]。在这项研究中,笔者发现针刺组大鼠mNSS评分明显降低,可见“百会”透“曲鬓”针刺法治疗脑出血大鼠神经功能损伤的有效性。脑出血后大鼠脑组织中SYK表达明显增多,与模型组相比针刺组SYK水平显著降低,且针刺组与抑制剂组疗效无显著差异,由此推断针刺“百会”透“曲鬓”可能是通过抑制SYK表达来调控脑出血后神经炎症反应,从而有效改善脑出血引起的神经功能损伤。
综上所述,“百会”透“曲鬓”针刺法治疗脑出血可能的作用机制之一是通过降低脑出血引起的脾酪氨酸激酶的升高,抑制下游炎症通路,减少相关炎性细胞因子的产生,减轻脑损伤。由于针刺治疗具有多靶点、多环节的特点,并非单纯作用一条路径。本研究首次提出针刺可能以SYK为干预靶点,拮抗脑出血后炎性脑损伤的假设,并通过实验得以验证。然而SYK参与脑出血炎症反应的作用机制还有待进一步研究和发现,这将为治疗脑出血神经功能损伤提供新思路。
[1] Qureshi AI,Mendelow AD,Hanley DF.Intracerebral haemorrhage[J].The Lancet,2009,373(9675):1632-1644.
[2] Broderick J,Connolly S,Feldmann E,et al.Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group[J].Circulation,2007,116(16):e391-413.
[3] Lloyd-Jones D,Adams R,Carnethon M,et al.Heart disease and stroke statistics——2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee[J].Circulation,2009,119(3):480-486.
[4] Sudlow CL,Warlow CP.Comparable studies of the incidence of stroke and its pathological types: results from an international collaboration International Stroke Incidence Collaboration[J].Stroke,1997,28(3):491-499.
[5] Mayer SA,Rincon F.Treatment of intracerebral haemorrhage[J].Lancet Neurol,2005,4(10):662-672.
[6] Keep RF,Hua Y,Xi G.Intracerebral haemorrhage: mechanisms of injury and therapeutic targets[J].Lancet Neurol,2012,11(8):720-731.
[7] Zhou Y,Wang Y,Wang J,et al.Inflammation in intracerebral hemorrhage: from mechanisms to clinical translation[J].Prog Neurobiol,2014,115:25-44.
[8] Zhao X,Sun G,Zhang J,et al.Hematoma resolution as a target for intracerebral hemorrhage treatment: role for peroxisome proliferator-activated receptor gamma in microglia/macrophages[J].Ann Neurol,2007,61(4):352-362.
[9] Singh R,Masuda ES,Payan DG.Discovery and develop-ment of spleen tyrosine kinase (SYK) inhibitors[J].J Med Chem,2012,55(8):3614-3643.
[10] Bijli KM,Fazal F,Minhajuddin M,et al.Activation of Syk by protein kinase C-delta regulates thrombin-induced intercellular adhesion molecule-1 expression in endothelial cells via tyrosine phosphorylation of RelA/p65[J].J Biol Chem,2008,283(21):14674-14684.
[11] Masuda ES,Schnitz J.SYK inhibitors as treatment for allergic rhinitis[J].Pulm Pharmacol Ther,2008,21(3):461-467.
[12] Chakraborty G,Rangaswami H,Jain S,et al.Hypoxia regulates cross-talk between Syk and Lck leading to breast cancer progression and angiogenesis[J].J Biol Chem,2006,281(16):11322-11331.
[13] 孙丽,甘我挺,韩欣,等.脾酪氨酸激酶—动脉粥样硬化新靶点及其药物研究[J].中国药理学通报,2012,28(5): 608-612.
[14] Meng X,Xu S,Lao L.Clinical acupuncture research in the West[J].Front Med,2011,5(2):134-140.
[15] Liu W,Wang X,Yang S,et al.Electroacupunctre improves motor impairment via inhibition of microglia-mediated neuroinflammation in the sensorimotor cortex after ischemic stroke[J].Life Sci,2016,151:313-322.
[16] Liu H,Sun XW,Zou W,et al.Scalp acupuncture attenuates neurological deficits in a rat model of hemorrhagic stroke[J].Complement Ther Med,2017,32:85-90.
[17] George P,Charles W.The rat brain in stereotaxic coordinates[M].6th ed.Burlington:Academic Press,2008:101-102.
[18] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[19] Lei C,Wu B,Cao T,et al.Activation of the high-mobility group Box 1 protein-receptor for advanced glycation end-products signaling pathway in rats during neurogenesis after intracerebral hemorrhage[J].Stroke,2015,46(2):500-506.
[20] Xue X,You Y,Tao J,et al.Electro-acupuncture at points of Zusanli and Quchi exerts anti-apoptotic effect through the modulation of PI3K/Akt signaling pathway[J].Neurosci Lett,2014,558:14-19.
[21] Duris K,Manaenko A,Suzuki H,et al.α7 nicotinic acetylcholine receptor agonist PNU-282987 attenuates early brain injury in a perforation model of subarachnoid hemorrhage in rats[J].Stroke,2011,42(12):3530-3536.
[22] 刘细国,袁先厚,江普查.脾酪氨酸激酶在人脑胶质瘤中的表达及其意义[J].中国临床神经外科杂志,2010,15(8):484-486.
[23] Spurgeon SE,Coffey G,Fletcher LB,et al.The selective SYK inhibitor P505-15 (PRT062607) inhibits B cell signaling and function in vitro and in vivo and augments the activity of fludarabine in chronic lymphocytic leukemia[J].J Pharmacol Exp Ther,2013,344(2):378-387.
[24] Ifrim DC,Joosten LA, Kullberg BJ.Candida albicans primes TLR cytokine responses through a Dectin-1/Raf-1-mediated pathway[J].J Immunol,2013,190(8):4129-4135.
[25] Stepanek O,Draber P,Drobek A.Nonredundant roles of Src-family kinases and Syk in the initiation of B-cell antigen receptor signaling[J].J Immunol,2013,190(4):1807-1818.
[26] Abbal C,Lambelet M,Bertaggia D,et al.Lipid raft adhesion receptors and Syk regulate selectin-dependent rolling under flow conditions[J].Blood,2006,108(10):3352-3359.
[27] Nag A,Faeder JR,Goldstein B.Shaping the response: the role of FcεRI and Syk expression levels in mast cell signaling[J].IET Syst Biol,2010,4(6):334-347.
[28] Nag A,Monine MI,Blinov ML,et al.A detailed mathematical model predicts that serial engagement of IgE-Fc epsilon RI complexes can enhance Syk activation in mast cells[J].J Immunol,2010,185(6):3268-3276.
[29] Kerrigan AM,Brown GD.Syk-coupled C-type lectins in immunity[J].Trends Immunol,2011,32(4):151-156.
[30] Sekuli A,Hudson CC,Homme JL,et al.A direct linkage between the phosphoinositide 3-kinase-AKT signaling pathway and the mammalian target of rapamycin in mitogen-stimulated and transformed cells[J].Cancer Res,2000,60(13):3504-3513.
[31] Ruland J,Mak TW.Transducing signals from antigen receptors to nuclear factor kappaB[J].Immunol Rev,2003,193:93-100.
[32] Aronowski J,Hall CE.New horizons for primary intracerebral hemorrhage treatment: experience from preclinical studies[J].Neurol Res,2005,27(3):268-279.
[33] Wang J,Dore S.Inflammation after intracerebral hemorrhage[J].J Cereb Blood Flow Metab,2007,27(5):894-908.
[34] He Y,Xu L,Li B,et al.Macrophage-Inducible C-Type Lectin/Spleen Tyrosine Kinase Signaling Pathway Contributes to Neuroinflammation After Subarachnoid Hemorrhage in Rats[J].Stroke,2015,46(8):2277-2286.
[35] 张国威,邹伟,刘芳,等.“百会”透“曲鬓”头针疗法对急性脑出血大鼠脑组织GDNF及VEGF表达的影响[J].中国中西医结合杂志,2012,32(9):1264-1270.
[36] Zou W,Chen QX,Sun XW,et al.Acupuncture inhibits Notch1 and Hes1 protein expression in the basal ganglia of rats with cerebral hemorrhage[J].Neural Regen Res,2015,10(3):457-462.
