中风膏对氧糖剥夺/再复氧损伤大鼠海马神经干细胞增殖的影响*
2018-03-13黄生辉李妍怡
黄生辉, 巩 婷, 李妍怡△
(1. 甘肃中医药大学中西医结合学院, 2. 甘肃中医药大学附属医院神经内科, 3. 甘肃省中医院脑病科, 4. 甘肃中医药大学中西医结合研究所, 兰州 730000)
缺血性脑血管病(ischemic cerebrovascular disease,ICVD)是在脑血管血流动力学改变或粥样动脉硬化等脑血管壁病变的基础上发生脑部血液供应障碍,导致相应供血区脑组织由于缺血、缺氧而出现脑组织坏死或软化,并引起短暂或持久的局部或弥漫性损害,表现为一系列神经功能缺损的临床症候群[1]。该病具有高发病率、高致残率、高死亡率、预后差、易复发等特点,居脑血管病死亡原因之首,给社会及家庭造成了严重的经济负担[2],而促进神经再生是脑缺血后神经功能恢复的关键。神经干细胞(neural stem cells,NSCs)是一类存在于中枢神经系统内具有高度增殖、自我更新及分化能力,在一定条件下能不断进行有丝分裂并分化成神经元、星形胶质细胞及少突胶质细胞的原始母细胞[3]。已有大量研究显示:单味中药、中药有效成分、中药提取物、中药复方对神经干细胞具有调控作用,可以促进缺血性脑血管疾病神经再生与修复[4-5]。气虚血瘀是缺血性脑卒中发病的基本病机,“益气活血法”符合缺血性脑卒中正气亏虚、瘀血凝滞的病机本质。气为血之帅,血为气之母;气行则血行,气滞则血瘀。血液在脉中周流不息,有赖于气的推动;而气亦需血的滋养。气虚无力,不能推动血液运行,出现气虚血瘀或气滞血瘀;而瘀血久留,耗伤正气还会加重气虚[6]。通过益气活血的治疗方法可以通过改善血流,促进神经再生等而发挥神经保护作用。体现“益气活血法”的中风膏在临床上治疗缺血性脑血管病,凡属气虚血瘀证者,具有良好的临床疗效。因此,通过中医药促进内源性神经再生修复,是治疗缺血性脑血管疾病一个有巨大希望的治疗策略,为缺血性脑卒中的治疗展现美好的前景。因此,本实验采用体外氧糖剥夺/再复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)损伤模型模拟体内脑缺血缺氧再灌注的损伤,观察体现“益气活血法”的中风膏对海马NSCs 细胞活力和细胞凋亡的影响。
1 材料与方法
1.1 实验动物
SPF级SD大鼠,由上海斯莱克公司提供,SCXK(泸)2012-0002(合格证号:0286597)。
1.2 主要试剂与仪器
DMEM/F12( 1∶1) 、B27 添加剂购自Gibco 公司,D-Hanks 液、胎牛血清购自Hyclone公司,碱性成纤维细胞生长因子( basic fibroblast growth factor,bFGF)、表皮细胞生长因子(epidermal growth factor,EGF)均购自Peprotec公司。鼠抗Nesti多克隆抗体分别购自 Santa Cruz 和 Cell Signaling Technology 公司。Annexin V-FITC/PI凋亡检测试剂盒购自杭州联科生物科技有限公司。CCK8 试剂盒、多聚赖氨酸溶液和DAPI 染色液均购自碧云天生物技术有限公司。全波长酶标仪:SpectraMax Plus 384型,美国MD;流式细胞仪:Accuri C6,BD公司。
1.3 海马神经干细胞原代培养
参照 Hiroaki等[7]方法取新生24 h内的SD乳鼠,75%酒精消毒,无菌条件下迅速断头取脑,分离双侧海马;将组织剪成1 mm3小块,用NSCs培养基重悬,轻柔吹打1 min,静置1 min后吸取细胞悬液至15 ml离心管中,往沉淀中加入培养基,吹打1 min,静置1 min,吸取细胞悬液至15 ml离心管中,如此反复操作至无肉眼可见组织块;将收集的细胞悬液依次通过200目的滤网,离心、弃去上清液,用NSCs 培养基重悬;调整细胞密度在5×105cells/ml,接种于T25培养瓶中,置37℃,5%CO2,饱和湿度培养箱中孵育,每2~3 d换液1次,培养5~7 d后当神经球直径达到100~200 μm时,采用含终浓度为20 ng/ml的bFGF和EGF、2% B27添加剂、1%双抗、1%L-谷氨酰胺的DMEM/F12(1∶1)神经干细胞培养基进行传代培养。接种于预先多聚赖氨酸(0.1 mg/ml)包被过的培养皿内贴壁培养,实验用稳定生长的第三代悬浮神经球。
1.4 海马神经干细胞的鉴定[8]
将培养板中的培养基吸弃,PBS洗2次,每次3 min;4%多聚甲醛室温固定20 min,PBS洗2次,每次3 min;0.1%TritonX-100室温破膜20 min,PBS洗2次,每次3 min;2%FBS室温封闭30 min;加入适当稀释比例的一抗(Nestin:PBS=1∶100),4℃孵育过夜;PBS洗3次,每次3 min,加入适当稀释比例的荧光二抗(1∶800),4℃避光孵育1 h;PBS洗2次,每次3 min,加入1 μg/ml的DAPI,4℃避光孵育30 min;PBS洗2次,每次3 min,倒置荧光显微镜下观察拍照。
1.5 神经干细胞氧糖剥夺/再复氧(OGD/R)损伤模型的构建[9]
除去神经干细胞培养基,D-Hanks 液清洗 3 次,将培养液改为 D-Hanks 液,置于 37℃三气培养箱缺氧2 h,通以体积分数分别为1% O2、5%CO2和94%N2混合气体。氧糖剥夺后将细胞培养液更换为神经干细胞完全培养液,并置于37℃、饱和湿度、体积分数为5%CO2培养箱中复氧培养 24 h。
1.6 CCK8法实验分组及给药方案
具体分为正常组、模型组、中风膏5%含药血清组、中风膏10%含药血清组、中风膏20%含药血清组。共设1 d、3 d、5 d、7 d四个时间点。(1)正常对照组:用神经干细胞培养基,在常规37℃,5%CO2培养箱下培养;(2)模型组: 用含10%正常大鼠血清的神经干细胞培养基,细胞在给予缺氧复氧处理后,再在37℃,5%CO2条件下培养2 h;(3)中风膏5%含药血清组:在复氧后加入含5%中风膏含药血清的神经干细胞培养基,37℃,5%CO2条件下培养2 h,其余过程同模型组。(4)中风膏10%含药血清组:在复氧后加入含10%中风膏含药血清的神经干细胞培养基(取正常大鼠外周血离心分离出血清,经56℃水浴30 min灭活。取10%体积分数加入DMEM/F12培养基中。37℃,5%CO2条件下培养2 h,其余过程同模型组。(5)中风膏20%含药血清组:在复氧后加入含20%中风膏含药血清的干细胞培养基,37℃,5%CO2条件下培养2 h,其余过程同模型组。
1.7 含药血清制备
中风膏为甘肃省中医医院院内制剂,由医院制剂室提供,批号:20161018。配方: 岷当归、黄芪、川芎、赤芍等;中风膏治疗组:1 ml/100 g灌胃。取260~280 g体重的SD大鼠20只,随机分为中药血清组、正常血清组,每组10只大鼠。给药前均禁食12 h(自由饮水)。根据中药血清药理学实验方法,灌胃药量按人与大鼠体表面积公式换算后成人给药的10倍灌胃。最大灌胃量不超过1 ml/100 g,用以制备含药血清。正常对照组则给予2 ml生理盐水灌胃。每天给药2次,每次1 ml,连续给药3 d,末次给药后1~2 h采血。10%水合氯醛腹腔麻醉,腹主动脉取血,4℃离心分离血清(3 000 r/min,20 min),56℃灭活30 min后经0.2 μm微孔滤膜过滤除菌,将每组大鼠的血清混合后,分装至1 ml离心管中,-20℃保存备用。
1.8 CCK8 法检测中风膏含药血清对NSCs增殖的影响
消化神经干细胞,以100 μl体系5×103个/孔接种至 96 孔培养板,每组6个复孔OGD/R造模后,弃去96 孔板内培养上清,每孔避光加入100 μl 含体积分数为 0.1CCK8溶液。37℃孵育1 h后终止培养。使用空白对照孔调零,在酶标仪上测定 450 nm 处吸光度值,结果以OD值表示。实验重复3次,取3次实验结果的平均值作为实验结果。
1.9 流式细胞学法检测中风膏含药血清对NSCs凋亡的影响
取对数期生长的神经干细胞,消化成单细胞接种于6 孔板内,每孔调整密度至1×106个。OGD/R造模后,用体积分数为0.0025胰蛋白酶将细胞消化,体积分数为 0.1胎牛血清中和胰蛋白酶,1 000×g离心5 min,弃去上清液,预冷的PBS洗2次离心弃上清用500 μl 1×Binding buffer 重悬细胞,加入Annexin V-FITC、PI染料4℃避光孵育10 min,上机检测。流式结果分为四个象限:左上为死细胞占全部检测细胞比、左下为正常活细胞占全部检测细胞比、右下为早期凋亡细胞占全部检测细胞比、右上为晚期凋亡细胞占全部检测细胞比。总凋亡率=早期凋亡率+晚期凋亡率。
1.10 统计学处理
2 结果
2.1 海马神经干细胞的原代培养及鉴定
传代后形成的海马神经干细胞克隆球Nestin 间接免疫荧光染色,经神经干细胞特异性标记物 Nestin 鉴定为阳性(图1,2,见彩图页Ⅳ)。提示培养的细胞是神经干细胞,可用于后续实验。
2.2 中风膏对OGD/R损伤后海马神经干细胞增殖的影响
通过CCK8 法检测神经干细胞增殖结果显示,正常组细胞在培养1~7 d内增殖明显,模型组细胞在造模后各个时间点增殖能力均明显下降,在细胞造模后加入中风膏含药血清培养细胞,实验发现在3 d 20%浓度中风膏含药血清培养条件下,细胞的增殖能力较模型组增强。而在5 d、7 d两个时间点含药血清组增殖能力均较模型组明显上升且呈现剂量依赖趋势,证明含药血清对干细胞OGD/R损伤后的增殖能力有显著的修复作用(图3)。
2.3 中风膏对 OGD/R损伤后海马神经干细胞细胞凋亡的影响
据2.2实验结果选取药物作用效果最为明显的7 d时间点和20%含药血清组进行细胞凋亡时间。实验结果显示,与正常组细胞相比模型组出现非常明显的晚期凋亡,证明OGD/R对干细胞造成严重损伤。而20%中风膏含药血清培养组凋亡相比模型组有显著下降(P<0.01),结果证明20%中风膏含药血清对干细胞损伤有治疗作用,可降低细胞凋亡(图4)。
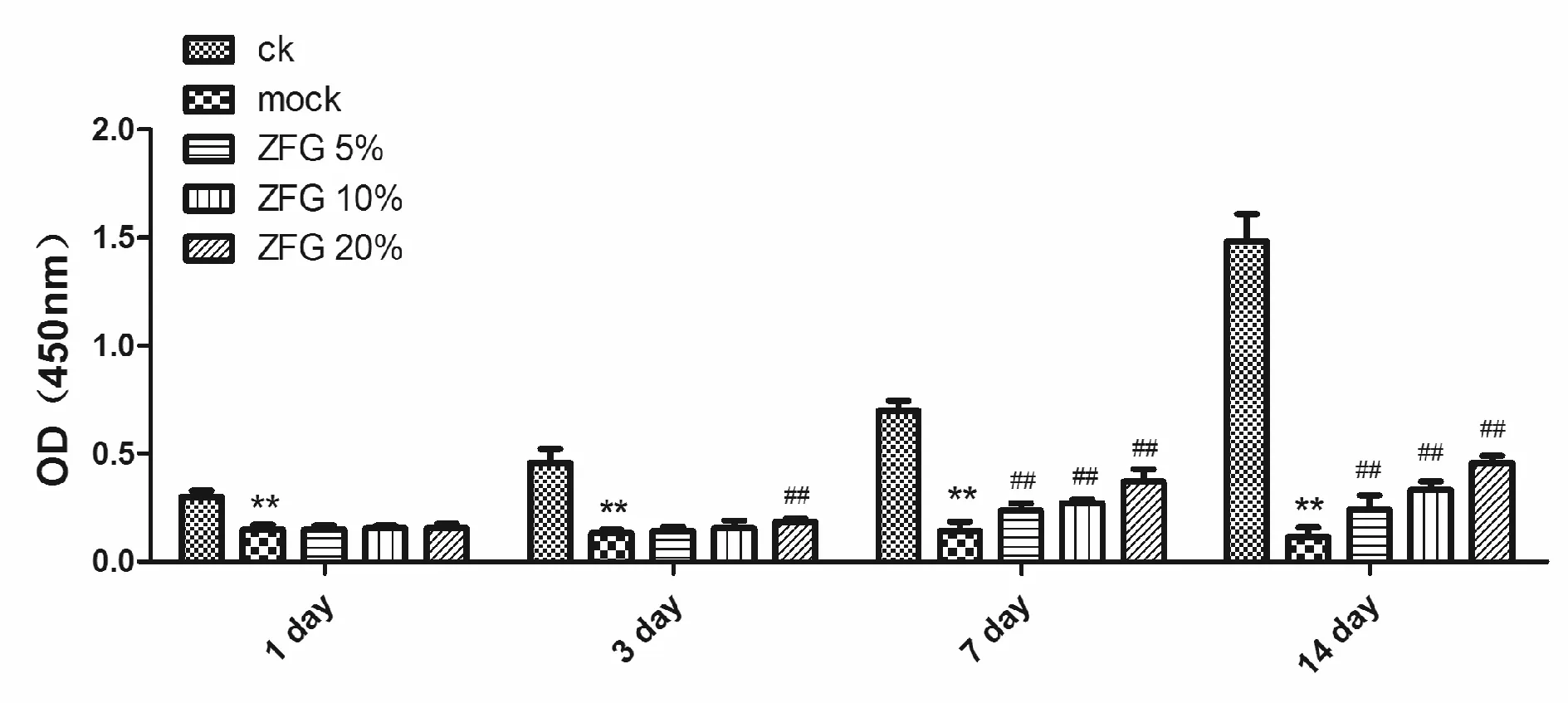
Fig.3The proliferation of NSCs cells after OGD/R treatmenttested by CCK8 experiment(n=6)
ck: Normal group; mock: Model group; ZFG 5%: 5% ZhongFengGao containing serum; ZFG 10%: 10% ZhongFengGao containing serum; ZFG 20%: 20% ZhongFengGao containing serum
**P<0.01vsck;##P<0.01vsmock

Fig.4The apoptosis rate of NSCs cells after OGD/R treatment(n=3)
A: Normal group; B: Model group; C: 20% ZhongFengGao containing serum; D: Statistical analysis of apoptosis experiment
**P<0.01vsmock
3 讨论
中枢神经系统损伤后的修复与再生一直是神经科学领域研究的热点,中药为重要手段的中医药疗法为脑缺血后神经再生的研究提供了新的思路[10]。缺血性脑卒中主要病机为气虚血瘀,“益气活血法”为中医治疗缺血性脑卒中的基本方法,有着明确的不可替代的作用,其有效性和安全性已经得到临床验证[11]。体现“益气活血法”的“中风膏”为甘肃省中医院院内制剂,以古方“佛手散”(当归、川芎)为基础,重用岷当归(达药典规定的6倍),配伍黄芪、丹参、赤芍、羌活、甘草等药物,具有较强的益气活血,化瘀通络的功效,为“益气活血法”的代表方药之一,中风膏能够有效降低血黏度、抑制颈动脉粥样斑块、抑制血小板聚集、减轻钙超载、抑制神经细胞凋亡等,具有明确的神经保护和改善微循环作用,具有良好的临床疗效[12-15]。“益气活血法”及其代表中药复方通过大量的实验研究,能通过促进 NSCs增殖与分化,进而有利于损伤的神经细胞再生,有利于脑缺血后神经功能的恢复[16, 17]。黄芪为补气药,三七为活血药,配伍符合中医治疗缺血性脑卒中的益气活血的治疗法则,两者单独应用均可促进NSCs 增殖,张建平等研究提示,黄芪皂苷(50 μg/ml)和三七总皂苷(15 μg/ml)配伍可明显逆转 OGD-R 所致海马 NSCs 的LDH漏出率增高、存活率降低及核萎缩或凋亡发生[18]。
神经干细胞除具有自我更新和多向分化的潜能外,还具有以下几个方面的特征[19]:(1)对损伤部位具有反应能力:通过产生新生的神经细胞而修复受损神经组织;(2)具有迁移作用和良好的组织相容性:当神经发生损伤后,神经干细胞从脑室向神经损伤区域方向迁移,达到神经修复的目的。海马是脑内对缺氧最为敏感的部位,是执行学习、记忆等高级功能的脑区,也是NSCs的主要分布脑区之一,在体外培养的海马 NSCs较适用于缺血性脑损伤模型的建立及其相关研究[20]。悬浮培养和贴壁培养是神经干细胞常用的两种培养方法,本研究采用无血清悬浮培养海马神经干细胞,结果显示:细胞呈悬浮状态,3 d后克隆球开始形成,说明神经干细胞的增殖特性。部分神经球出现融合及贴壁分化现象,细胞呈典型 NSCs 形态。Nestin是一种属于第Ⅵ类中间丝类型的蛋白,仅在胚胎早期神经上皮表达,当神经前体细胞向终末方向分化为神经元和胶质细胞时,Nestin 便停止表达,可以作为神经干细胞的标记蛋白,常常应用于神经干细胞的分离、鉴定和培养[21]。本实验经巢蛋白染色鉴定,大部分为阳性细胞,说明培养的细胞为海马神经干细胞,可以进行后续实验的研究。
EGF已经被证实是促进NSCs增殖最为重要的影响因子[22],可以维持干细胞的长期存活生长,促进 NSCs 进行对称性分裂,其产生的子代细胞均可继续分裂。而B-27、bFGF 则起到维持细胞悬浮、抑制神经干细胞分化的作用[23]。本实验所用的神经干细胞培养基由B-27、bFGF、EGF等组成,可以维持干细胞的增殖,当细胞聚集增多,不断增殖、变大,干细胞球的体积也随之增长,使干细胞神经球内层的细胞与培养基接触的表面积变小,营养物质交换变少,细胞逐渐出现凋亡,这与文献报道一致[24]。有研究提示:高体积分数血清能够促进神经干细胞向星形胶质细胞分化,而低体积分数血清有利于神经干细胞向神经元分化[25],本实验研究提示含药血清会影响神经干细胞的分化,具体如何避免中药含药血清影响干细胞的贴壁及分化,并诱导其向神经元定向分化有待于课题组进一步的实验探索。
本实验CCK8实验结果表明,中风膏含药血清对 OGD/R损伤后的大鼠海马NSCs增殖能力有显著的修复作用,说明体现“益气活血法”的中风膏可以促进海马神经干细胞增殖,实验为将来中医药促进神经干细胞增殖,促进神经再生,治疗缺血性脑卒中提供实验依据,但其促增殖的确切机制有待进一步研究。细胞死亡是脑缺血/再灌注损伤的最严重形式,脑缺血/再灌注后的凋亡机制参与细胞死亡。因此,寻求有效措施减少细胞凋亡已成为降低缺血/再灌注脑组织损伤的靶点之一[26]。本研究显示,20%中风膏含药血清对干细胞损伤有治疗作用,可降低细胞凋亡,这可能是中风膏对神经干细胞损伤治疗的作用机制之一。培养体系或反应体系中的含药血清浓度愈高,则药量愈大,所取含药血清的体外药理效应就越强[27],本实验为该推论提供确切的实验依据。中药血清药理学研究为中药复方的时效、量效关系规律的探索提供新的思路和方法,对于建立和完善中医药“病-证-方-量-时-效”理论体系和推动中医药事业的快速发展具有重要意义[28]。此外,关于中风膏究竟是如何激活内源性神经干细胞,促进其增殖与定向分化,抑制凋亡,揭示其神经保护通路和神经功能重建调节机制,我们仍需进一步研究。
