急性低氧暴露与低氧运动习服的血液学评价指标*
2018-03-13周文婷
周文婷, 胡 扬, 徐 飞
(1. 遵义师范学院体育学院, 贵州 遵义 563000; 2. 北京体育大学, 北京 100084; 3. 杭州师范大学, 杭州 310036)
随着进出高原人数日渐增多,急性高山病(acute mountain sickness, AMS)成为高发疾病。高原缺氧是AMS的根本诱因[1],低氧环境下运动会导致运动能力、耐受力下降和多种不适反应出现,加重AMS症状[2],而短期适当剂量的低氧暴露结合训练可加快高原习服的进程,显著降低急进高原时AMS的发生率及严重程度[3]。
通过多次试验,本试验室先后利用模拟低氧环境建立AMS模型,对世居平原北方汉族男性施以3周渐进式低氧训练,观察AMS低氧习服效果,测试低氧暴露及3周低氧训练阶段的血液学指标(血清血管紧张素转化酶(angiotensin converting enzyme, ACE)、血管紧张素II(anglotensinogen II, AngII)[3]、抗利尿激素(antidiuretic hormone, ADH)和醛固酮(aldosterone, ALD)[4])和心肺功能指标(心率、动态血压、SpO2等)[5]的变化,并筛选与低氧暴露和低氧运动习服效果相关的遗传位点。结果发现,血清ACE 活性和AngⅡ水平不是AMS的敏感指标[3]。内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)基因的4a/4b位点是AMS发生及低氧运动习服的预测分子标记[6],HIF-1基因的G-217A位点和AGT基因的G-217A位点与低氧习服相关[4,5],其他基因位点则与AMS发生及低氧运动习服无关[3,6,7]。一氧化氮(NO)、内皮素-1(endothelin-1, ET-1)及心纳素(atrial natriuretic peptide, ANP)是一组舒、缩血管的血管活性物质,对低氧敏感,低氧下它们的合成与分泌异常会引发的缺氧性肺动脉高压(hypoxia pulmonary hypertension, HPH),是除肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)和ADH外另一AMS的潜在病理生理基础[2,8],故本文也测试AMS发生和低氧习服中血清ANP、ET-1及eNOS的水平,以探索上述血液学指标作为AMS发生及低氧运动习服效果敏感指标的可行性,从而为急性高原反应的诊断及低氧习服效果的评价提供血液学指标。
1 材料与方法
1.1 试验对象
61名健康男性大学生(20.6±1.4岁)参与Phase 1研究,后13人因个人原因在低氧训练期间流失,故Phase 2研究对象48人(20.8±1.4岁)。受试者无神经系统、心肺、心血管系统疾病及吸烟史;均为北方汉族世居平原者(海拔<800 m)。试验前6个月未经高原和/或低氧暴露(海拔≥1 500 m)。试验前签署知情同意书,并熟悉测试仪器和试验流程。
1.2 试验流程
Phase 1:受试者于常压低氧舱(模拟海拔4 800 m,温度20℃~24℃,相对湿度46%~67%)中暴露6 h:进舱后休息30 min,然后进行30 min的运动测试:在卧式功率车上仰卧休息5 min后,以恒定负荷(80 W, 60 rPm)蹬车20 min,恢复5 min。运动结束后继续静息暴露至6 h。以LLS量表评价AMS[9],运动前和运动后即刻、低氧暴露4 h和6 h结束时记录AMS评分,将6 h结束时AMS评分≥3且有头痛者定为AMS。Phase 2:恢复1周后,受试者进行3 周 (2 h/d, 4 d/周)间歇性低氧暴露辅以运动,在模拟海拔2 500 m、3 500 m和4 800 m 各1周。控制运动强度,使受试者在上述低氧环境下运动时的SpO2分别为90%~92%、<88%和<75%水平(以Nonin 3100 型血氧饱和度仪测试 SpO2,传感器统一夹在左手食指,等数据稳定后读数并记录),跑步、蹬车可选。恢复1周,重复Phase1,LLS量表评价AMS。
1.3 血液学指标测试
受试者分别于Phase1阶段的常氧安静(Normoxia I, NMI)、低氧暴露结束(Hypoxia I, HYI)、3周 低氧训练后重复Phase1的常氧安静(Normoxia II, NMII)和低氧暴露结束(Hypoxia II, HYII)时取8 ml静脉血,分装后分离血浆,-20℃保存。测试前样本复融,4℃ 3 000 r/min 离心5 min,取上清,RIA法测定血清ANP、ET-1及eNOS(北京华英生物技术研究所进口分装试剂)。
1.4 统计学处理
2 结果
2.1 急性低氧暴露对AMS与血液学指标的影响
6 h低氧暴露后,AMS与非AMS组的评分分别为4.3± 1.7和1.1±0.9,AMS发生率为49.2%,评分值介于0~10。AMS与非AMS组在HYI时的ANP及eNOS均下降非常显著,ET-1均轻微上升,两组间各指标变化量△1差异不显著(表1)。
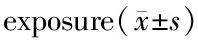

GroupnNMIHYI△1(HY-NM)ANP( pg/ml)AMS 30247.1±97.6165.4±36.0∗∗-81.3±98.8Non AMS 31255.5±95.9170.5±27.9∗∗-85.0±106.9ET-1( pg/ml)AMS30123.0±27.8128.5±29.95.5±34.2Non AMS31128.5±23.9131.5±28.53.0±37.8eNOS( μmol/L)AMS3066.5±14.958.2±11.5∗∗-8.3±14.7Non AMS3166.2±13.754.7±7.4∗∗-12.0±15.2
ANP: Atrial natriuretic peptide; ET-1: Endothelin-1; eNOS: Endothelial nitric oxide synthase; AMS: Acute mountain sickness; NMI: Normoxia Ⅰ; HYI: Hypoxia Ⅰ
**P<0.01vsNMI
2.2 3周低氧训练对AMS与血液学指标的影响
低氧训练后,受试者AMS评分为1.4±1.6,AMS发生率为18.7%,评分值区间为0-6,60.4%的受试者AMS评分下降,定为低氧习服组(AMS-A),其他为未习服组(AMS-NA)。
NMII时,AMS-A与AMS-NA组的ANP水平均比NMI时显著上升,组间的ANP变化量差异显著,而ET-1和eNOS水平下降不显著。与NMII时相比,两组HYII时的ANP水平均显著下降,且ANP变化量在第二次低氧暴露后与初次低氧暴露相比均显著下降,但组间差异不显著。HYII时两组的eNOS水平分别上升和下降,eNOS变化量均比初次低氧暴露时上升,在AMS-A组中差异非常显著,组间的差异也非常显著。两组的ET-1水平在各个时段均无显著性变化(表2)。
3 讨论
3.1 低氧暴露剂量及3周渐进式低氧训练方案的确定
本研究预期将AMS发生率控制在~50%,评分控制在~10,使设计达到均衡,较好地控制数据偏倚、统计效力及AMS症状的严重程度。最终以模拟海拔4 800 m暴露6 h的低氧剂量,辅以30 min的恒定负荷运动,成功构建适于AMS研究的急性低氧暴露模型,获得预期的AMS发生率及AMS严重程度,表明本研究的低氧暴露剂量合理。此外,以往研究发现阶梯习服及短期多次重复低氧暴露结合训练均可促进低氧习服[3,10],5 d的低氧预适应即可显著降低进驻4 300 m海拔高原新兵的AMS发生率,且可保持5 d[11],但阶梯习服若不施加运动,单纯依靠低氧刺激,习服时间往往较长;多次重复低氧暴露结合训练则由于模拟高度恒定,易出现暴露早期受试者身体不适或暴露后期低氧剂量不足,故推测结合两种方法更利于低氧习服。本研究采用3周渐进式低氧训练方案,通过SpO2水平控制运动强度,最终AMS发生率显著降至18.7%,AMS评分区间降为0-6,60.4%的受试者表现低氧习服,故可用于世居平原人的高原预适应及AMS的预适应和控制。

Tab. 2 The serum levels of ANP, ET-1 and eNOS in the AMS-A group and the AMS-NA group under the second acute hypoxic exposure after 3 weeks hypoxia
ANP: Atrial natriuretic peptide; ET-1: Endothelin-1; eNOS: Endothelial nitric oxide synthase; AMS: Acute mountain sickness; NMⅠ: Normoxia Ⅰ; NMⅡ: Normoxia Ⅱ; HYⅠ: Hypoxia Ⅰ; HYⅡ: Hypoxia Ⅱ
**P<0.01vsNMI;##P<0.01vsNMII
3.2 AMS发生与低氧习服中的血液学指标变化
急进高原人群中AMS的发生率约为30%~80%,其防治成为重要研究课题[7]。因AMS发病机制不明,其诊断和习服效果均采用LLS和ESQ等量表进行评价,当LLS评分≥3且出现头疼时即认为发生AMS,并由评分高低决定其严重程度,习服效果则根据习服后LLS和ESQ等量表评分的变化来表示。由于量表评价依赖个体主观感觉,存在主观性较强、某些个体难以准确认知相应症状的缺点,因此长期以来始终缺乏可靠指标用于AMS及其习服效果的预测与评价,故探索以血液学指标、生理学指标或功能型遗传标记来预测和评价AMS的发生及其习服效果对AMS的防治具有重大的现实意义、应用前景和价值[12]。NO、ET-1及ANP是一组对低氧敏感的血管活性物质[13-15],当低氧刺激血管内皮细胞时,ET-1与NO的合成分泌会分别增加和减少,加剧血管收缩造成HPH,而ANP作为低氧下机体的一种保护性代偿机制,在HPH出现时总表现为分泌增加,从而在尿钠排泄中发挥关键作用[16]。本研究中,受试者低氧暴露后的血清ET-1水平轻微上升,但eNOS和ANP水平下降均非常显著,表明二者水平的变化与低氧耐受能力及心肺功能的下降有关,故可将二者视为急性低氧暴露的敏感指标,而其他血液学指标RAAS与ADH在急性低氧暴露中的作用(即钠、水潴留在何种程度上影响AMS的发生)仍需进一步加以明确[2-4]。但因AMS与非AMS组间差异不显著,故并非AMS的预测和评价指标,推测可能与本研究的低氧剂量较低有关。海拔高度越高、暴露时间越长,AMS症状就越严重[2]。本研究中急性低氧暴露时间为6 h,虽然AMS发生率接近50%,但均较轻微,而多数发现ET-1、ANP或eNOS显著变化的研究,其研究对象的AMS症状都较严重,有些甚至确诊高原肺水肿[17],故AMS的血液学预测指标仍需进一步探索。
研究发现,比初次低氧暴露相比,3周低氧训练后受试者的ANP水平在再次低氧暴露前后均非常显著性升高,组间ANP变化量差异也非常显著,而ET-1和eNOS水平有改善,但变化不显著,表明3周低氧训练对机体的血液学指标有正面影响,且该影响可能与AMS低氧习服效果相关,但ANP的影响最显著,表现更好的舒血管能力和低氧适应能力。此外,受试者再次低氧暴露前后的血液学指标变化均比初次暴露时有改善,表明机体对低氧训练产生较好的应激,从而提高受试者的低氧适应能力,但这种改善主要体现在ANP和eNOS上,而eNOS水平变化量的差异则体现为AMS-A组与AMS-NA组的低氧习服差异,可作为习服效果的评价指标:即低氧训练后AMS-A组的eNOS提高幅度显著,故低氧习服效果更好,而AMS-NA组提高幅度不显著,低氧习服效果较差,与此前研究结果相一致[18,19]。
综上所述,血清ANP和eNOS水平是急性低氧暴露的敏感指标,ANP变化量与低氧运动习服效果有关。3周低氧训练后,AMS-A与AMS-NA组的eNOS水平在低氧暴露后变化趋势不同,造成两组低氧习服效果迥异,eNOS变化量可作为低氧习服效果的辅助评价指标。
