失效模式和影响分析在医院制剂复方硼砂溶液偏差事件中的应用
2018-03-13杨八十叶丽娟郑辉辉吴坤林林再兴陈锦珊
杨八十,叶丽娟,郑辉辉,吴坤林,林再兴,陈锦珊
(解放军第一七五医院、厦门大学附属东南医院制剂科,福建 漳州 363000)
失效模式和影响分析(FMEA)是质量风险管理的重要工具[1-3],即评估潜在的失败模式和因此对产品性能或结果产生的影响,一旦失败模式被确定,可应用风险降低来消除、减少或控制潜在的失败。复方硼砂溶液是解放军第一七五医院自制制剂之一,临床上用于治疗口腔炎、扁桃体炎、咽喉炎等疾病[4]。在2016年第一季度出现多批次的微生物限度结果超标偏差事件,提示其在生产管理中存在质量风险,为此,借助FMEA方法,探讨其用于分析和干预医院制剂配制过程中发生的偏差事件的可行性,现将结果报道如下。
1 成立评估小组
成立复方硼砂溶液偏差事件评估小组,成员包括质量管理2人、物料管理组1人、生产部门4人、药检室1人,共8名。评估通过小组讨论分析、生产偏差调查、现场考察等形式进行。
2 实施风险评估
2.1 风险识别 复方硼砂溶液处方来源于《中国人民解放军医疗机构制剂规范》[5],药物主要由硼砂、碳酸氢钠、甘油、液化苯酚组成,配制工艺流程见图1,本系统从配制到分装阶段所用的配液罐、滤球、药剂自动灌装机等设备器具,同时用于生产碘伏及复方苯酚溶液两种制剂。成品微生物限度检查方法及标准以《中国药典》[6]为依据。
2.2 风险分析 采用简易的风险管理工具——因果图分析法[7],从“人员、设备、物料、方法、环境”5个方面进行风险分析,具体见表1。
2.3 风险评分[8-10]
2.3.1 评分标准 采用ICH Q9推荐的方法学FMEA进行风险评估和管理,风险RPN值=风险发生的可能性O×严重性S×可检测性D,评分标准如表2和表3所示。
2.3.2 风险因素FMEA评分 根据以上评分标准,对风险因素进行打分,如表4所示。
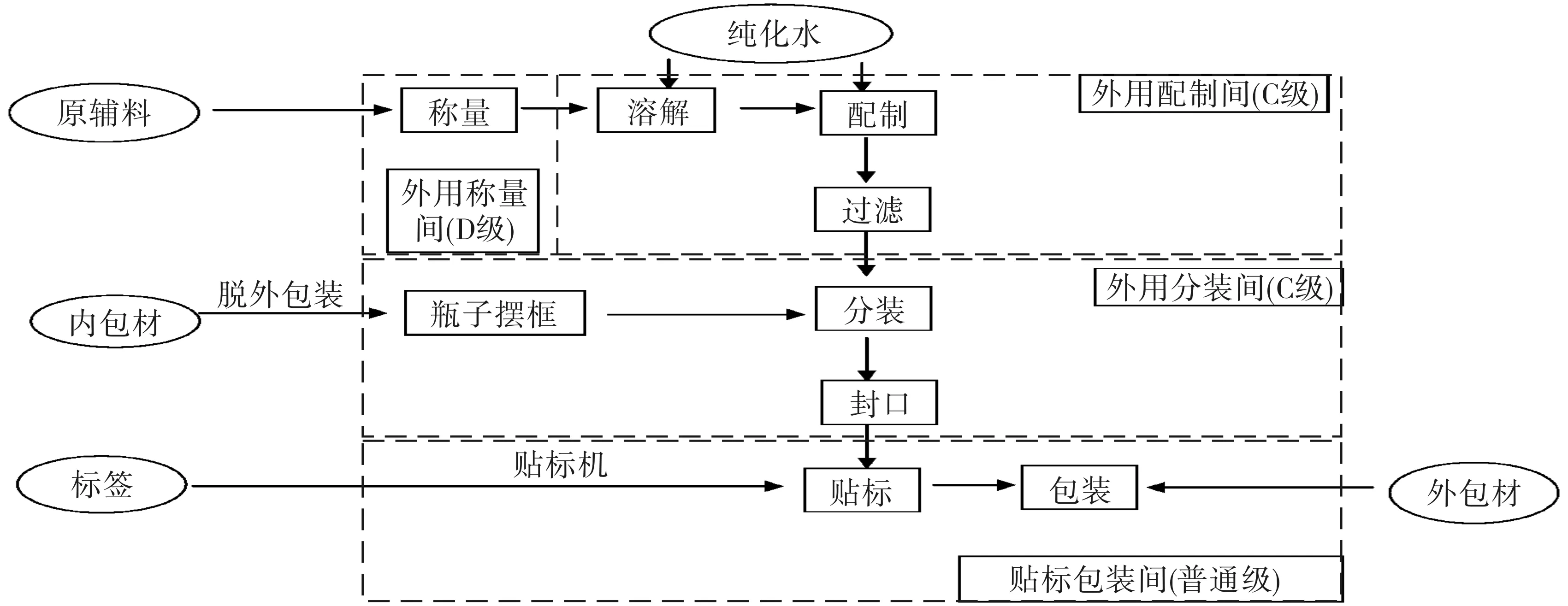

图1 复方硼砂溶液配制工艺流程图 表1 因果图法风险分析列表
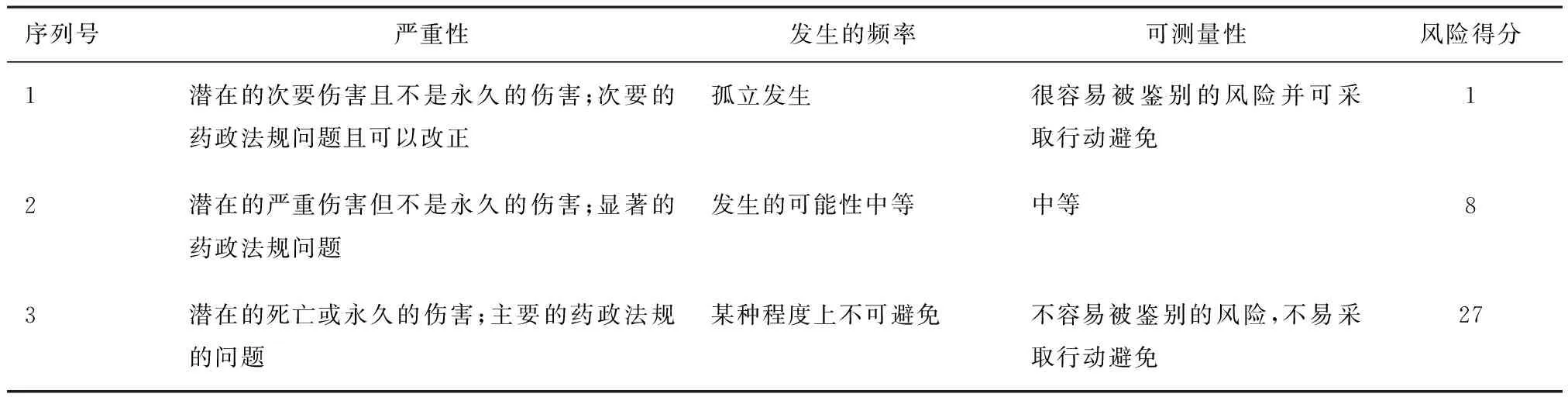
表2 FMEA评分标准——失效模式和影响分析评分

表3 FMEA评分标准——失效模式和影响分析矩阵
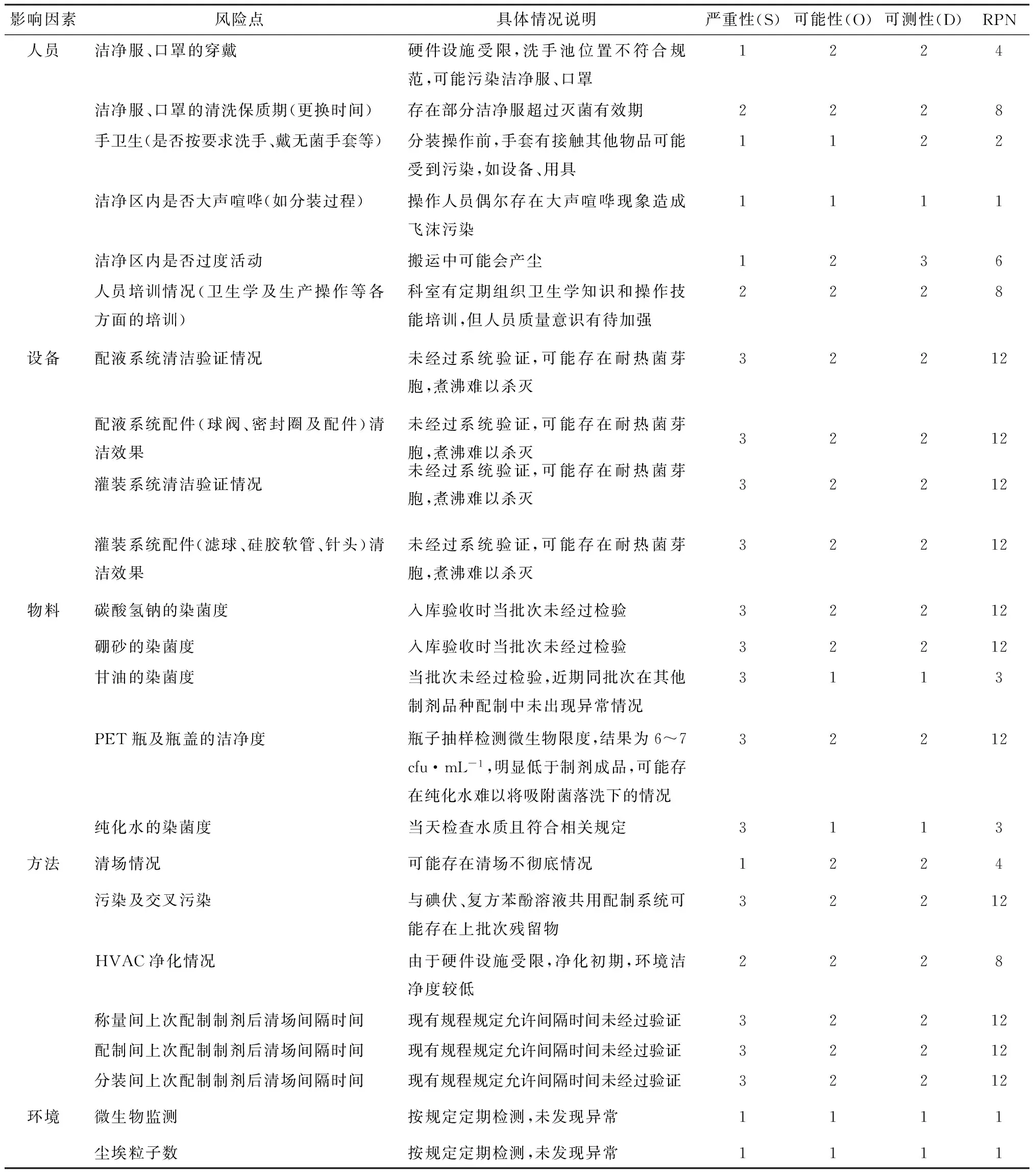
表4 FMEA评分结果/分
2.3.3 关键影响因素的确定 由表4可知,其中人员执行操作规程力度、灌装系统的消毒清洁验证、物料包材的染菌度及各个工序清场间隔时间的确定是复方硼砂溶液微生物限度超标偏差事件的关键因素,关键影响因素应是风险控制的关键要素。
3 风险降低措施
3.1 物料管理组 (1)针对制剂聚酯瓶(PET)的包装缺陷问题,向供应商提出改进建议,以降低包装破损的发生率;(2)严格落实入库验收制度,对每一批次包材、原料均加强验收并进行质量抽验;(3)规范库房保管,监控并准确记录库房的温湿度,雨季时加强除湿措施;(4)物料发放时落实核对及外包装检查,发现可疑质量问题不得发出,对于退回库房的物料同样落实质量检查。
3.2 生产部门 (1)加强人员培训,强化药品生产和质量管理(GMP)法规意识、质量意识和责任意识;(2)及时完善配制灌装系统清洁、消毒标准操作规程,并按照规范要求开展验证;(3)请领洁净服时应加强核对,确保洁净服在灭菌有效期内;(4)加强物料领取环节的质量把关,对于存在可疑质量问题的物料予以拒绝领用;(5)合理安排生产操作人数,减少由于人为因素带来的污染;(6)严格按照标准操作规程进行操作,不得擅自调整配制工艺,对于确需变更配制工艺的应按规定程序申请变更。
4 小结
针对偏差事件,我们运用质量风险管理工具——FMEA,从“人员、设备、物料、方法、环境”五个方面系统分析出现偏差的可能因素,并采取相应措施,截止2016年12月未再出现类似偏差事件,偏差得到有效控制,制剂质量得到了保证,表明FMEA方法适用于分析和干预制剂配制过程中发生的偏差事件。
FMEA应用于复方硼砂溶液微生物限度超标偏差事件可以识别并消除风险,需要注意的是,成功地进行FMEA分析,需要评估小组人员对产品和流程有着深入的了解并且能客观、公正评价与自己有关的缺陷,这样得出的结果才具有科学性及指导意义;FMEA是一项长期的、细致的、系统的工作,此次的风险评估虽完成了,但风险管理远没有结束,后续我们将持续性考察该风险评估的适用性和有效性,对风险评分以及风险降低措施的实施效果等做回顾性分析,以使风险管理得到持续改进,确保制剂质量安全、有效。
[1] 邢永恒.药品GMP教程[M].北京:化学工业出版社,2015:209-211.
[2] 王翔,杨悦.浅谈制药企业验证活动中风险评估的应用研究[J].中国药物评价,2013,30(4):238-242.
[3] 焦明丽,吴群红,徐鹏,等.失效模式与原因分析从理论到实践[J].中国卫生经济学,2012,31(12):33-34.
[4] 刘全芳,郑绍忠,张婷.复方硼砂溶液(稀)微生物限度检查法验证[J].安徽医药,2011,15(8):963-964.
[5] 中国人民解放军总后勤部卫生部.中国人民解放军医疗机构制剂规范 [M].北京:人民军医出版社,2003:284.
[6] 国家药典委员会.中国药典(四部)[S].北京:中国医药科技出版社,2015:140.
[7] 陈宾,范锋,杨悦.中药栓剂生产过程中的风险管理[J].中国药物评价,2014,31(6):356-361.
[8] 孟铮,黄文锋.失效模式和影响分析在原料药工艺验证中的应用[J].中国现代应用药学,2015,32(2):224-231.
[9] 姜琳,孟春玲.浅谈风险管理在GMP验证工作中的应用[J].首都医药,2014,21(6):18-20.
[10] 黄雪,梁毅.风险管理在药品生产工艺验证中的应用[J].机电信息,2016(11):10-13.
