不同剂量的重组人血管内皮抑素腹腔给药对腹水瘤小鼠的疗效观察
2018-03-13韦婕陈建胡冰季楚舒
韦婕,陈建,胡冰,季楚舒
(安徽省立医院肿瘤科,安徽 合肥 230001)
恶性腹水为晚期恶性肿瘤的常见并发症。引发恶性腹水的原发病以卵巢癌最常见,其他可见于胃肠道肿瘤、胰腺癌、子宫癌。大部分患者中位生存期为数周至数月。众所周知,新生血管的生成及血管通透性的增加与恶性腹水的发生发展息息相关,因此抗血管靶向治疗应运而生。重组人血管内皮抑素(恩度)具有多靶点抗血管生成作用。现有的基础研究及临床研究均显示恩度在恶性腹水治疗中具有较好的疗效及安全性[1-4]。但目前恩度给药剂量、频率以及给药方式的标准不一,为临床参考带来了一定的困难。本研究从剂量标准出发,通过不同剂量恩度给药,比较各组间腹水疗效的差异,现报道如下。
1 材料和方法
1.1 材料 ICR小鼠160只购于北京维通利华实验动物技术有限公司,体质量16~18 g,雄性,饲养于SPF级环境中,动物资格许可证号:SCXK(京)2012-0001。小鼠艾氏腹水癌细胞(EAC细胞)由勇山生物科技公司培育。重组人血管内皮抑素(恩度)由先声药物有限公司提供(批号201603013),用生理盐水配置成所需剂量,现用现配。
1.2 建立小鼠腹水瘤模型 复苏并扩增EAC细胞,用不含血清的1640培养基调整细胞浓度为每毫升5×107个,取0.1 mL细胞悬液接种于小鼠腹腔内传代。待小鼠出现腹水后(接种第7~9天)断颈处死小鼠,无菌条件下抽取腹水,放入离心管中,1 000 r·min-1离心5 min,弃上清,加入生理盐水吹洗,再离心,共2次。再用生理盐水稀释肿瘤细胞悬液每毫升2.0×107个细胞。取该悬液每只0.1 mL(相当于每只细胞数2.0×106个)接种于160只小鼠腹腔。
1.3 实验分组与给药 接种EAC细胞次日(第1天)将160只小鼠依体质量随机分成5组,每组32只,每组随机解剖12只小鼠,用注射器采集腹水,6只检测腹膜通透性,6只取腹膜组织备用。余小鼠按组依次腹腔给予相同体积的生理盐水(Control组),12.5、25、50、100 mg·kg-1恩度,于第1、3、5天分别给药1次。第7天每组随机解剖13只小鼠,采集腹水,7只检测腹膜通透性,6只取腹膜组织备用。每组剩余7只小鼠观察生存期。
1.4 观察指标和检测方法 (1)体质量:从第1天起隔日测量每只小鼠的体质量,绘制体质量变化曲线;(2) 腹围:从第1天起隔日测量每只小鼠的腹围,绘制腹围变化曲线;(3)腹水性状:第7天采集腹水,记录各组腹水颜色;(4)腹膜通透性:从小鼠尾静脉注射0.2 mL 5%伊文思蓝(5%Evan蓝),2 h后处死小鼠,收集腹水,将腹水离心5 min后取上清用酶标仪检测540 nm波长处Evan蓝的吸光度(OD540),间接反映Evan蓝的浓度,从而分析腹膜通透性;(5)生存期:记录各组剩余7只小鼠的存活时间,绘制生存曲线。

2 结果
2.1 对体质量变化的影响 各组小鼠体质量测量结果及变化曲线分别见表1和图1。第1天给药前各组小鼠体质量差异不明显。第9天各组小鼠的体质量均较第1天增加,各恩度治疗组体质量均轻于Control组,剂量分组对体质量影响明显(F=3.220,P=0.027),其中仅100 mg·kg-1恩度组与Control组之间差异有统计学意义(P=0.008)。
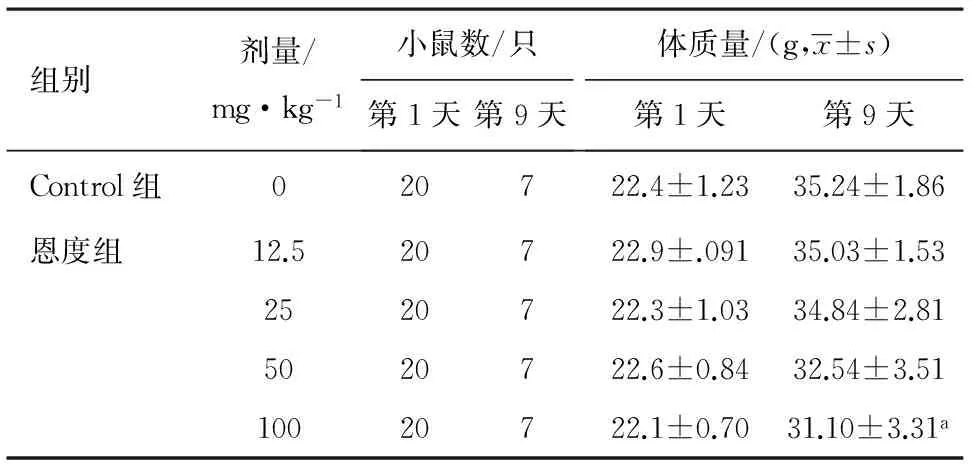
表1 各组小鼠体质量
注:与Control组比较,aP<0.05。
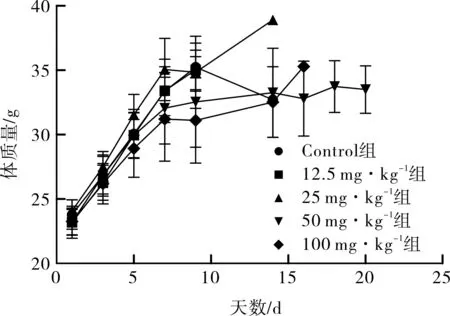
图1 各组小鼠体质量变化曲线
2.2 对腹围变化的影响 各组小鼠腹围测量结果及变化曲线分别见表2和图2。第1天给药前各组小鼠腹围差异不明显。第9天各组小鼠的腹围均较第1天增加,恩度剂量分组对腹围影响明显(F=6.791,P=0.001),其中50、100 mg·kg-1组腹围均小于Control组,50 mg·kg-1恩度组与Control组的差异(P=0.011)、100 mg·kg-1恩度组与Control组的差异均有统计学意义(P=0.010),但50 mg·kg-1与100 mg·kg-1组间差异无统计学意义(P>0.05)。
2.3 采集腹水情况 第7天处死小鼠,无菌注射器采集腹水。经5%Evan蓝处理后的腹水外观均呈蓝色。排除个体差异情况下,整体观察,与Control组相比,随着恩度剂量增加,腹水血性成分整体呈减少趋势。且100 mg·kg-1恩度组的腹水量整体较少,部分小鼠未采集到明显腹水。
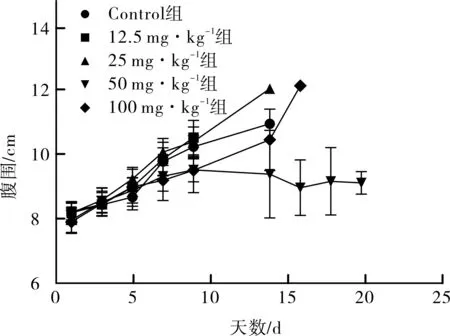
图2 各组小鼠腹围变化曲线
2.4 对腹膜通透性的影响 第1、7天各组腹水OD540值见表3和图3。第1天由于小鼠腹水尚未生长,故予腹腔注射4 mL无菌生理盐水后行5%Evan蓝检测吸光度,各组OD540均为0.4左右,各组之间差异不明显。第7天各组OD540均较第1天增大,且各恩度组OD540均小于Control组,但恩度剂量分组对OD540影响不明显(F=0.773,P>0.05),各组间均差异无统计学意义(P>0.05)。
2.5 对生存情况的影响 各组小鼠生存情况及生存曲线分别见表4和图4。中位生存时间最长的为50 mg·kg-1剂量组,且该组的生存曲线较其他组下降相对平缓。至第22天其余组小鼠均死亡,50 mg·kg-1组仍有2只小鼠生活状态良好,实施安乐死,解剖腹腔未见明显腹水。但与Control组相比,各恩度剂量组小鼠生存期差异无统计学意义(P>0.05)。
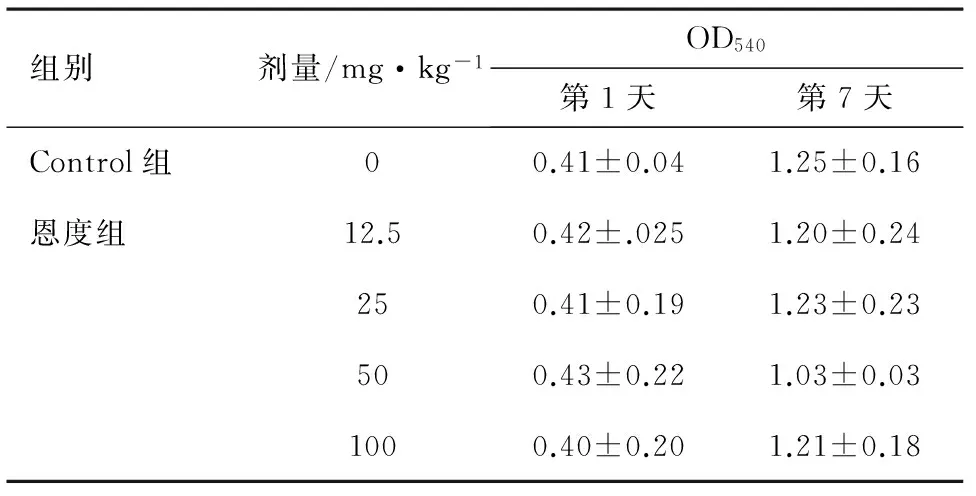
表3 各组小鼠腹水OD540值比较
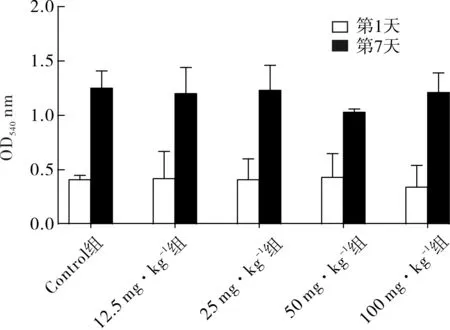
图3 各组小鼠第1天和第7天腹水OD540值

表2 各组小鼠腹围变化的比较
注:与Control组比较,aP<0.05。
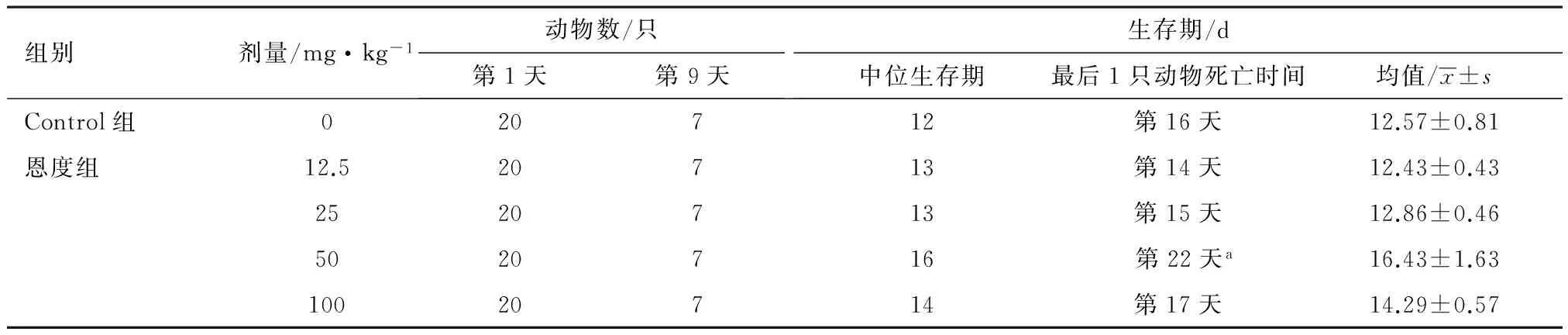
表4 各组小鼠生存情况
注:a:于第22天将2只尚存活的小鼠用CO2人为安乐死,第22天为删失数据。
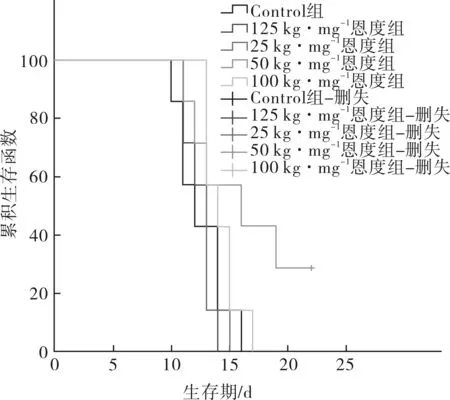
图4 各组小鼠生存曲线
3 讨论
恶性腹水往往预示着癌症晚期,大量腹水可导致患者腹式呼吸受限、食欲减少,睡眠质量下降,肠梗阻发生率升高,低蛋白血症及继发性贫血,加重或诱发恶液质的发生,患者往往一般状况差,预后不佳,中位生存期短,因此恶性腹水的治疗在提高晚期癌症患者的生活质量,延长其生存期具有重要意义[5]。目前临床常用的处理方式主要有限制液体入量,改善低蛋白血症,常规应用利尿剂,腹腔置管引流,腹腔热灌注化疗,免疫治疗及腹腔静脉分流术等[6-7],但疗效均不理想,且反复抽液、腹腔化疗易刺激腹膜、加重蛋白丢失、诱发肠粘连、肠梗阻等。
随着对腹水形成机制的探究,Tamsma等[8]提出腹水的产生主要与两条途径相关,淋巴吸收的减少以及腹膜腔内液体产生的增多。当肿瘤细胞侵犯或转移至腹膜时,肿瘤细胞会分泌多种生物活性肽,后者可促进新生血管的生成,致毛细血管内膜的总面积增加及血管通透性的升高,蛋白质渗出致腹腔内胶体渗透压升高,最终导致了腹腔内大量液体的产生。这些生物活性肽主要是血管内皮生长因子(VEGF)和碱性成纤维生长因子[9]。目前已有多项研究显示了VEGF在血管通透性、血管生成方面的重要作用[10]。O′Reilly等[11]发现的内皮抑素可通过与血管内皮的VEGF受体特异性结合阻碍血管内皮增生。恩度是我国研发的新型重组人血管内皮抑素,可直接抑制血管内皮细胞的增殖、迁移及分化,并促进内皮细胞的凋亡,多靶点抗肿瘤血管的生成[12]。目前已有多项临床研究表明,恩度联合化疗腹腔给药具有较好的近期疗效,可改善晚期肿瘤患者的生存质量,不增加化疗的毒性反应,为恶性腹水的治疗提供了新途径[13-15]。
我们在临床工作中发现一定范围下增加恩度给药剂量,患者腹胀症状及腹水消退的效果越来越明显,同时部分患者出现了胸闷、心慌等不适。药物剂量是影响疗效的一项关键因素,剂量过低可能无明显疗效,过高易加重药物的毒副反应。因此,我们设想恩度腹腔给药是否存在最佳剂量。但目前的报道尚无明确标准,已有文献中多为小样本的临床观察,联合化疗恩度剂量每次15~60 mg不等,动物实验剂量大多为8 mg·kg-1,缺乏高级别的循证医学证据。本实验将恩度稀释为4个剂量组(12.5、25、50、100 mg·kg-1),以生理盐水为对照实验,多方面对比疗效。
实验结果显示,高剂量组50、100 mg·kg-1在体质量、腹围指标上呈现阳性结果。临床上腹水明显时,最简单、直观的表现就是体质量增加、腹围增大,而腹围大小与腹水量息息相关,故该指标可间接反映药物抑制腹水生成的疗效。与Control组相比,100 mg·kg-1剂量组可明显降低小鼠体质量和腹围(P<0.05),显示出该剂量对腹水的抑制作用。而50 mg·kg-1剂量组相对Control组小鼠腹围明显减小(P<0.05),但体质量下降不明显,我们考虑可能与小鼠灵活好动,称重时并非完全静态,存在称重误差相关。
采集腹水时我们观察到在排除个体差异情况下,随着恩度的剂量加大,腹水血性成分减少,提示恩度对血性积液的产生具有很好的抑制作用,且同剂量相关。当肿瘤侵犯腹膜血管,腹膜通透性增高致大量红细胞渗出,即引起血性腹水。本实验结果与文献[16-17]研究验证的恩度对血性积液的疗效相符。对于100 mg·kg-1组个别小鼠未采集到腹水,以及生存期最长的50 mg·kg-1组中2只小鼠安乐死后解剖腹腔未见腹水生成的情况,我们认为除了模型接种失败的原因外还可能是该剂量下药物作用的结果,同时生存曲线中也显示出50 mg·kg-1剂量组的优势。
此外,我们发现在相同的实验背景下,文献[19-20]的实验中以恩度8 mg·kg-1给药即呈现出理想的阳性结果,反观本实验中相对高剂量给药体系仍出现的阴性结果,可能的解释有:(1)两位学者采用连续给药,疗程至少1周,而本课题隔天给药,疗程也相对较短;(2)文献[17]选用的是H22腹水瘤细胞,而本课题以艾氏腹水瘤细胞构建腹水模型,可能是不同的腹水瘤细胞对恩度疗效的反应不尽相同,值得深思的是提示临床中不同瘤种来源的腹水对血管内皮抑素的效果是否也存在差异,有待进一步探究。
综上所述,本实验设计体系下,恩度50 mg·kg-1剂量和100 mg·kg-1剂量相对其他剂量组对腹水抑制作用明显,可认定为内皮抑素腔内给药的有效剂量。前期动物实验显示恩度对腹水的抑制可能与降低腹水、腹膜组织中的血管内皮生长因子受体-2(VEGFR-2)的表达相关[18-19]。后续我们将对实验采集的腹水及腹膜组织进行VEGFR-2的检测,从分子水平了解差异。同时鉴于实验中各剂量组梯度较大,下一步可以围绕着50~100 mg·kg-1进一步细化剂量梯度,寻找给药剂量与腹水量、VEGFR-2表达水平的关系,试图了解腔内给药的最佳剂量。
[1] 吴书庆.恩度联合胸腹腔内化疗治疗恶性胸腹水的临床观察[J].中国肿瘤临床与康复,2013,20(1):56-58.
[2] 周文献.恩度灌注治疗恶性浆膜腔积液的研究进展[J].蛇志,2014(2):204-207.
[3] 谢海英.恩度联合铂类药物腔内灌注治疗恶性浆膜腔积液随机对照试验的meta分析[D].南宁:广西医科大学,2015:27-31.
[4] 杨惠萍,陈婷,应苗法.重组人血管内皮抑制素联合顺铂腔内注射治疗恶性胸腔积液疗效和安全性的Meta分析[J].肿瘤学杂志,2016,22(5):410-416.
[5] SAIF MW,SIDDIQUI IA,SOHAIL MA.Management of ascites due to gastrointestinal malignancy[J].Ann Saudi Med,2009,29(5):369-377.
[6] BECKER G,GALANDI D,BLUM HE.Malignant ascites:systematic review and guideline for treatment[J].Eur J Cancer,2006,42(5):589-597.
[7] SEIKE M,MAETANI I,SAKAI Y.Treatment of malignant ascites in patients with advanced cancer:peritoneovenous shunt versus paracentesis[J].J Gastroenterol Hepatol,2007,22(12):2161-2166.
[8] TAMSMA J,KEIZER H,MEINDERS A.Pathogenesis of malignant ascites:Starling′s law of capillary hemodynamics revisited[J].Annals of Oncology,2001,12(10):1353-1357.
[9] 姜贻乾,李朝阳,段光亮,等.重组人血管内皮抑素联合顺铂腹腔灌注治疗恶性腹水的临床观察[J].现代肿瘤医学,2012,20(2):339-341.
[10] 张海涛, 方申存, 张映铭.VEGF及Angiopoietin-2对恶性胸腔积液的诊断价值[J].现代肿瘤医学,2012, 20(9):1834-1836.
[11] O′REILLY MS,BOEHM T,SHING Y,et al.Endostatin:An endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88(2):277-285.
[12] 王浩杰,刘东华.内皮抑素在癌性胸水诊断及治疗中的研究进展[J].科技信息,2014(10):200-201.
[13] 朱海峰,李小琴.恩度联合顺铂治疗恶性胸腹腔积液的疗效[J].中国老年保健医学,2015,13(6):65-66.
[14] 关润芝.重组人血管内皮抑制素联合化疗药物治疗恶性胸腹水患者的疗效[J].中国医药指南,2016,14(20):133-134.
[15] 郭宝玲,陈志勇,郑秋香.不同剂量恩度联合顺铂胸腔灌注治疗非小细胞肺癌恶性胸腔积液的效果[J].齐鲁医学杂志,2016,31(2):148-151.
[16] 毛丽伟,廖国清,王红梅,等.恩度联合顺铂治疗恶性血性胸腔积液临床疗效观察[J].西南国防医药,2011,21(7):723-725.
[17] 魏红梅,秦叔逵,殷晓进,等.重组人血管内皮抑制素联合顺铂对小鼠腹水瘤抑制作用及其机制探讨[J].中华肿瘤防治杂志,2015,22(6):442-446.
[18] 吴春艳,王伟,陈鑫,等.重组人血管内皮抑素治疗小鼠恶性腹腔积液疗效及作用机制研究[J].中国临床药理学与治疗学,2014,19(5):507-511.
[19] 储赏奇,陈健,贾伟,等.血管内皮抑素抑制小鼠恶性腹水形成的实验研究[J].肝胆外科杂志,2015,23(6):463-466.
