N掺杂TiO2的改性制备及表征
2018-03-12,,,
, , ,
(1.福建工程学院材料科学与工程学院, 福建 福州 350118; 2.绿色节能环境材料福建省高校工程研究中心, 福建 福州 350118; 3.福建省室内环境工程技术研究中心, 福建 福州 350118)
TiO2作为一种半导体光催化材料,具有价廉易得、物化性质稳定、安全无毒、无二次污染等优点,因而受到研究人员的广泛关注。然而,因其带隙较宽(锐钛矿相TiO2的Eg=3.2 eV),光催化作用只能吸收利用波长小于387 nm的紫外光,对于太阳光能量的利用率低,这极大地限制了TiO2的实际应用[1];同时,TiO2还存在着光生电子-空穴对易复合,光生载流子利用效率不高等问题[2]。因此,开展TiO2的改性研究以提高其光催化效率,具有重要的科学与技术应用价值。
目前,对于N掺杂改性TiO2的研究主要集中于制备方法、可见光响应机理及在实际中的应用等方面。2001年Asahi等[3]首次以溅射法制备N-TiO2,研究表明,非金属元素N可以阴离子形式替代少量的晶格O,形成TiO2-xNx,使TiO2带隙变窄,在不牺牲紫外光活性的同时使其具有可见光催化活性,自此,掀起了一股以N等非金属元素掺杂改性TiO2的研究热潮。Chen等[4]利用常压等离子体纳米粒子合成工艺在不同的热处理气氛中制备N掺杂TiO2光催化剂;邓仕英等[5]先利用高温煅烧制备TiO2,再以水合肼为氮源,通过微波辐照对TiO2进行改性;M A Mohamed等[6]以溶胶凝胶法合成了N掺杂混相TiO2纳米棒组装的微球,但其需要经过后期高温煅烧处理。这些方法对合成所需的设备、反应条件要求较高,合成方法繁琐,成本较高,因此有必要研究更为绿色环保、经济廉价、简单实用的N掺杂TiO2改性方法。
本实验中,我们以尿素为氮源、钛酸四丁酯为前驱体,采用溶胶-凝胶法在较温和的反应条件下将非金属元素N引入TiO2晶格中,并应用多种表征手段,研究分析制备样品的晶相结构、表面基团及光吸收性能等,以此来制备N-TiO2光催化剂。
1 实验部分
1.1 主要试剂
钛酸四丁酯(分析纯,山东西亚试剂化学工业有限公司),尿素(分析纯,西陇化工股份有限公司),无水乙醇(分析纯,西陇化工股份有限公司),硝酸(分析纯,西陇化工股份有限公司)。
1.2 TiO2的改性制备
采用溶胶-凝胶法,在磁力搅拌的条件下,取8 mL钛酸四丁酯逐滴加入到10 mL无水乙醇中,搅拌30 min,得到淡黄色溶液A;称取一定量的尿素溶解于蒸馏水中,再滴加HNO3(尿素和钛酸四丁酯的摩尔比分别为2、3、4时,对应硝酸和蒸馏水的体积比分别为0.1、0.0875、0.75),搅拌均匀,得到溶液B;将溶液A缓慢滴加到高速搅拌的溶液B中,滴加完毕继续混合搅拌3.5 h;搅拌结束置于暗处陈化3 h,得到淡黄色水溶胶;将得到的淡黄色水溶胶置于100 ℃的烘箱恒温热处理11 h,令体系中的溶剂缓慢蒸发渐渐浓缩、均匀析出晶体(蒸发溶剂过程);将烘箱升温至170 ℃/200 ℃/230 ℃二度热处理2 h,继续放置至晶化完成从烘箱中取出,用研钵磨细得N掺杂TiO2样品,所得样品标记为X-Y-100-T TiO2,X为硝酸和蒸馏水的体积配比,Y为尿素和钛酸四丁酯的摩尔比(以下简称U-T摩尔比),T为二度热处理温度。
1.3 改性TiO2表征所用的主要仪器
X射线衍射仪(XRD,D8 Advance,德国Bruker公司),傅里叶变换红外光谱(FT-IR,Nicolet iS5,美国Thermo Fisher公司),紫外-可见漫反射光谱仪(UV-Vis DRS,Lambda 900,Perkin-Elmer公司),扫描电子显微镜(SEM,Nova NanoSEM 450,荷兰FEI公司),热重分析仪(TG,TG209-F3,德国NETZSCH公司)
2 结果与讨论
2.1 XRD表征
图1为不同制备条件下的样品XRD谱图,(a)(b)(c)分别表示在不同硝酸体积配比、二度热处理温度以及U-T摩尔比下条件制备的样品XRD谱图。通过与标准谱图JCPDS 21-1272和21-1276进行对比,图中的字母A和R分别代表TiO2锐钛矿相的(101)(004)(200)(220)晶面衍射峰和金红石相的(110)(200)(111)(211)(221)晶面衍射峰,表明样品为锐钛矿相和金红石相的混晶TiO2。样品XRD谱图中除TiO2的衍射峰外还有几个较为尖锐的杂峰,通过与标准谱图JCPDS 44-0951、49-1325和47-0867对比可知,在2θ=18 °、22.48 °、29 °和32.8 °位置的衍射峰分别属于TiO0.34N0.74、TiN0.6O0.4和NH4NO3,表明本实验虽然制备得到结晶度较高的N掺杂混晶TiO2,但由于未经过高温煅烧处理,晶体中仍存在少量杂质[7-8],同时也表明在制备过程中,尿素参与了钛酸四丁酯的水解反应,而不只是简单的物理混合。
由图1(a)可知,硝酸体积配比对样品的结晶度存在较为明显的影响,硝酸体积配比为0.075和0.087 5时,衍射峰强度微弱,当硝酸体积配比增大为0.1时,其衍射峰强度大幅增加,可明显观察到TiO2的衍射峰。这主要是因为在溶胶-凝胶法的反应过程中,溶液中的pH值会引起钛醇盐的水解和聚合行为的差异。
首先钛酸四丁酯与水接触后会迅速发生水解反应:
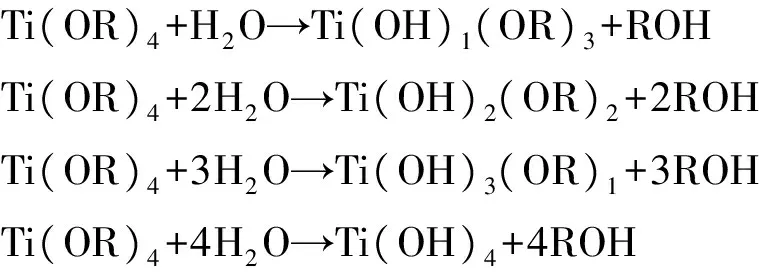
脱水聚合-Ti-OH+OH-Ti-→Ti-O-Ti+H2O
脱醇聚合-Ti-OR+HO-Ti-→Ti-O-Ti+ROH
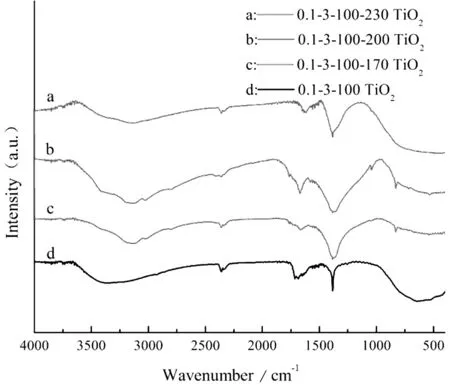
由图1(b)可知,只在100 ℃干燥的样品未出现TiO2的衍射峰(曲线d),经过二度热处理之后(曲线a、b、c),出现TiO2的特征衍射峰,且随着温度的升高,属于氮氧化钛和NH4NO3的峰衍射强度逐渐减弱,直至230 ℃消失,而TiO2的衍射峰则逐渐增强,形成以锐钛矿相为主的TiO2。这是由于在100 ℃温度下干燥仅是蒸发溶剂的过程,析出的产物此时处于“亚稳”状态,因此热处理温度与样品的晶型和结晶度具有重要的关系,经过二度热处理,NH4NO3受热挥发分解,TiO2逐渐晶化成型,晶核生长趋于完整。
由图1(c)可知,未添加尿素制备的TiO2同样为锐钛矿相和金红石相的混晶结构(曲线d),
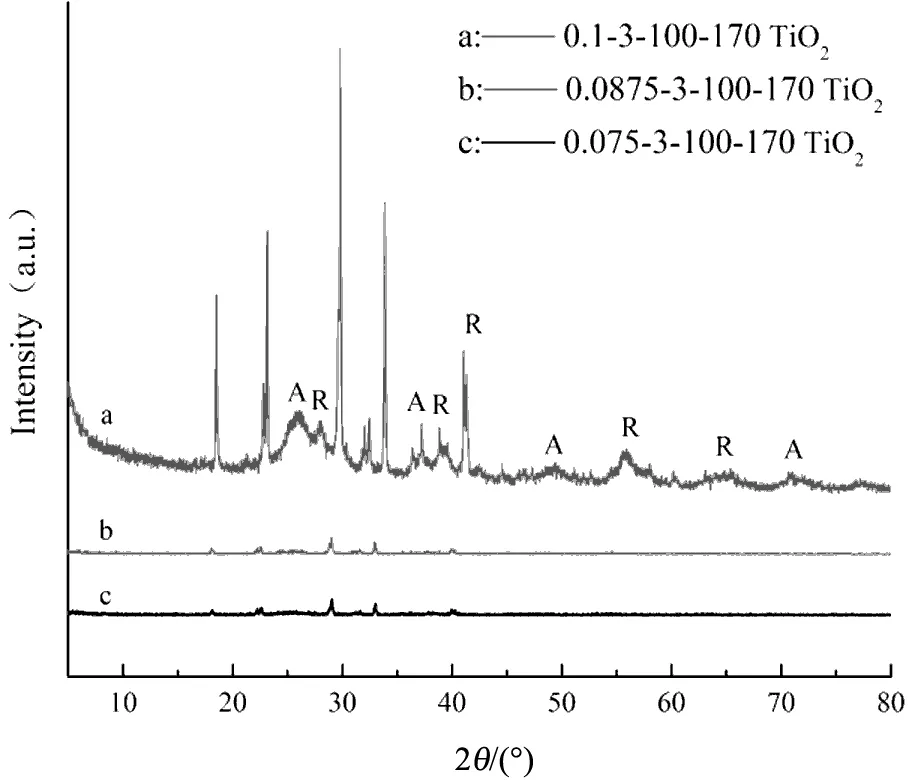
(a)不同硝酸体积配比
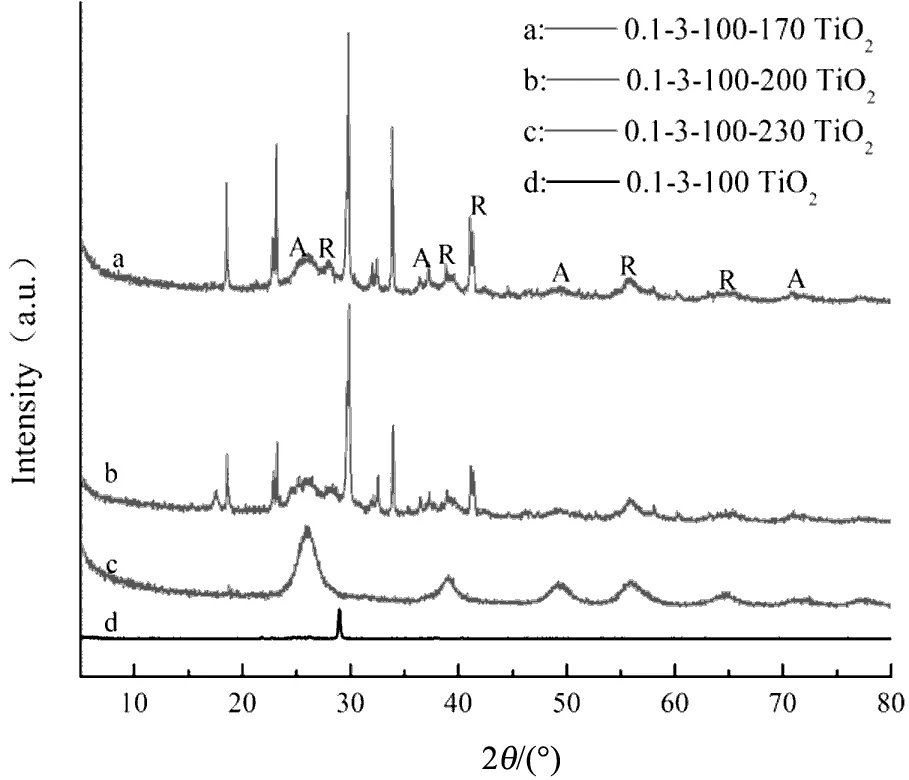
(b)不同二度热处理温度
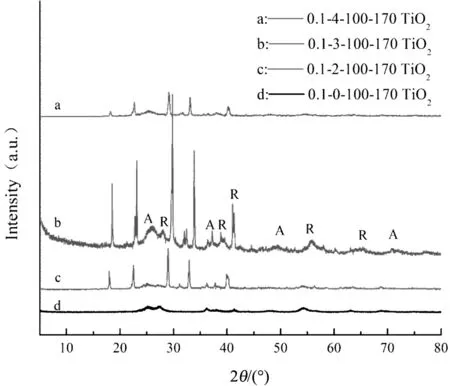
(c)不同U-T摩尔比图1 不同制备条件下的样品XRD谱图Fig.1 XRD spectra of samples prepared under different conditions
且不存在氮氧化钛等杂质;添加尿素之后,可在制备过程中将N元素引入TiO2晶格中,随着U-T摩尔比的增加,制备的样品峰强呈先增后减的趋势(曲线a、b、c),表明适当的尿素添加量有利于TiO2的结晶,可提高TiO2的结晶度,而过量的尿素反而会因为反应过程中发生的氮氧置换及晶格畸变造成结晶度的降低,延缓晶化过程。
2.2 FT-IR分析
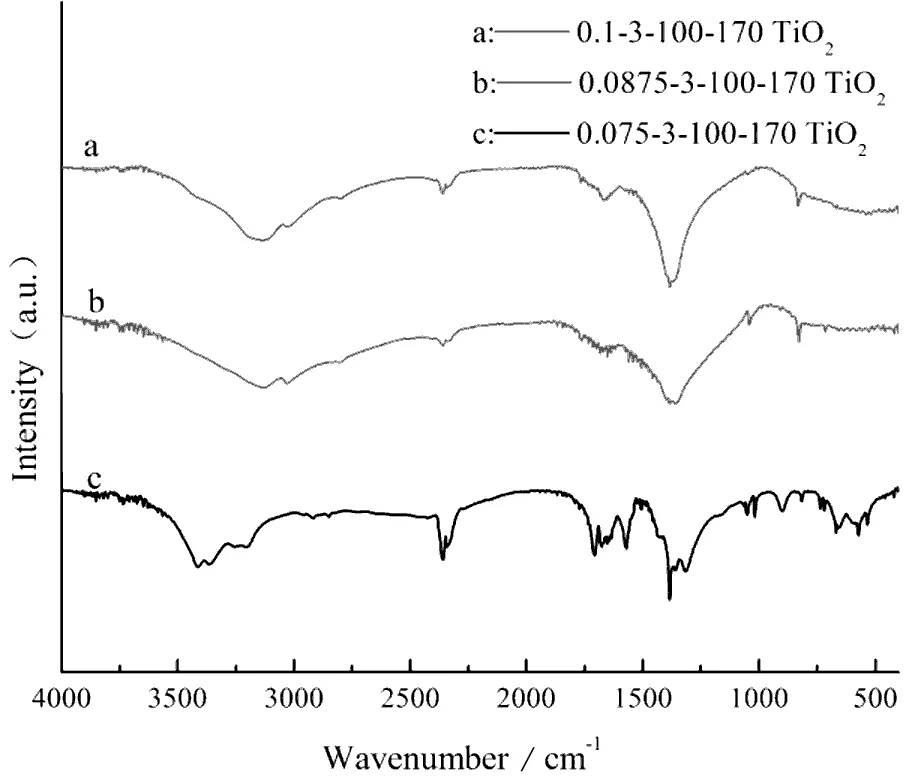
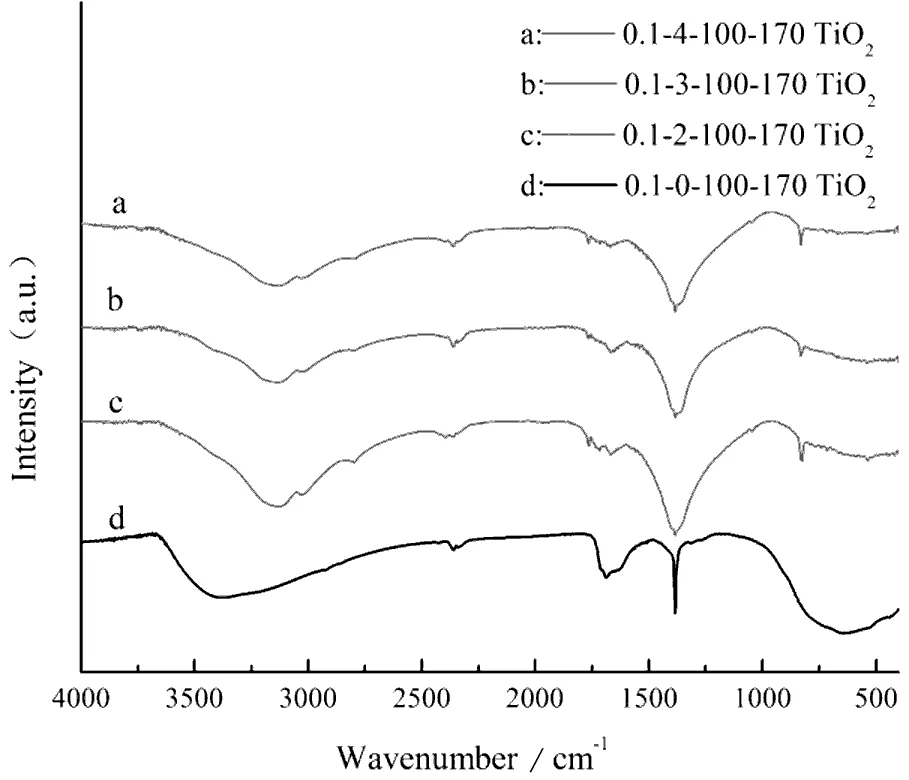
由图2(a)可知,随着硝酸体积配比的增加,400~750 cm-1归属于TiO2的吸收峰及3 350~3 450 cm-1的—OH吸收峰逐渐增强,其余的微弱杂峰则逐渐消失,结合XRD结果分析,硝酸体积配比会影响钛醇盐的水解和聚合行为,适当的硝酸体积配比可以促进水解产物以TiO2八面体方式排列,生成混晶型TiO2。而较低的硝酸体积配比则会造成水解产物的多样化,从而具有更多的杂峰,其中820 cm-1对应为—NH2的面外弯曲振动峰,1 033 cm-1是Ti-O-C的吸收峰,1 734 cm-1为C=O键的吸收振动峰,1 626 cm-1是C-N键的伸缩振动峰,这些键合结构表明尿素参与了钛酸四丁酯的水解过程,生成了铵盐等产物。
图2为不同条件下制备的样品傅里叶变换红外光谱图,图中3 350~3 450 cm-1的吸收峰是吸附水分子—OH的伸缩振动,1 650 cm-1左右处的吸收峰是O-H键的伸缩振动峰,这两处特征峰表明样品表面存在吸附水和羟基,在光的激发下,—OH可以捕获光生空穴(h+)生成具有强氧化能力的羟基自由基(·OH),而羟基自由基关系到光催化氧化的反应进程[11,12],二度热处理之后,随着热处理温度的升高,其特征峰强度先增强后减弱(图2(b)),这是因为温度过高会使吸附水脱附,同时会破坏表面羟基等基团的结构。其中400~750 cm-1附近的宽峰为Ti-O键或者Ti-O-Ti的弯曲振动特征峰,证明样品的主要成分为TiO2,伴随着热处理温度的升高,其峰强更为明显,表明TiO2的晶化程度提高。
由图2(c)分析得知,N掺杂之后样品的峰比未掺杂的样品多,其中400~750 cm-1属于TiO2的峰减弱,且在820 cm-1附近出现新的吸收峰,对应为—NH2的面外弯曲振动峰,在1 650 cm-1处的峰减弱,另有新的吸收峰在1 734 cm-1生成,对应为C=O键的吸收振动峰,3 050 cm-1和1 385 cm-1附近的吸收峰为N-H键的伸缩振动和弯曲振动特征峰,未掺杂尿素的TiO2仅在1 385 cm-1处有一尖锐的特征峰(曲线d),添加尿素之后,此峰明显宽化(曲线a 、b、c),宽化范围为1 000~1 500 cm-1,包含1 160 cm-1,1 430 cm-1,1 450 cm-1的N-Ti振动峰,很好地证明尿素参与了TiO2的制备过程,且成功掺杂入TiO2的晶格中[13-16]。
(a)不同硝酸体积配比
(b)不同二度热处理温度
(c)不同U-T摩尔比图2 不同制备条件下的样品红外吸收光谱图Fig.2 FT-IR spectra of samples prepared under different conditions
2.3 紫外-可见漫反射光谱分析
固体物质的颜色通常由其吸收边位置决定,吸收边红移使得固体物质对可见光产生吸收,从而产生颜色[17],本实验制备的TiO2粉末为白色,而掺杂N之后则呈现淡黄色,这是N成功掺杂进入TiO2结构中宏观的外在表象。
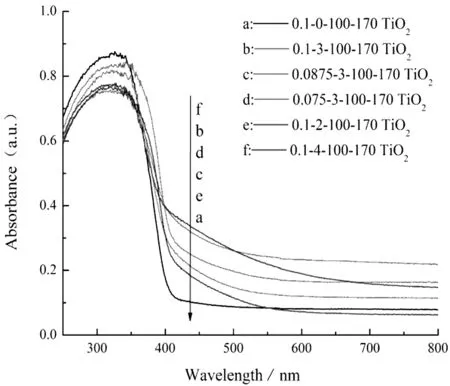
由图3(a)可知,空白样即未掺杂N元素的纯TiO2(0.1-0-100-170 TiO2),其在紫外光波段200~360 nm之间有较强的吸收性能,360 nm之后光吸收强度急剧下降,在400 nm之后的可见光区光吸收性能较为微弱且趋于平稳,这是由于TiO2的禁带宽度大约为3.2 eV,只能受到波长小于387 nm的紫外光激发才能产生光催化活性。对比空白样,不同条件下制备的N掺杂TiO2对可见光波段的吸收均有提高,N原子的掺杂缩小了TiO2的禁带宽度,拓宽其光吸收范围,导致了TiO2吸收带边的红移。这是由于N原子和O原子的半径较为接近,因此在制备的过程中,N原子取代了TiO2晶格中的部分O原子,形成N-Ti-O键,在TiO2的价带上方引入一个新的杂质能级,从而拓宽了TiO2对可见光的响应[18-19]。
由图3(a)可知,N元素的掺杂量对TiO2的光吸收具有一定程度的影响,掺杂量过高或过低时,样品对可见光的吸收性能均较低。这是由于掺杂量过低时,TiO2中没有足够的光生载流子捕获阱;而掺杂量过高时,则使得N原子无法有效地渗入TiO2晶格中,堆积在表面,占据了大量的催化活性位点,从而影响TiO2的光吸收能力[20]。这表明N原子的浓度须控制在一定合适的范围内,TiO2的带隙才能降低,从而提高其对可见光的利用率,本实验最佳U-T摩尔比为3。
由图3(a)也可以看出,不同的硝酸体积配比也能够影响改性TiO2的光吸收性能,结合XRD谱图分析结果,我们推测这是因为硝酸体积配比较低时,钛酸四丁酯的水解速率较快,无法形成良好的网络状钛醇盐凝胶,导致二度热处理之后TiO2晶化程度不高,并且生成的其它产物吸附在TiO2表面,影响其光吸收性能;当硝酸体积配比增大为0.1时,钛酸四丁酯的水解速率得到有效抑制,同时水合钛离子游离出的OH-与溶胶中的H+反应,生成相对稳定的Ti4+凝胶,有利于N掺杂的TiO2生成,相应的光吸收性能得到提升[21-22]。
图3(b)是不同二度热处理温度下的样品UV-Vis吸收光谱,在100 ℃干燥未经过二度热处理的样品在可见光区的吸收较为微弱(曲线a),随着热处理温度的升高,样品对于可见光的吸收呈先增后减的趋势,这是因为热处理温度过低时,N无法充分掺入TiO2晶格中,提高热处理温度可以促进N的掺杂,而热处理温度过高则会将加速前驱体表面的N源分解,造成N掺杂量的减少,从而导致对可见光的吸收减弱。本试验170 ℃(曲线b)和200 ℃(曲线c)二度热处理后的样品光吸收曲线较为接近,可选择能耗更低的170 ℃作为二度热处理温度。
(a)不同硝酸体积配比和U-T摩尔比
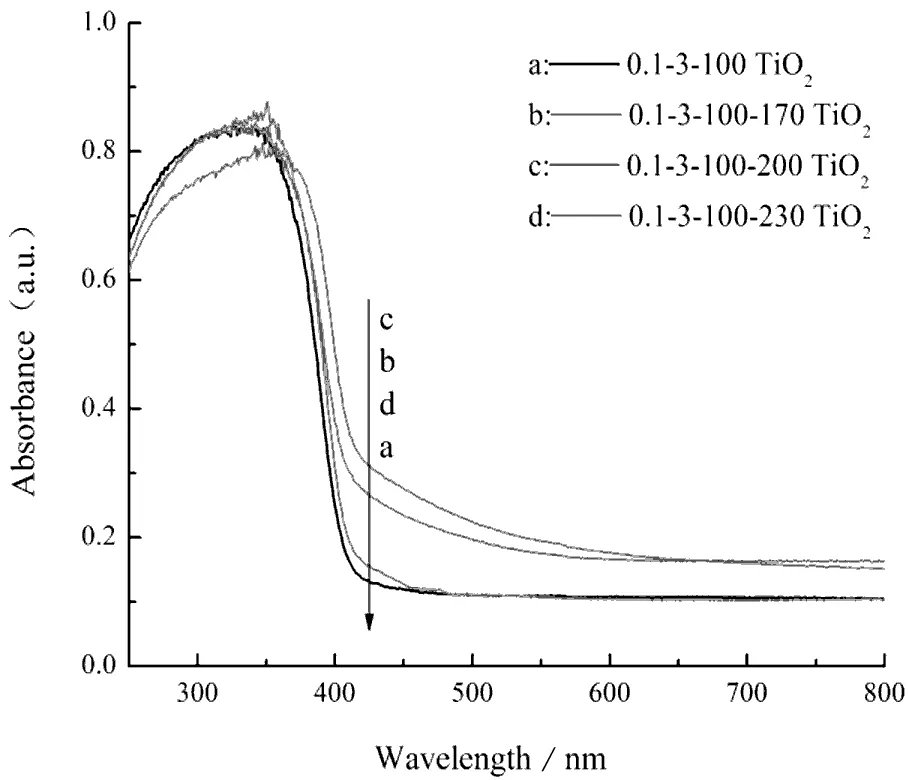
(b)不同二度热处理温度图3 不同制备条件下的样品紫外-可见漫反射光谱图Fig.3 UV-Vis DRS of samples prepared under different conditions
2.4 扫描电镜分析
为进一步了解样品的形貌特征,对样品0.1-0-100-170 TiO2和0.1-3-100-170 TiO2做了SEM表征,如图4所示。结果表明,N掺杂对TiO2的形貌并无特别明显的影响,所制备的样品主要呈类球形颗粒状,尺寸约为15~20 nm,略有团聚现象,这可能是由于颗粒的尺寸较小,比表面能增大所致。

(a)0.1-0-100-170 TiO2

(b)0.1-3-100-170 TiO2图4 TiO2扫描电镜图Fig.4 SEM images of TiO2
2.5 热重分析
图5是在改变硝酸体积配比和U-T摩尔比条件下制备的TiO2样品热重图。未掺杂尿素的TiO2(曲线a:0.1-0-100-170 TiO2)只有两个失重台阶,在200 ℃之前,损失量约为10 %,这是由于样品表面的吸附水脱附所引起的,在200~350 ℃之间,损失量为9 %,这是制备过程中残留有机物的燃烧损失;N掺杂TiO2的热重图基本形状都类似,也为两个失重台阶,样品在200 ℃之前的失重台阶,质量损失较为缓慢,损失量较少,这是由于样品表面附着水的损失,而在200~300 ℃之间的损失量较大,可能是由于低温制备的过程中所生成的杂质燃烧分解或者转化为TiO2所致,在300 ℃之后都趋于稳定状态,而随着尿素添加量的增加,其质量损失也呈增长趋势,表明过高的热处理温度会造成N源的分解挥发。
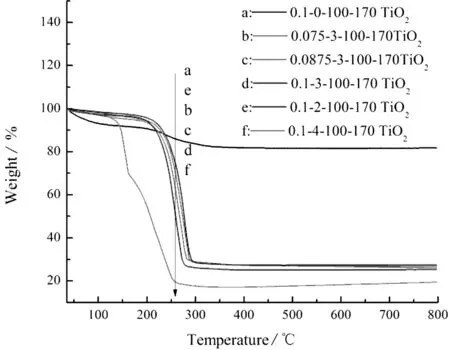
图5 样品的热重分析曲线Fig.5 TGA curves of samples
3 结论
本实验采用溶胶-凝胶法在较温和的反应条件下成功制备了N掺杂TiO2光催化剂,该法在硝酸体积配比为0.1,U-T摩尔比为3,二度热处理温度为170 ℃的条件下制备得到N-TiO2样品的结晶度高、且为锐钛矿相和金红石相的混晶结构,具有良好的可见光响应,并且制备过程无需复杂设备、成本低廉,为制备具有可见光活性的TiO2光催化剂提供了一种经济、便捷的方法。
[1] KUMAR S G, DEVI L G. Review on modified TiO2photocatalysis under UV/visible light: selected results and related mechanisms on interfacial charge carrier transfer dynamics[J]. Journal of Physical Chemistry A, 2011, 115(46): 13211-13241.
[2] HASHIMOTO K, IRIE H, FUJISHIMA A. TiO2Photocatalysis: A historical overview and future prospects[J]. Japanese Journal of Applied Physics, 2014, 44(12): 8269-8285.
[3] ASAHI R, MORIKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293(5528): 269.
[4] CHEN C, BAI H, CHANG C. Effect of plasma processing gas composition on the nitrogen-doping status and visible light photocatalysis of TiO2[J]. Journal of Physical Chemistry C, 2007, 111(42): 15228-15235.
[5] 邓仕英,刘长生.微波掺氮改性纳米二氧化钛的研究[J].化学与生物工程, 2012, 29(3): 13-17.
[6] MOHAMED M A, SALLEH W N W, JAAFAR J, et al. Photodegradation of phenol by N-Doped TiO2, anatase/rutile nanorods assembled microsphere under UV and visible light irradiation[J]. Materials Chemistry & Physics, 2015, 162:113-123.
[7] 因博,王际童,徐伟,等.中孔炭负载二氧化钛光催化剂的制备及降解甲基橙[J].新型炭材料,2013,28(1):47-54.
[8] 黄涛,张国亮, 王玲,等.以尿素为氮源制备氮改性二氧化钛及其改性机理[J].催化学报,2011,32(3):508-512.
[9] 杨辉,乾宏,高基伟.锐钛矿-金红石混晶TiO2溶胶的制备及光催化性能[J].稀有金属材料与工程,2008,37(s2):201-204.
[10] 曾爱香,罗丽,胡凯龙.溶胶-凝胶法制备纳米TiO2粉体的研究进展[J].材料导报,2013,27(19):23-28.
[11] PERIYAT P, MCCORMACK D E, HINDER S J, et al. One-pot synthesis of anionic (Nitrogen) and cationic (sulfur) codoped high-temperature stable, visible light active, anatase photocatalysts[J]. Journal of Physical Chemistry C, 2009, 113(8): 3246-3253.
[12] 吴晶,高攀,朱忠其,等.镨和氮共掺杂纳米TiO2光催化剂的制备与性能[J].中国有色金属学报,2011,21(6):1480-1484.
[13] 李海燕,曹玉辉,张敏,等.N掺杂TiO2纳米粉体的制备及其可见光催化性能[J].化学研究,2013(3):247-251.
[14] LIU X W, CHEN Y, CHEN C B, et al. Preparation and photocatalytic activity of nitrogen-doped nano TiO2/tourmaline composites[J]. Journal of Materials Engineering, 2016, 44(6): 104-109.
[15] 王全忠,刘华,刘亚丽,等.氮掺杂纳米TiO2的制备及其光催化活性[J].钢铁钒钛,2017,38(2):59-63.
[16] 霍爽,董旭峰,齐民,等. TiO2/尿素核壳纳米颗粒的制备及其电流变性能[J].功能材料,2015,46(5):5147-5150.
[17] JOSHI M M, MANGRULKAR P A, TIJARE S N, et al. Visible light induced photoreduction of water by N-doped mesoporous titania[J]. Applied Catalysis A: General, 2012, 37(13): 10457-10461.
[18] PELAEZ M, FALARAS P, LIKODIMOS V, et al. Synthesis, structural characterization and evaluation of sol-gel-based NF-TiO2, films with visible light-photoactivation for the removal of microcystin-LR[J]. Applied Catalysis B: Environmental, 2010, 99(3): 378-387.
[19] JING W U, PAN G, ZHU Z Q, et al. Preparation and properties of praseodymium and nitrogen co-doped nano-titanium dioxide photocatalyst[J]. Chinese Journal of Nonferrous Metals, 2011, 21(6): 1480-1484.
[20] 蔡莉,张姝.尿素为氮源N-TiO2的制备、表征及光催化性能[J].分子催化,2012,26(2):184-191.
[21] 姜聚慧,朱琳芳,王慧,等.制备条件对Bi3+掺杂纳米TiO2光催化性能的影响[J].化学研究与应用,2011,23(6):707-711.
[22] WANG X, WU Q F, XUAN S F. Evenly supported TiO2on activated carbon fiber and its photocatalytic degradation property[J]. Advanced Materials Research, 2011, 239-242: 1637-1642.
